分散液液微萃取与超高效液相色谱-串联质谱联用测定土壤和沉积物中三丁基锡
2014-03-27胡文凌余卫娟翟云云陈利群江胜良
胡文凌,庞 明,余卫娟,翟云云,陈利群,江胜良,蒋 玮
1.嘉兴市环境保护监测站,浙江 嘉兴 314000 2.嘉兴学院生物与化学工程学院,浙江 嘉兴 314000
三丁基锡是目前已知的内分泌干扰物质之一,可干扰哺乳动物的内分泌,导致生育力下降、胚胎畸形、生长发育迟缓,也可使动物性成熟和繁殖推迟,引起动物性畸变[1]。由于三丁基锡具有防腐、杀菌、防霉等作用,主要应用于木材防腐和船舶油漆等,并可通过各种途径进入到环境中,在土壤和沉积物中均有检出[2-3]。
目前三丁基锡的分析检测主要采用色谱分离技术与高灵敏的检测器联用,包括气相色谱火焰光度法[4]、气相色谱质谱联用法[5]、气相色谱-微波诱导等离子体发射光谱法[6]、液相色谱荧光法[7]、液相色谱-电感耦合等离子体质谱法[8]和液相色谱质谱联用法[9]等。采用气相色谱法进行分离时需要衍生化处理,操作烦琐费时,而液相色谱法则无需衍生化步骤,具有操作简单、分析速度快等优点。
三丁基锡因在土壤和沉积物中的浓度较低,需要采用适合的样品前处理技术进行浓缩富集。分散液液微萃取(DLLME)是Rezaee 等[10]于2006 年建立的一种环境友好型的前处理技术,该技术集萃取和浓缩于一体,具有溶剂用量少,操作简单、快速、成本低和富集效率高等优点,结合各种分离检测技术已被应用于环境[11-12]、食品[13]和生物[14]等领域。
该文采用分散液液微萃取法与超高效液相色谱-串联质谱联用,建立了土壤和沉积物中三丁基锡测定的新方法。
1 实验部分
1.1 仪器与试剂
超高效液相色谱-串联质谱(ACQUITY UPLC-TQD,美国);2 mL 进样瓶,内置带聚合物支脚的250 μL 锥形玻璃内插管;KQ 2200DE 型数控超声波清洗仪。
甲醇、甲酸、氯苯和四氯乙烯为色谱纯;氯仿和四氯化碳为分析纯;三丁基氯化锡标准品(96.5%,德国);三丁基锡的标准储备液:准确称取适量三丁基氯化锡,用甲醇稀释,配制成1 000 mg/ L(以锡计)的储备液。
实验室用水均为CascadaTMAN 超纯水仪所制超纯水。
1.2 实验方法
1.2.1 色谱条件
色谱柱为BEH C18柱(50 mm × 2.1 mm,1.7 μm,美国),柱温30 ℃。流动相:A相为0.1% 甲酸水溶液,B相为甲醇。梯度洗脱程序:0 ~ 1 min,5% B;1~2 min,5%~100% B;2~3 min,100% B;3~4 min,5%~100% B;4 ~ 6 min,5% B。流速0.3 mL/min,进样量5 μL。
1.2.2 MS/MS 质谱条件
电喷雾离子源,正离子电离(ESI+),多反应监测(MRM),毛细管电压3.75 kV;离子源温度120 ℃;脱溶剂气温度350 ℃;脱溶剂气流量650 L/h;锥孔气流量50 L/h;锥孔电压30 V;定量和定性离子对(碰撞能量)分别为m/z291.4 > 235.2(10 V)和291.4 > 179.2(18 V)。
1.2.3 分散液液微萃取萃取步骤
将土壤和沉积物样品中的树叶、树枝或石子等异物去除,称取约20.0 g(准确至0.1mg)样品于具塞锥瓶中,加入丙酮-水(体积比1∶5)混合溶液100 mL,以100 W的超声功率超声提取30 min,静置后将上层清液经0.45 μm 滤膜抽滤,移取5.00 mL 滤液于具塞锥形离心管中,加入0.15 g NaCl,溶解后,缓慢加入一定体积的萃取溶剂和分散剂的混合溶液,摇匀,形成一个乳浊液体系,致使溶液变混浊,以4 000 r/min 离心5 min,分散在水相中的萃取溶剂通过离心后沉积到试管底部,用微量注射器将沉淀在管底的沉积相吸出,并转移到带内插管的样品瓶中,于UPLC-MS/MS 自动进样测定。
1.2.4 标准样品配制
除去土壤样品中的异物,风干后过0.15 mm孔径筛。将过筛的土样分别用甲醇和丙酮超声洗涤30 min,再用超纯水超声洗涤后离心,干燥后碾碎,制成土壤空白基体。称取土壤空白基体20.0 g样品,加入三丁基锡标液后得到5.00 μg/kg(以锡计)的标准土壤样品,用于分散液液微萃取的条件优化。
2 结果与讨论
影响分散液液微萃取性能和效率的因素很多,其中主要包括萃取剂的种类和体积、分散剂的种类和体积、萃取时间和盐效应。优化这些实验参数是获得良好萃取回收率和高富集倍数的关键。该文考察了这些参数的影响,采用萃取后沉积相中三丁基锡在仪器上的响应值,即色谱峰面积来评价各实验参数,优化和选择了最佳的实验条件。
2.1 萃取剂的种类
分散液液微萃取的萃取溶剂是影响萃取效率的重要因素,实验考察了氯仿、四氯化碳、四氯乙烯和氯苯4 种萃取溶剂的萃取效果。为了消除沉积相体积不同对萃取结果的影响,采用0.50 mL 丙酮含不同体积的萃取剂作为萃取混合相以获得(18.0 ± 0.5)μL的沉积相体积,萃取剂体积分别为氯仿40.0 μL、四氯化碳37.0 μL、四氯乙烯32.0 μL 和氯苯30.0 μL。实验发现,以氯苯作为萃取溶剂时,沉积相中的三丁基锡的响应值最大,萃取效率最佳,因此选择氯苯作为萃取剂。
2.2 萃取剂的体积
为了考察萃取剂体积对萃取效率的影响,在分散剂丙酮体积均为0.50 mL 的条件下,加入25.0 ~ 40.0 μL 氯苯,实验结果见图1。当氯苯体积为25.0 ~ 30.0 μL 时,随着氯苯体积的增加,沉积相中三丁基锡的响应值变化不大;但氯苯体积小于30.0 μL 时,方法的精密度较差;当氯苯体积大于30.0 μL 时,由于稀释效应,沉积相中三丁基锡的响应值逐渐降低,从而会导致富集倍数下降。因此,选择萃取剂的体积为30.0 μL。
2.3 分散剂的种类
分散剂的选择应考虑萃取溶剂在分散剂中具有良好的溶解性,同时分散剂还要能与水互溶,以使萃取溶剂在水相中能分散成细小的液滴,增大其与待测物的接触面积,从而提高萃取效率。实验选择丙酮、乙腈和甲醇作分散剂,考察不同分散剂对三丁基锡萃取效率的影响。实验结果表明,丙酮、甲醇和乙腈作分散剂时,沉积相中三丁基锡的浓度变化不大,即所选的3种分散剂对三丁基锡的萃取效率影响不大,考虑到丙酮的毒性小且成本低,选择丙酮为分散剂。

图1 氯苯体积对萃取效率的影响
2.4 分散剂的体积
分散剂的体积会影响萃取剂在水中的分散程度,从而影响萃取效率,体积过小,萃取剂不能均匀地分散在水相中,无法形成良好的乳浊液体系,而分散剂体积过大,会增加待测物在水中的溶解度。实验考察了分散剂丙酮体积对萃取效率的影响,分别以含有26.0、28.0、30.0、32.0、33.0、35.0、39.0 、43.0 μL 氯苯的0.20、0.35、0.50、0.65、0.80、1.00、1.50、2.00 mL 丙酮作为分散体系,以使沉积相体积保持为(18.0 ± 0.5)μL,实验结果见图2。当丙酮体积为0.50 mL 时,三丁基锡的响应值达到最大,此后随着丙酮体积的增加,三丁基锡的响应值逐渐降低。该法选择分散剂丙酮体积为0.50 mL。
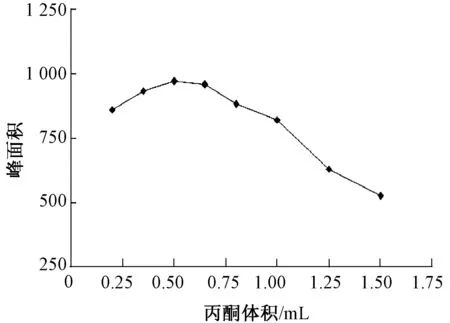
图2 丙酮体积对萃取效率的影响
2.5 萃取时间
考察了萃取时间为0 ~ 30 min 时的萃取效率。实验结果表明,萃取时间对萃取效率的影响不大,主要是因为萃取剂以极细微的液滴形态分散于水溶液中,萃取剂和水相的接触面积非常大,三丁基锡能够快速地从水相转移到有机相中并达到萃取平衡,这正是分散液液微萃取所具备的最大的一个优点。
2.6 盐效应
水溶液中盐的加入会使待测物在水相中的溶解度降低,从而提高萃取效率,但由于盐浓度的增加也使得有机萃取剂在水相中的溶解度减小,沉积相体积增大,方法的富集倍数会降低。实验通过在水相中加入NaCl(0~10%)的方法考察了盐含量对萃取效率的影响。实验结果表明,当加入的NaCl质量分数为0~3%时,沉积相中三丁基锡的响应值没有明显变化,当NaCl质量分数大于3%时,三丁基锡的响应值稍有下降,富集倍数降低。故选择加入3%的NaCl。
2.7 方法的线性范围、检出限和富集倍数
在优化的实验条件下,对三丁基锡标准系列进行测定,方法在0.5 ~ 50 μg/kg范围内线性关系良好,相关性系数为0.999 0,方法检出限(3倍信噪比)为0.1 μg/kg,标样色谱图见图3。

图3 标样色谱图
2.8 样品分析
实际样品取菜地土壤和嘉兴市某河道沉积物,同时向土壤和沉积物样品中加入一定量标准溶液进行加标回收实验,平行测定6 次,计算加标回收率和相对标准偏差,结果见表1。
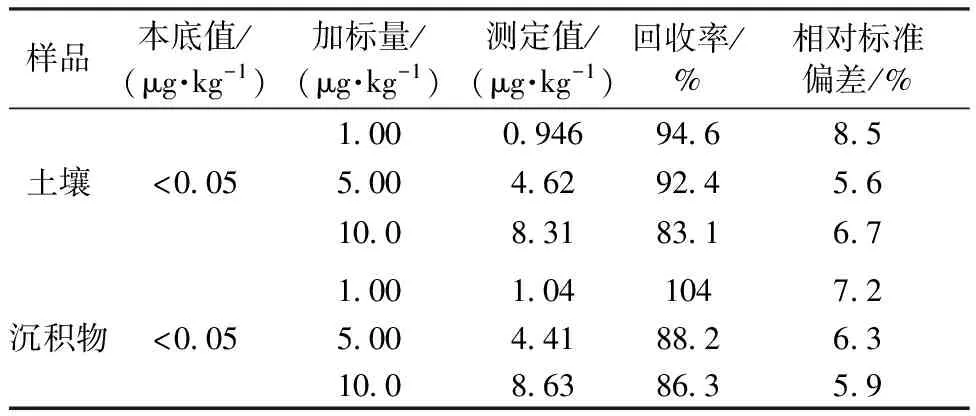
表1 实际样品的分析结果(n=6)
3 结论
建立了分散液液微萃取和超高效液相色谱-串联质谱联用测定土壤和沉积物中三丁基锡的方法,并通过实验确定了分散液液微萃取的最佳条件:30.0 μL 氯苯为萃取溶剂,0.50 mL 丙酮为分散剂,NaCl质量分数为3%。该方法具有线性范围宽、检出限低、重现性好、操作简便及样品处理耗时短等优点,应用于实际样品分析,加标回收率为83.1%~104%,精密度(n=6)为5.6%~ 8.5%,可以满足土壤和沉积物中三丁基锡的分析要求。
[1] 熊振湖,黄国兰.内分泌干扰物三丁基锡诱导的腹足纲动物性畸变现象[J].环境科学研究,2002,15(3):56-60.
[2] Julien H, Tea Z, Maïé B,et al.Analytical advances in butyl-, phenyl- and octyltin speciation analysis in soil by GC-PFPD[J].Talanta,2008,75:486-493.
[3] Barbara R,Leszek,Andrzej W,et al.The content of butyl- and phenyltin derivatives in the sediment from the Port of Gdansk[J].Chemosphere,2008,73(3):407-414.
[4] Afsoon P B,Araz B,Fatemeh R,et al.Speciation of butyl and phenyltin compounds using dispersive liquid-liquid microextraction and gas chromatography-flame photometric detection[J].Journal of Chromatography A,2008,1193(1/2):19-25.
[5] Cacho J I,Campillo N,Vias P,et al.Headspace sorptive extraction for the analysis of organotin compounds using thermal desorption and gas chromatography with mass spectrometry[J].Journal of Chromatography A,2013,1 279:1-6.
[7] González-Toledo E,Compaó R,Granados M,et al.Determination of butyltin and phenyltin species by reversed-phase liquid chromatography and fluorimetric detection[J].Journal of Chromatography A,2000,878(1):69-76.
[8] Yu Z H,Zhang J,Wang X R.Speciation Analysis of Organotin Compounds in Sediment by Hyphenated Technique of High Performance Liquid Chromatography-Inductively Coupled Plasma Mass Spectrometry[J].Chin J Anal Chem,2011,39(4):544-547.
[9] Zhu S S,Hu F T,Yang T,et al.Synthesis and characterization of a molecularly imprinted polymer for the determination of trace tributyltin in seawater and seafood by liquid chromatography-tandem mass spectroscopy[J].Journal of Chromatography B,2013,921/922:21-26.
[10] Rezaee M,Assadi Y,Milani H R,et al.Determination of Organic Compounds in Water using Dispersive Liquid-Liquid Microextraction[J].Journal of Chromatography A, 2006,1 116(1/2):1-9.
[11] Isela L,Sandra G,Marta C,et al.Dispersive Liquid-Liquid Microextraction Combined with Microvolume Spectrophotometry to Turn Green the 5530 APHA Standard Method for Determining Phenols in Water and Wastewater[J]. Talanta, 2012, 98:197-202.
[12] 张瑶,苏萍,钟秋,等.分散液液微萃取富集土壤中的二嗪磷和甲拌磷残留[J].分析科学学报,2013,29(1):17-20.
[13] Constantinos K Z,Ilias R,Petros G Z,et al. Dispersive liquid-liquid microextraction for the determination of organochlorine pesticides residues in honey by gas chromatography-electron capture and ion trap mass spectrometric detection[J]. Food Chemistry,2012,134(4):1 665-1 672.
[14] 丁宗庆,刘光东.分散液液微萃取-数码比色法测定环境及生物样品中亚硝酸根[J].分析化学,2009,37(1):119-122.
