长期饲喂高精料日粮对泌乳期山羊血液生化参数及组织中糖代谢相关基因表达的影响
2014-03-26董海波王绍庆贾媛媛端木永前陶诗煜倪迎冬张源淑庄苏沈向真赵茹茜
董海波,王绍庆,贾媛媛,端木永前,陶诗煜,倪迎冬,张源淑,庄苏,沈向真,赵茹茜
(南京农业大学 农业部动物生理生化重点开放实验室,江苏 南京210095)
亚急性瘤胃酸中毒的典型特征是摄食后瘤胃液pH在5.2~5.6之间并持续至少3h/d[1]。这种代谢紊乱的出现通常是由于动物摄入过量的可快速发酵的碳水化合物,而瘤胃不能及时中和其发酵产生的有机酸所致[2-4]。Fairfield等[5]研究表明约20%的商业化奶牛牧场中泌乳早期及中期奶牛瘤胃pH<5.5,出现亚急性瘤胃酸中毒(SARA)状态,导致牧场每头牛每天损失约1.12美元,因此SARA已经成为乳业的主要关注问题之一。增加奶牛能量摄食是缓解奶牛热应激的重要措施,提高精料喂量,可在一定程度上增加能量摄入,提高养分消化率,改变氨基酸的代谢流向,缓解能量负平衡,但易引起奶牛代谢热增加和瘤胃酸中毒[2,6]。然而,在生产中由于亚急性瘤胃酸中毒的诊断复杂性故不易被准确诊断出,目前主要以瘤胃液的pH变化作为主要的诊断依据[7-8]。尝试一些其他组织的探索(如血液的代谢参数变化)从中找出相应的关键指标指示亚急性瘤胃酸中毒状态也越来越被重视[9-10]。
有研究报道亚急性瘤胃酸中毒会导致乳产量下降,脂代谢和蛋白代谢发生变化特别是乳脂与乳蛋白含量的变化[4,11-12]。然而,目前有关SARA状态时糖代谢的研究报道较少。动物机体负责能量代谢的主要器官和组织包括肝脏,肌肉以及脂肪组织。葡萄糖是动物机体重要的能源物质和代谢底物,主要通过食物摄取以及组织合成,如肝脏,肌肉等。肝脏是调节机体能量平衡尤其是糖、脂代谢的主要器官,对营养分配起着重要作用[13],反刍动物肝脏是糖异生的主要场所[14]。肝脏中葡萄糖的转运与葡萄糖转运蛋白2(Glut2)的表达呈正相关,但Glut2的表达与各种激素的控制也密不可分[15]。肌肉是维持机体机动性与代谢健康的基本组织,其代谢稳态在机体遭遇代谢应激时(包括饮食与锻炼)会通过调控肌肉线粒体数量与功能以及葡萄糖代谢的变化以适应不同的应激[16]。肌肉中葡萄糖转运蛋白4(Glut4)作为胰岛素敏感性葡萄糖转运载体可以减少外周血葡萄糖水平的上升[17]。有研究报道不同的动物或者人类肥胖模型均展现出脂肪组织中Glut4的表达下降,而不是肌肉[18]。此外,脂肪作为能量储备的重要组织,在机体能量代谢不足时被分解供能,对机体的能量平衡起着重要作用,脂肪能值高,可以启动能量代谢调节系统,有利于奶牛能量平衡[19]。本研究旨在模拟实际生产中的饲喂模式,通过长期饲喂高精料日粮,初步探索其对泌乳期反刍动物能量代谢的血液生化参数和相关基因表达的影响。
1 材料与方法
1.1 试剂与仪器
TRIzol?Reagent购自上海英俊生物技术有限公司;SYBR?Premix Ex TaqTM购自Takara公司;冷冻离心机(AllegraTM64R,BECKMAN COULTERTM,USA);组织匀浆器;PCR仪(STRATAGENE,USA);酶标仪(Synergy2,Biotek,USA);NanoDrop TM1000sepctrophotometer(Thermo Scientific,USA)。
1.2 试验动物与饲养
本实验于2013年6月2日开始选用健康状况良好,体重(47±8)kg的泌乳期山羊8只,手术安装永久性瘤胃瘘管,恢复期为14d,随机分成2组(4只/组)饲养于南京农业大学实验动物房,单笼饲养,分别饲喂精粗比为40∶60和60∶40的日粮,自由饮水,每日饲喂时间为早08:00和晚18:00。
1.3 试验设计
本试验随机分为2组,分别饲喂精粗比40∶60(LC)和60∶40(HC)日粮(由羊草、苜蓿草和精料组成),粗料由20%苜蓿草和80%羊草组成。2组日粮总能量和总蛋白含量相等。试验期包括适应期2周和采样期6周。饲料营养成分同以往研究报道[20]。
1.4 样品采集处理与分析测定
1.4.1 瘤胃液采集和处理 实验结束后分别于采食前0h,以及采食后1,2,3和5h通过瘤胃瘘管采集瘤胃液10mL(经孔径为0.15mm尼龙绢过滤),测定pH值。
1.4.2 肝脏,肌肉,脂肪的采集、RNA的提取及Real-time PCR 实验结束将山羊宰杀后采集肝脏,肌肉,脂肪并迅速置于液氮中保存,待提取RNA。采用TRIzol一步法提取样品总RNA,NanoDropTM1000分光光度法测定总RNA的浓度和纯度,2%琼脂糖凝胶电泳验证RNA质量,-70℃保存备用。反转录酶体系及Tap酶为Promega产品,SYBR?购自TaKaRa公司。引物采用Primer 5.0软件自行设计,由上海捷瑞生物工程有限公司合成,引物列表见表1。
实时荧光定量分析采用2-ΔΔCT法,以内标基因β-actin为参照,计算目的基因转录的相对量,通过以下公式计算出每一个样本的ΔΔCT值,最后每一个样本值以2-ΔΔCT表示。X表示任意一个样本,公式如下:
1.5 数据统计与分析
采用SPSS 17.0软件进行单变量双因素分析,主效应分别为日粮处理和采样时间;用ANOVA进行方差分析。
2 结果与分析
2.1 不同精粗比日粮对瘤胃液pH的影响
双因素(日粮效应与时间效应)分析结果显示(图1),日粮和采食后发酵时间显著影响瘤胃液pH(P<0.05)。高精料饲喂2周后,摄食后山羊瘤胃液pH低至5.2~5.8,持续时间超过3h(图1A),符合瘤胃亚急性酸中毒的状态,而LC组山羊瘤胃液pH处于正常变动范围。然而,高精料饲喂8周后,瘤胃液pH升高,采食后瘤胃pH均高于6.0,但仍低于LC组山羊(图1B)。
2.2 不同精粗比日粮对血液生化指标的影响
由表2显示,与LC组相比较,HC组山羊血浆中谷草转氨酶浓度有上升的趋势(P=0.09),血糖含量显著升高(P<0.05),血液中游离脂肪酸(NEFA)浓度有上升的趋势(P=0.071)(图2),但血液中甘油三酯和胆固醇的含量无显著变化。

表1 目的基因序列Table 1 The primer sequences of the target genes
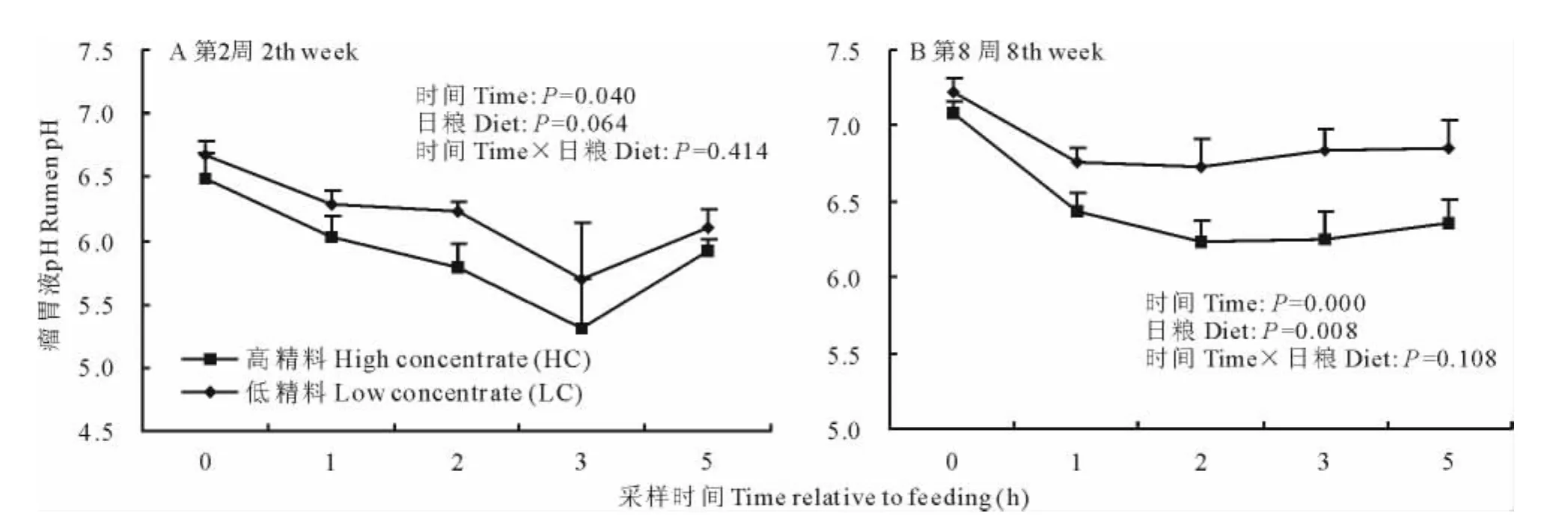
图1 不同精粗比日粮对瘤胃液pH的影响Fig.1 Effect of different concentrate ratio diets on rumen pH
2.3 糖代谢相关基因mRNA表达变化
如图3所示,与LC组相比,HC组山羊肝脏中葡萄糖转运蛋白Glut4mRNA表达有升高的趋势(P=0.06,图3),肌肉中PCK2mRNA表达和脂肪组织中PC mRNA表达呈上升趋势(P=0.066,P=0.069),其他糖代谢相关基因的表达未见显著性变化(P>0.05)。
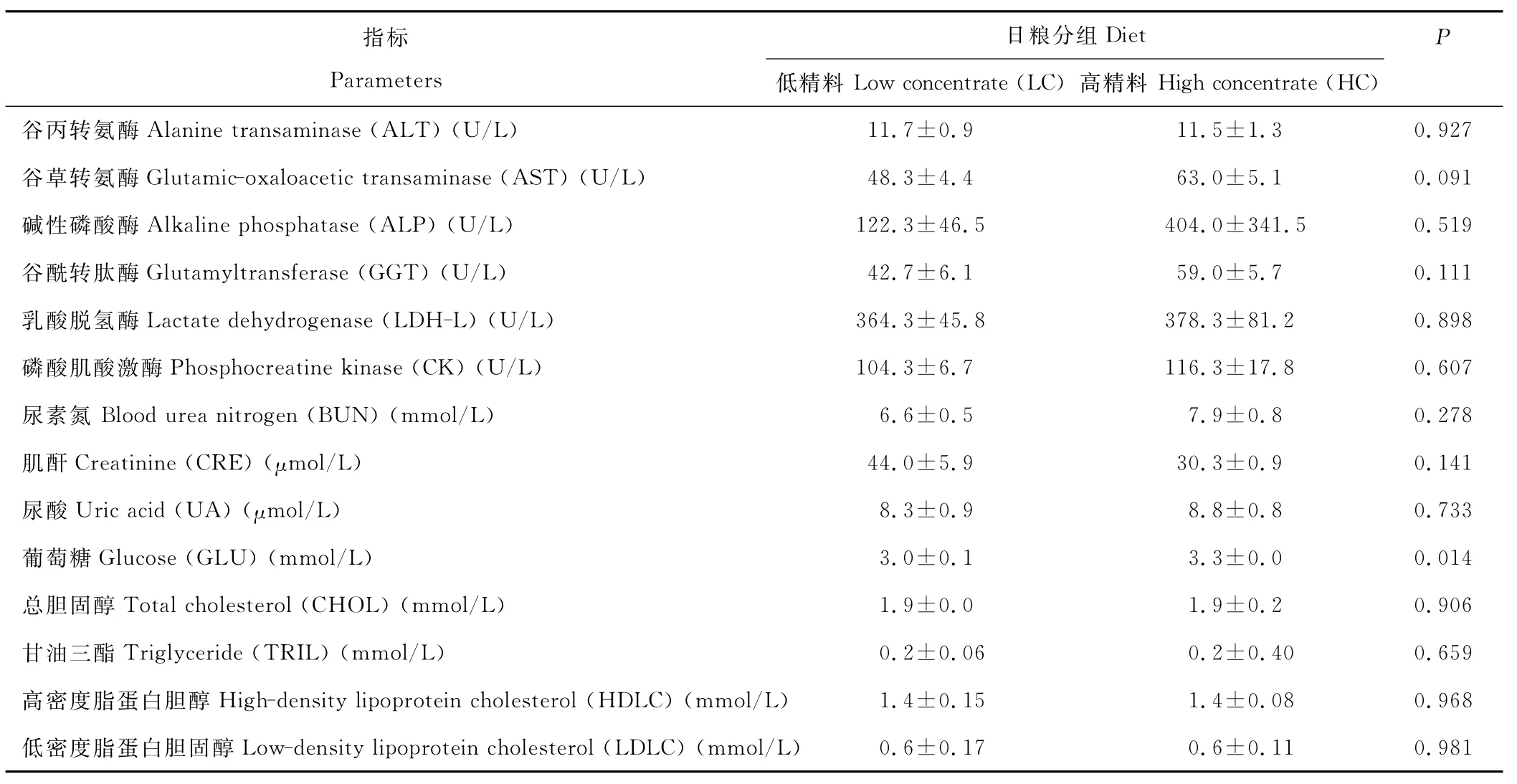
表2 血液生化指标Table 2 The plasma biochemical index

图2 不同精粗比日粮对血浆中非饱和脂肪酸(NEFA)的影响Fig.2 The effect of different concentrate ratio on NEFA of plasma
如图4所示,在LC组中不同组织间Glut4,PC和PCK2基因的表达有差异。肝脏和肌肉组织相比,肌肉中Glut4mRNA表达丰度最高,达极显著水平(P<0.01);而肝脏中PC和PCK2mRNA表达丰度极显著高于肌肉和脂肪组织(P<0.01),脂肪组织中PCK2表达量显著高于肌肉组织(P<0.05)。
3 讨论
3.1 不同精粗比对瘤胃液pH及血液生化指标的影响
为了满足泌乳的能量需求和提高泌乳性能,通常给泌乳反刍动物饲喂富含能量的高精料日粮;然而摄入过多的可快速发酵的碳水化合物易导致瘤胃中挥发性脂肪酸的沉积,以及异常代谢产物如脂多糖(LPS)和组胺的累积,从而导致泌乳早期和中期瘤胃亚急性瘤胃酸中毒[2,21-23]。本研究发现,给泌乳中期奶山羊饲喂60%精料日粮2周后,瘤胃液pH<5.8并持续3h/d以上符合亚急性瘤胃酸中毒的界定范围,与以往的研究结果相吻合[21,24]。然而,高精料饲喂8周后山羊采食后瘤胃液pH升高至6.0以上,但仍低于LC组山羊。以上结果提示瘤胃组织对长期饲喂高精料日粮出现适应现象[25]。此外,有文献报道苜蓿(Medicagosativa)是高果胶(5%~10%)饲料,且富含钙、钾等碱性元素,具有较强的缓冲能力,果胶虽在瘤胃中降解快,但发酵产物是半乳糖醛酸,抑制了酸性乳酸菌的发酵,从而有助于瘤胃液pH值的稳定[26]。
谷丙转氨酶(ALT)和谷草转氨酶(AST)是动物体内最为重要的2种转氨酶,主要分布在肝脏、骨骼肌、肾脏、心肌等组织中,正常血清中含量低,但当上述组织细胞受损时,会导致酶活性升高[27]。本研究通过检测血液生化指标发现,与LC组相比HC组山羊血液ALT无显著变化,但是AST有上升的趋势。这可能与机体为适应泌乳等生理需要,通过自身调节增强机体组织(如脂肪动员、蛋白动员等)代谢,导致AST活性增加有关[28]。此外,血液AST的增加也可能提示HC组山羊组织器官的损伤,如氧化应激损伤[29]。与LC组相比,HC组山羊血浆中NEFA有升高的趋势,血浆葡萄糖的含量显著升高。研究证明,血浆中NEFA的含量常被用于衡量机体能量状态,NEFA升高提示动物机体能量暂时供应不足[30],这可能是与长期饲喂高精料日粮导致食欲抑制有关[31]。当能量摄入不足时,为了改善营养缺乏,奶牛会动用体内储备的脂肪和蛋白质满足泌乳需要,如奶牛动用体脂满足能量需要,动用体蛋白质分解为氨基酸去满足肝糖异生[32]。葡萄糖作为乳糖合成的底物被乳腺摄取最终决定着奶产量的多少,而葡萄糖的主要来源则是肝脏糖异生。有研究报道,饲喂高精料日粮后引起反刍动物肝脏糖异生加强并伴随血液中葡萄糖含量显著上升[9-10],与本研究结果相吻合。

图3 不同精粗比日粮对不同组织中糖代谢相关基因mRNA表达的影响Fig.3 The effect of different concentrate diet on mRNA expression of glucose metabolic genes in different tissues
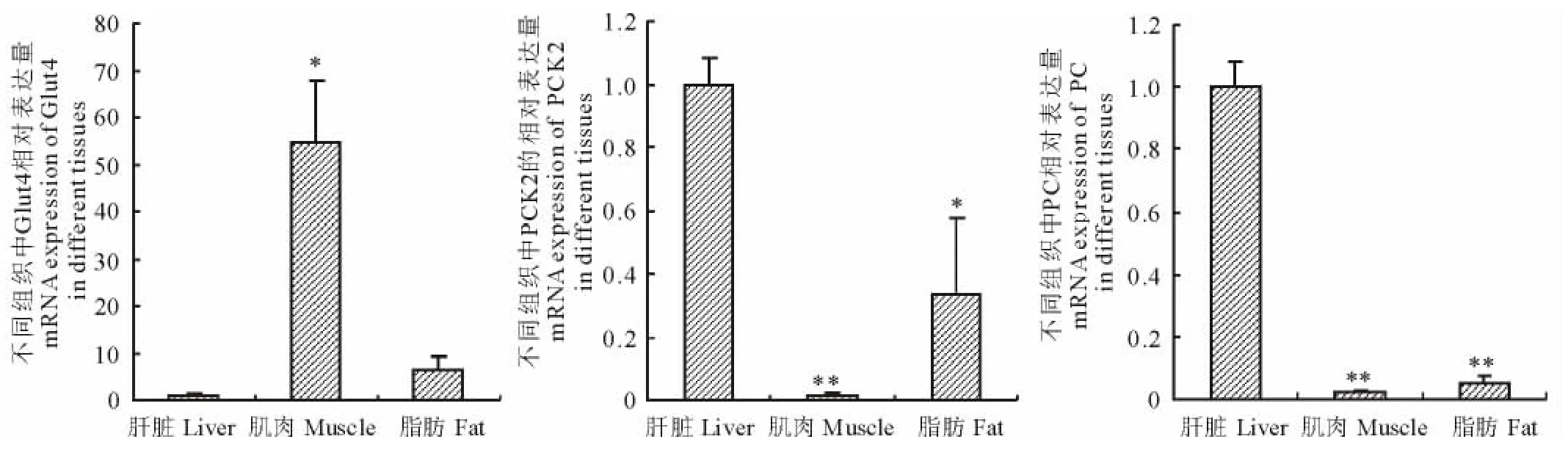
图4 LC组中不同组织间糖代谢相关基因mRNA表达变化Fig.4 The effect of low concentrate diet on mRNA expression of glucose metabolic genes between different tissues in LC group
3.2 不同精粗比日粮对不同组织糖代谢相关基因表达的影响
肝脏对机体能量平衡起到重要作用,是糖酵解、糖原合成以及脂肪生成的重要位点[32]。特别是反刍动物,肝脏是提供乳糖合成所需葡萄糖来源的主要场所,占糖异生的80%[14,33]。本研究发现,长期饲喂高精料日粮后HC组肝脏中与糖分解或合成代谢相关的基因均未发生显著变化,与葡萄糖转运相关的蛋白Glut2基因表达也未发生变化,但胰岛素敏感性葡萄糖转运蛋白Glut4mRNA表达有上调趋势。以往研究报道,葡萄糖转运蛋白Glut家族中,Glut2主要分布在肝脏、肾以及胰腺β细胞;Glut4则主要分布在肌肉与脂肪组织中[34],关于反刍动物肝脏中表达Glut4的报道甚少。本研究发现Glut4在肝脏中表达并有上升趋势,说明Glut4也可能参与到肝脏糖异生及外周血液葡萄糖代谢变化。有研究指出肌肉中葡萄糖转运蛋白4(Glut4)作为胰岛素敏感性葡萄糖转运载体可以减少外周血葡萄糖水平的上升,但肝脏中Glut4表达上升是否与血糖上升有关还不清楚,血糖的升高可能是机体能量代谢变化的综合结果。此外,通过组织间比较发现,肌肉中Glut4mRNA表达最高,其表达丰度是肝脏的54倍,这与以往的研究报道相一致[15]。
泌乳期尤其是泌乳早期的反刍动物,通常处于能量负平衡状态,血液胰岛素含量升高并出现肌肉与脂肪组织胰岛素抵抗现象[14]。有研究报道,高水平胰岛素有抑制糖异生的作用[34]。本研究发现,肌肉与脂肪中糖代谢的关键酶PCK2和PC的表达量均有上升的趋势。PEPCK是糖异生的限速酶,有2个亚型即PCK1和PCK2分别位于胞浆和线粒体内[35],PCK1较适合于以氨基酸为底物的糖异生,而PCK2则较适合于以乳酸为底物的糖异生[36]。本研究发现肌肉中PCK2基因表达有上升趋势,提示以乳酸为底物的糖异生加强。肌肉乳酸的升高也可能会为肝脏提供更多糖异生所需的碳源[14]。PC是糖异生的另一个关键酶,与PEPCK一起直接控制代谢产物。泌乳期奶牛为了增加泌乳量需要通过增强PC的表达提高内源性葡萄糖的产生[14]。本研究结果提示,HC组山羊脂肪组织中PC基因表达上升可能是血糖升高的原因之一。此外,本研究发现,肝脏PC及PCK2mRNA表达均显著高于肌肉和脂肪组织,这可能与反刍动物肝脏的特殊功能有关。反刍动物肝脏是利用来自瘤胃液丙酸异生成葡萄糖的主要场所[14]。
4 结论
长期饲喂高精料日粮导致泌乳期山羊血液NEFA,AST和葡萄糖含量升高,以及肝脏、肌肉和脂肪组织中参与糖异生关键基因的表达上调,提示机体代谢紊乱及糖异生增强。
[1] Gozho G N,Plaizier J C,Krause D O,etal.Subacute ruminal acidosis induces ruminal lipopolysaccharide endotoxin release and triggers an inflammatory response[J].Journal of Dairy Science,2005,88:1399-1403.
[2] Dong G,Liu S,Wu Y,etal.Diet-induced bacterial immunogens in the gastrointestinal tract of dairy cows:impacts on immunity and metabolism[J].Acta Veterinaria Scandinavica,2011,53:48.
[3] Rustomo B,AlZahal O,Odongo N E,etal.Effects of rumen acid load from feed and forage particle size on ruminal pH and dry matter intake in the lactating dairy cow[J].Journal of Dairy Science,2006,89:4758-4768.
[4] Plaizier J C,Krause D O,Gozho G N,etal.Subacute ruminal acidosis in dairy cows:the physiological causes,incidence and consequences[J].Veterinary Journal,2008,176:21-31.
[5] Fairfield A M,Plaizier J C,Duffield T F,etal.Effects of prepartum administration of a monensin controlled release capsule on rumen pH,feed intake,and milk production of transition dairy cows[J].Journal of Dairy Science,2007,90:937-945.
[6] 王建平,王加启,卜登攀.饱和脂肪酸对泌乳中期热应激奶牛血液CO2、离子浓度和离子平衡的影响[J].草业学报,2013,22(3):314-320.
[7] Keunen J E,Plaizier J C,Kyriazakis L,etal.Effects of a subacute ruminal acidosis model on the diet selection of dairy cows[J].Journal of Dairy Science,2002,85:3304-3313.
[8] Enemark J M,Jorgensen R J,Kristensen N B.An evaluation of parameters for the detection of subclinical rumen acidosis in dairy herds[J].Veterinary Research Communications,2004,28:687-709.
[9] Ametaj B N,Emmanuel D G,Zebeli Q,etal.Feeding high proportions of barley grain in a total mixed ration perturbs diurnal patterns of plasma metabolites in lactating dairy cows[J].Journal of Dairy Science,2009,92:1084-1091.
[10] Guo Y,Xu X,Zou Y,etal.Changes in feed intake,nutrient digestion,plasma metabolites,and oxidative stress parameters in dairy cows with subacute ruminal acidosis and its regulation with pelleted beet pulp[J].Journal of Animal Science and Biotechnology,2013,4:31-41.
[11] Kleen J L,Hooijer G A,Rehage J,etal.Subacute ruminal acidosis(SARA):a review[J].Journal of Veterinary Medicine Series A-Physiology Pathology Clinical Medicine,2003,50:406-414.
[12] Beauchemin K A,Yang W Z,Rode L M.Effects of particle size of alfalfa-based dairy cow diets on chewing activity,ruminal fermentation,and milk production[J].Journal of Dairy Science,2003,86:630-643.
[13] 薛妮娜,王晓娟,王莉莉.肝脏G蛋白偶联受体与糖代谢调节[J].中国药理学通报,2011,27(1):4-10.
[14] Aschenbach J R,Kristensen N B,Donkin S S,etal.Gluconeogenesis in dairy cows:the secret of making sweet milk from sour dough[J].IUBMB Life,2010,62:869-877.
[15] Wood I S,Trayhurn P.Glucose transporters(GLUT and SGLT):expanded families of sugar transport proteins[J].British Journal of Nutrition,2003,89:3-9.
[16] Auwerx J,Menzies K J.An acetylation rheostat for the control of muscle energy homeostasis[J].Journal of Molecular Endocrinology,2013,51(3):101-114.
[17] Rayner D V,Thomas M E,Trayhurn P.Glucose transpor-ters(GLUTs 1-4)and their mRNAs in regions of the rat brain:insulin-sensitive transporter expression in the cerebellum[J].Canadian Journal of Physiology and Pharmacology,1994,72:476-479.
[18] Shepherd P R,Kahn B B.Glucose transporters and insulin action-implications for insulin resistance and diabetes melli-tus[J].New England Journal of Medicine,1999,341:248-257.
[19] 王聪,刘强,张延利,等.甘油对围产期奶牛能量平衡和肝脏糖原合成的影响[J].草业学报,2013,22(1):252-259.
[20] 贾媛媛,王绍庆,常广军,等.高精料日粮诱导的SARA对泌乳期山羊血液及瘤胃液中皮质醇的影响[J].草业学报,2012,21(4):259-266.
[21] Nocek J E.Bovine acidosis:implications on laminitis[J].Journal of Dairy Science,1997,80:1005-1028.
[22] Garrett E F,Pereira M N,Nordlund K V,etal.Diagnostic methods for the detection of subacute ruminal acidosis in dairy cows[J].Journal of Dairy Science,1999,82:1170-1178.
[23] Oba M,Allen M S.Effects of brown midrib 3mutation in corn silage on productivity of dairy cows fed two concentrations of dietary neutral detergent fiber:3.Digestibility and microbial efficiency[J].Journal of Dairy Science,2000,83:1350-1358.
[24] Yang W Z,Beauchemin K A.Effects of physically effective fiber on chewing activity and ruminal pH of dairy cows fed diets based on barley silage[J].Journal of Dairy Science,2006,89:217-228.
[25] Steele M A,Croom J,Kahler M,etal.Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J].American Journal of Physiology-Regulatory Integrative and Comparative Physiology,2011,300:1515-1523.
[26] 李勇,郝正理,李发弟,等.不同组合饲粮对绵羊瘤胃代谢参数的影响[J].草业学报,2011,20(6):264-269.
[27] 王俊东,刘宗平.兽医临床诊断学[M].北京:中国农业出版社,2004:237-239.
[28] 左之才,邓俊良,王哲,等.不同能量摄入水平对围产期健康奶牛血清总胆红素、蛋白及转氨酶的影响[J].中国兽医学报,2007,27(6):865-869.
[29] 叶平生,姜雪元,张树坤,等.高精料对泌乳期山羊肝脏氨基酸分配与重分配及乳蛋白的影响[J].草业学报,2013,22(6):182-189.
[30] Staples C R,Thatcher W W,Clark J H.Relationship between ovarian activity and energy status during the early postpartum period of high producing dairy cows[J].Journal of Dairy Science,1990,73:938-947.
[31] Carlson M R,Zhang B,Fang Z,etal.Gene connectivity,function,and sequence conservation:predictions from modular yeast co-expression networks[J].BMC Genomics,2006,7:40.
[32] 董海波,王绍庆,贾媛媛,等.亚急性瘤胃酸中毒时山羊下丘脑食欲调节因子 mRNA的表达变化[J].江苏农业科学,2013,41(1):23-25.
[33] Bergman E N,Brockman R P,Kaufman C F.Glucose metabolism in ruminants:comparison of whole-body turnover with production by gut,liver,and kidneys[J].Federation Proceedings,1974,33:1849-1854.
[34] Brockman R P.Role of insulin in regulating hepatic gluconeogenesis in sheep[J].Canadian Journal of Physiology and Pharmacology,1985,63:1460-1464.
[35] Nijland M J,Mitsuya K,Li C,etal.Epigenetic modification of fetal baboon hepatic phosphoenolpyruvate carboxykinase following exposure to moderately reduced nutrient availability[J].The Journal of Physiology,2010,588:1349-1359.
[36] Modaressi S,Brechtel K,Christ B,etal.Human mitochondrial phosphoenolpyruvate carboxykinase 2gene.Structure,chromosomal localization and tissue-specific expression[J].Biochemical Journal,1998,333(2):359-366.
