连续混合选择下多花黑麦草杂交群体的SSR多样性变化
2014-03-26王绍飞黄琳凯张新全马啸
王绍飞,黄琳凯,张新全,马啸
(四川农业大学草业科学系,四川 雅安625014)
多花黑麦草(Loliummultiflorum)因具有产量高、适应性强、营养价值丰富等优点,在我国南方地区粮草轮作中发挥了极其重要的作用,是南方地区推广面积最大的栽培牧草之一[1-4]。我国多花黑麦草育种工作起步晚,育成品种较少,实际生产过程中多使用引进品种[5],主推品种遗传背景狭窄,因此怎样加快育种步伐,育成一批适应我国不同生态区实际生产需要的新品种成为亟待解决的问题之一[6]。近年来,越来越多的育种者采用标记辅助选择(marker assisted selection,MAS)的方法,从分子标记的角度评价育种材料,避免环境等外界因素的影响,期望加快育种周期[7-13]。
目前,国内外学者已经将DNA分子标记技术应用在了多花黑麦草等牧草育种工作中。如Inoue和Gao[14]利用RFLP、AFLP、TASs(端粒重复相关序列)标记对多花黑麦草构建高密度连锁图。Eduardo和Caroline[15](2004)利用RAPD技术对来自巴西及乌拉圭的4个多花黑麦草群体做了遗传多样性分析,发现来自不同地区的多花黑麦草群体间差异不明显。季杨等[16](2008)采用SRAP分子标记技术对多花黑麦草12个杂交组合的亲本与后代共70个材料进行研究,通过分析杂种与双亲之间的扩增谱带多态性,鉴别真假杂种。杨文轩等[17](2010)利用SSR、SRAP标记对6个多花黑麦草亲本品种及其9个杂交F2代组合80份材料进行遗传分析,揭示了亲本与其杂交后代间的遗传关系。
材料间杂交是植物育种的基本手段之一,但多花黑麦草属于异花授粉植物,不能采用系谱法进行育种,在形成杂交基础群体之后一般进行混合选择。在国内外研究中,鲜见多花黑麦草群体改良效果及其群体内、群体间的遗传变异的分子标记评价的报道。本研究以2个多花黑麦草杂交世代材料及其亲本为试验材料,利用多花黑麦草基因组SSR标记从分子水平分析混合选择对多花黑麦草杂交群体遗传多样性的影响,并评价各轮群体的遗传变异情况,以期为已有的杂交后代群体的进一步遗传改良提供理论依据。
1 材料与方法
1.1 试验材料
本试验的供试材料包括2个多花黑麦草杂交组合[剑宝(♀)×长江2号(♂)、长江2号(♀)×剑宝(♂)]的各混合选择改良后代群体及其亲本共12份材料的360个单株(表1)。2008年5月,用人工去雄授粉的方法,将国审主推品种“长江2号”(四倍体)与国外引进品种“剑宝”(四倍体)选择多个优异单株进行正反杂交,2个杂交组合分别混收后代群体种子,然后每年对各杂交子代群体进行混合选择,选择目标是植株高大、分蘖多、叶片宽大、冬季生长速度快等,到目前为止,共进行了5轮(代)混合选择。
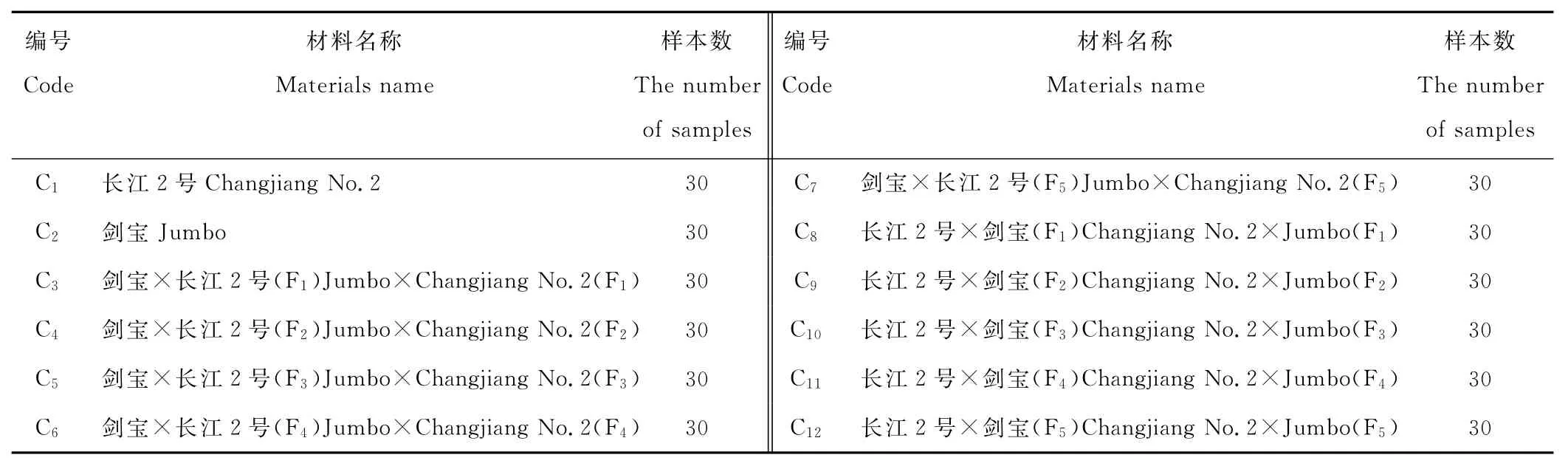
表1 供试材料信息Table 1 The information of the tested materials
1.2 DNA提取及检测
2013年2月参试的12份多花黑麦草材料,每份材料随机选取30个健康单株,用其嫩叶按照CTAB法提取其单株基因组DNA。采用0.8%琼脂糖凝胶电泳及紫外分光光度计检测DNA的纯度及浓度,符合实验要求的DNA存放于-20℃冰箱备用。纯度及浓度不符合要求的,重新提取DNA。
1.3 SSR-PCR反应及电泳检测
SSR-PCR反应扩增体系为15μL,包括:DNA 1μL(10ng/μL)、PCR-Mix 7.5μL(北京天根生化供试),正、反向引物各0.4μL(10pmol/μL),Taq DNA聚合酶0.3μL(2.5U/μL),ddH2O补足体积。反应程序采用touchdown PCR:94℃预变性5min;10个降落循环:94℃变性30s,65℃开始每个循环降低0.5℃复性45s,直至60℃、72℃延伸1min;94℃变性30s,60℃复性45s、72℃延伸1min,共计30个循环;72℃延伸7min;10℃保存。引物采用最新开发的多花黑麦草基因组SSR引物[18]。
扩增产物在6%聚丙烯酰胺凝胶上检测,先用200V恒定电压预电泳30min,再在样孔中每个样品点样6~8 μL,以50bp ladder为分子量标准,并用400V电压电泳2h,参照许绍斌等[19]的方法银染。电泳检测重复2次。
1.4 数据统计及分析
由于供试材料均为同源四倍体,利用SSR标记难以辨别杂合基因型,故本研究将SSR标记不进行基因型判定,按照如下方法处理:按点样顺序对不同SSR引物扩增分子量范围内的多态性条带逐条记录,对相同分子量的条带按有无分别赋值,有带记为1,无带记为0,构成二元数据矩阵。统计扩增产物的条带总数(total No.of bands,TNB)和多态性条带数量(No.of polymorphic bands,NPB),计算多态性百分率(percentage of polymorphic bands,PPB)。利用POPGENE软件计算各群体的Shannon多样性指数及Nei’s基因多样性。
2 结果与分析
2.1 SSR引物的筛选及其多态性分析
从100对SSR引物中筛选出来20对条带清晰、多态性好的引物(表2),对试验材料进行PCR扩增,共得到217条清晰可辨条带,平均每对引物扩增出的条带数为10.9条;其中多态性条带共有202条,平均每对引物扩增出10.1条多态性条带,引物的平均多态性条带百分率达到92.2%。表明这20对SSR引物具有较高的检测效率。
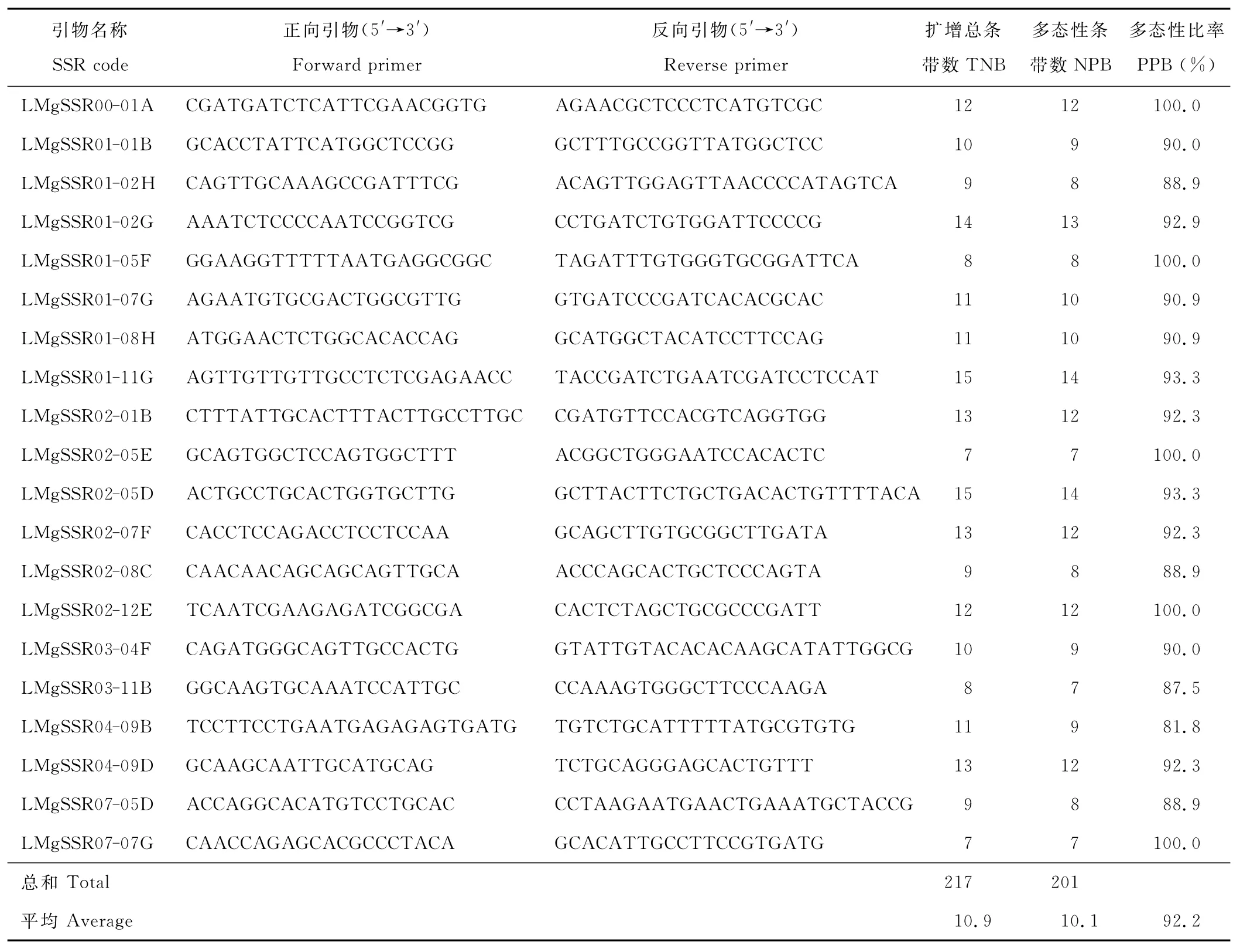
表2 用于多花黑麦草SSR分析的引物序列和多态性Table 2 Primer sequences and amplification results from SSR analyses of L.multiflorum
2.2 各杂交后代群体的SSR扩增条带分析
通过条带类型统计,对各参试多花黑麦草材料条带类型做划分,计算各类型条带数在总条带数中所占的比重,可以分析各杂交世代材料在条带类型上的变化。如表3所示,具有该类型条带的记为“+”,不具有该类型条带的记为“-”,当某条带在群体中出现频率高于70%时可看作该群体的共有条带。条带类型被划为7类。Ⅰ类:条带在父本、母本、子代中都出现;Ⅱ类:条带在双亲中均出现,而子代中没有出现;Ⅲ类:条带在父本及子代中出现,而母本没有出现;Ⅳ类:条带仅在父本中出现,而母本和子代中均没有出现;Ⅴ类:条带在母本及子代中出现,而父本中没有出现;Ⅵ类:条带仅在母本中出现,而父本和子代中均没有出现;Ⅶ类:条带仅在子代中出现,而父母本中均没有出现。
从条带类型占条带总数百分比看,各群体均具有上述7种条带类型(图1,图2)。Ⅰ类条带反映双亲对后代的遗传贡献,它在各类型条带中的比例最大,约占30.5%~38.6%,杂交世代组合“剑宝(♀)×长江2号(♂)”中,C3(F1)>C4(F2),C4(F2)<C5(F3)<C6(F4)<C7(F5);杂交世代组合“长江2号(♀)×剑宝(♂)”中,C8(F1)>C9(F2),C9(F2)<C10(F3)<C11(F4)<C12(F5)。2个组合中均表现出F2<F1<F3<F4<F5的规律。Ⅱ类条带占条带总数的百分比可以反映子代对双亲条带的缺失情况:杂交世代组合“剑宝(♀)×长江2号(♂)”中,C4(F2)>C3(F1)>C5(F3)>C6(F4)>C7(F5),而杂交世代组合“长江2号(♀)×剑宝(♂)”各群体间拥有相同的规律。Ⅰ、Ⅱ类条带类型的统计规律表明各杂交世代群体中F2代出现最大的遗传分离,从F3代起各世代材料继承双亲遗传背景的比例越来越高,而产生的新的遗传变异越来越少。Ⅲ类条带与Ⅴ类条带的总数表示子代具有父本或者母本一方的特征带总数。Ⅳ类条带与Ⅵ类条带的总数表示子代同时缺失父本和母本的特异性条带总数。从统计结果看,相对于F1及F2代,F3、F4及F5代继承父本或母本一方的特异性条带的比例呈现逐步减少的趋势,而同时缺失父本和母本特异性条带的比例也在逐渐减少,说明F3、F4及F5代更多的继承了父母本的分子特性,出现较少的遗传变异。而Ⅶ类条带表示子代特有的条带,各世代材料表现出F1>F2,F2<F3<F4<F5的规律,表明杂交子代具有的特异性条带数有增多的趋势。

图1 SSR引物LMgSSR01-05F的扩增电泳图Fig.1 SSR amplified results with primer pair LMgSSR01-05F

图2 SSR引物LMgSSR02-05E的扩增电泳图Fig.2 SSR amplified results with primer pair LMgSSR02-05E
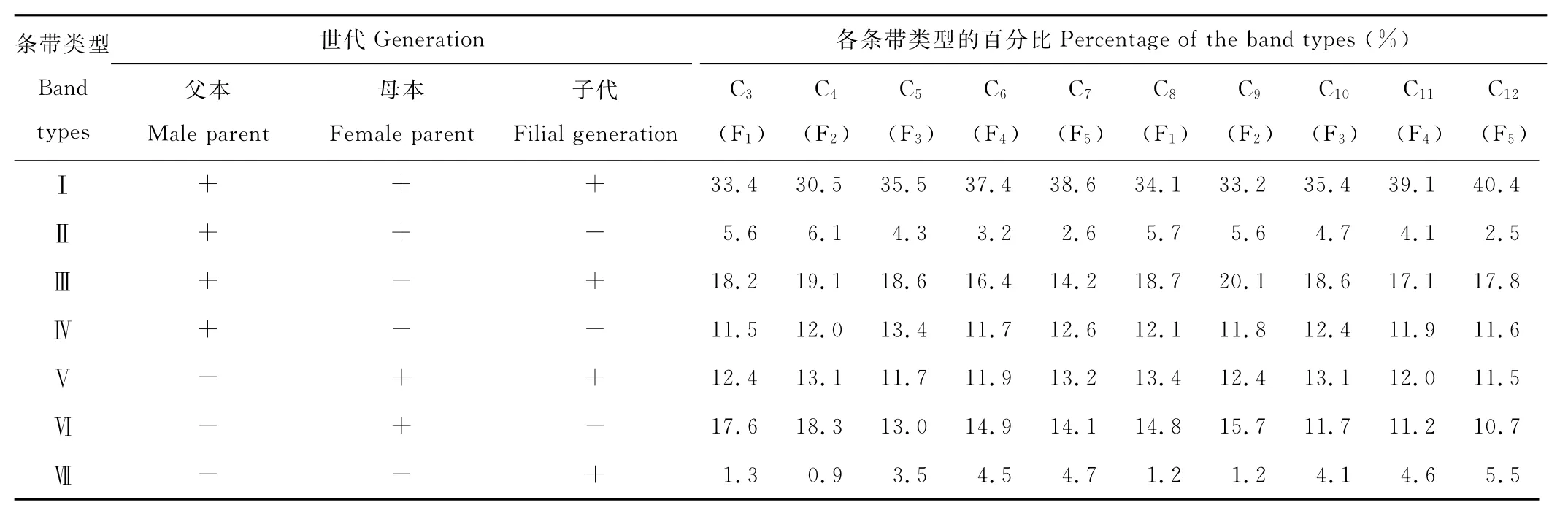
表3 杂交组合“剑宝(♀)×长江2号(♂)”和“长江2号(♀)×剑宝(♂)”各世代条带类型统计Table 3 The band types of cross combination“Jumbo(♀)×Changjiang No.2(♂)”and“Changjiang No.2(♀)×Jumbo(♂)”
2.3 不同杂交世代群体间的遗传变异比较
多态性条带百分率(PP)、Shannon多样性指数(I)和Nei’s基因多样性(Ho)等都是能够反映群体内的遗传多样性丰富程度或群体变异程度的指标。对供试的多花黑麦草各群体进行多态性条带统计(表4),发现20对具有多态性的SSR引物共扩增出217个条带,其中多态性条带比例为92.2%。杂交世代组合“剑宝(♀)×长江2号(♂)”的改良群体中,各世代群体的多态性条带数出现先增后减的规律,表明遗传变异在C4(F2)群体中达到最多之后依次减少。C3、C4群体的多态性条带数高于两亲本C1、C2的多态性条带数,杂交使多花黑麦草群体早代(F1、F2)的遗传变异增多。杂交世代组合“长江2号(♀)×剑宝(♂)”的改良群体也表现出相同的规律。
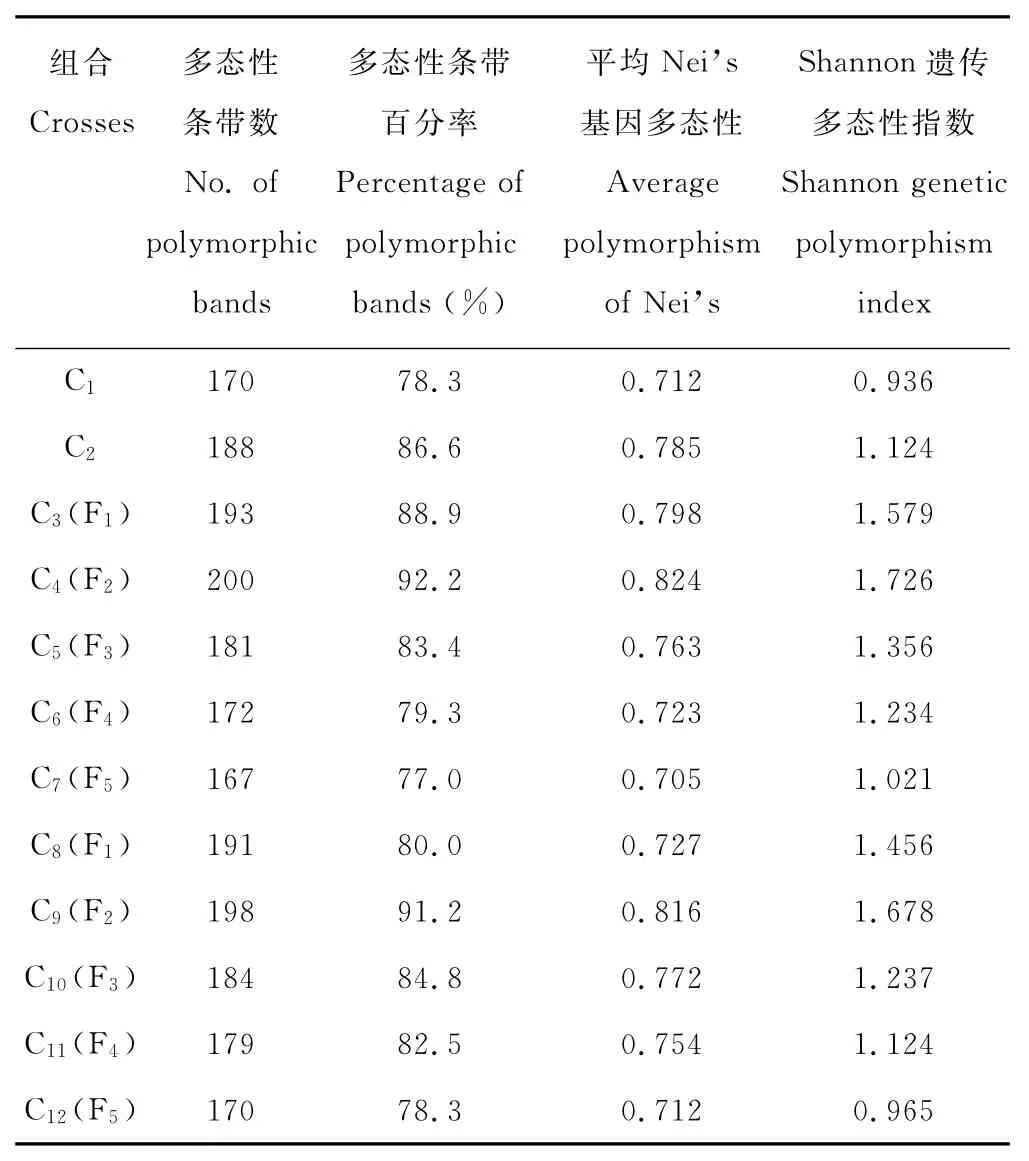
表4 供试材料的遗传多样性分析Table 4 Genetic diversity indexes of tested materials
利用Popgene计算C1~C12各群体的I和Ho指数,进而计算群体平均遗传多样性指数(Hpop)及总群体遗传多样性指数(Hsp),分析遗传多样性在群体内和群体间的分布。结果表明,杂交世代组合“剑宝(♀)×长江2号(♂)”的各改良群体(C3~C7)中各群体世代的Shannon多样性指数和Nei’s基因多态性总体是减小的,即改良群体内的遗传变异逐步降低。C3(F3)~C7(F5)群体的平均多样性指数(Hpop)为1.382,总的群体遗传多样性指数(Hsp)为1.912,即遗传多样性72.3%分布在群体内,27.7%分布在群体世代间,说明杂交组合“剑宝(♀)×长江2号(♂)”的各世代改良群体内的遗传多样性远大于各轮改良群体间的遗传多样性,这符合多花黑麦草异花授粉的繁育方式[20]。在杂交世代组合“长江2号(♀)×剑宝(♂)”中,各轮改良群体(C8~C12)也表现出随着选择世代的增加遗传变异减少的情况,且有75.2%的遗传多样性存在于群体内,24.8%的遗传多样性存在于群体间。
3 讨论与结论
本研究利用SSR分子标记对混合选择下的2个多花黑麦草杂交后代5轮改良群体的遗传变异进行分析。从条带类型的变化上看,多花黑麦草杂交群体随着混合选择的进行,SSR引物扩增出来的与父母本共有的非特异性条带数增多,缺失亲本特异性条带数减少,即群体的遗传变异减少。遗传多样性参数也表现出同样的趋势,各改良群体的遗传多样性指数、多态性条带数及多态性条带百分率等都随着选择的不断进行呈现出减小。关于供试多花黑麦草群体内遗传变异随选择世代的增加而下降的原因,这可能是连续对多花黑麦草株高、叶宽等性状定向选择导致遗传漂变产生新的育种群体的结果[21]。此外在条带类型分析中发现,杂交子代有缺失双亲共有条带(Ⅱ类条带)及出现非双亲条带(Ⅶ类条带)的情况。若亲本的基因型杂合,子代可能会出现双隐性基因型,再经过人工选择就会出现Ⅱ类缺少条带。杂交中子代的DNA序列也可能会出现非孟德尔式的变异,子代DNA序列中可能出现非亲本序列,从而有了Ⅶ类条带。国内外研究中已有同类报道,存在杂交子代缺失亲本序列和出现非亲本序列的现象[22-23]。
多花黑麦草通过杂交可以使其早代(F1、F2)的遗传多样性增加,但是随着选择的进行,群体内个体间的遗传多样性会因连续对性状的定向选择以及因群体数量和选择强度加大所引起的遗传漂变而出现下降趋势。因此,在多花黑麦草杂交育种过程中,应尽可能扩大群体规模,增加有效群体的含量或增加新的优良外源种质,并适当降低选择强度,来减小遗传漂移,以保持育种群体的遗传多样性。同时,继续保持适度选择压力,对F6等世代继续检验其与亲本和各杂交世代群体内多样性的差异性,还应从表型和具有群体诊断性的高频率稳定条带上来检验新群体与原始亲本群体的差异,为新品种选育提供直接证据。
[1] 董宽虎,沈益新.饲草生产学[M].北京:中国农业出版社,2003:113-117.
[2] 于林清,云锦凤.中国牧草育种研究进展[J].中国草地,2005,27(3):61-64.
[3] 云锦凤.牧草及饲料作物育种学[M].北京:中国农业出版社,2001:9-12.
[4] 许能祥,顾洪如,丁成龙,等.多花黑麦草耐盐性及其在盐土条件下饲用品质的研究[J].草业学报,2013,22(4):89-98.
[5] 苏加楷.中国牧草新品种育种的回顾与展望[J].草原与草坪,2001,(4):3-8,16-17.
[6] 张新跃,李元华,苟文龙,等.多花黑麦草研究进展[J].草业科学,2009,21(1):55-60.
[7] Joshi D C,Shrotria P K,Singh Ravindra,etal.Assessment of RAPD and ISSR marker systems for establishing distinctiveness of forage Sorghum (SorghumbicolorL.Moench)varieties as additional descriptors for plant variety protection[J].Indian Journal of Genetics and Plant Breeding,2011,71(1):25-36.
[8] 李杰勤,王丽华,詹秋文,等.20个黑麦草品系的SRAP遗传多样性分析[J].草业学报,2013,22(2):158-164.
[9] 刘欢,慕平,赵桂琴.燕麦种质资源遗传多样性ISSR研究[J].草业学报,2012,21(4):116-124.
[10] 曾亮,袁庆华,王方,等.冰草属植物种质资源遗传多样性的ISSR分析[J].草业学报,2013,22(1):260-267.
[11] 李杰勤,王丽华,詹秋文,等.蓝天堂黑麦草的NaN3诱变及其RAPD分析[J].草业学报,2013,22(1):276-281.
[12] 曾汉元,魏麟,刘鹏,等.能源草芦竹遗传多样性的ISSR分析[J].草业学报,2013,22(3):266-273.
[13] 刘涛,刘左军,刘凤梅,等.钝裂银莲花不同居群遗传多样性的ISSR分析[J].草业学报,2013,22(3):259-265.
[14] Inoue M,Gao Z S.Construction of a high-density linkage map of Italian ryegrass using RFLP AFLP TASs markers[J].Genome,2004,47(1):57.
[15] Eduardo A V,Caroline M C.Genetic structure of annual ryegrass(Loliummultiflorum)populations estimated by RAPD[J].Scientia Agricola(Piracicaba,Braz.),2004,61(4):407-413.
[16] 季扬,张新全,马啸,等.多花黑麦草品种(系)间杂交及杂交后代SRAP遗传分析[J].草业学报,2009,18(4):260-265.
[17] 杨文轩,马啸,张新全,等.多花黑麦草品种间杂交F2代分子标记遗传分析[J].草业学报,2012,21(4):125-133.
[18] Hirata M,Cai H W.Development of simple sequence repeat(SSR)markers and construction of an SSR-based linkage map in Italian ryegrass(LoliummultiflorumLam.)[J].Theoretical and Applied Genetics,2006,113(2):270-279.
[19] 许绍斌,陶玉芬,杨昭庆,等.简单快速的DNA银染和胶保存方法[J].遗传,2002,24(3):335-336.
[20] Schoen D J,Brown A H D.Intraspecific variation in population gene diversity and effective population size correlates with the mating system in plants[J].Proceedings of the National Academy of Sciences,USA,1991,88:4494-4497.
[21] 魏昕,荣廷昭.墨白964群体5轮混合选择遗传变异的分子生物学研究[J].中国农业科学,2006,39(2):237-245.
[22] Ayliffe M A,Lawrence G J,Ellis J G,etal.Heteroduplex molecules formed between allelic sequences cause nonparental RAPD bands[J].Nucleic Acid Research,1994,22(9):1632-1636.
[23] Feldman M,Levy A A.Allopolyploidy-a shaping force in the evolution of wheat genomes[J].Cytogenetic and Genome Research,2005,109(1-3):250-258.
