细粒棘球蚴抗原B对NOD小鼠1型糖尿病的预防作用
2014-03-26伊力多斯艾合他木夫
李 凤,邢 英,伊力多斯·艾合他木夫
(新疆医科大学第一附属医院VIP内三科,乌鲁木齐 830000)
1型糖尿病是T淋巴细胞介导的器官特异性自身免疫性疾病,主要是由于免疫系统异常破坏体内胰岛细胞,导致胰岛素分泌障碍,引起体内胰岛素绝对缺乏从而导致血糖持续升高,出现糖尿病[1]。当Th1/Th2细胞向左移动时,则抑制细胞免疫反应,使胰岛β细胞破坏,当Th1/Th2细胞向右移动时,则具有免疫保护的作用,使胰岛β细胞受到保护。包虫病为我区常见病,虽然棘球蚴抗原B诱导免疫耐受中已有报道,但较少有研究显示其在1型糖尿病早期有预防干预作用。结合棘球蚴可逃避宿主免疫杀伤及免疫监视的作用[2],如在1型糖尿病的早期进行免疫干预,对1型糖尿病的治疗有很大的帮助[3]。本研究建立在腹腔内注入棘球蚴抗原B介导的BALB/c小鼠1型糖尿病小鼠模型,并观察不同组别小鼠糖尿病情况,分析棘球蚴抗原B对链脲佐菌素诱导BALB/c小鼠1型糖尿病早期有无预防、治疗作用。
1 材料与方法
1.1材料 链脲佐菌素购自美国sigma公司;血糖仪/血糖试纸购自德国罗氏公司;TRIzol试剂购自“Invitrogen Life Technologies公司;反转录试剂盒购自Promega公司;其他试剂购自TaKaRa公司;聚合酶链反应(polymerase chain reaction,PCR)扩增仪购自美国Bio-Rad公司;引物由上海生物工程公司设计合成;小鼠白细胞介素(interleukin,IL)-2、IL-10酶联免疫吸附测定法试剂盒:武汉博士德;酶标仪:芬兰Thermo公司;分析软件:Ascent software for Multiskan.
1.2方法
1.2.1建立1型糖尿病小鼠模型 6~8周龄雄性清洁小鼠,购于新疆医科大学第一附属医院动物中心,饲养于新疆医科大学第一附属医院动物房内(SPF级),购置的小鼠于动物房内常规条件下饲养1周使其适应环境,1周后20只小鼠腹腔注射链脲佐菌素溶液(链脲佐菌素:美国sigma公司;枸橼酸、枸橼酸钠:武汉市瑞特化学用品有限公司;链脲佐菌素溶于0.1 mol/L枸橼酸缓冲液pH 4.5配制),剂量为40 mg/(kg·d),连续5 d,注射前禁食8 h,不禁水。造模后观察饮水进食情况,监测质量及血糖变化。血糖≥16.7 mmol/L且次日复测仍为此水平,提示小鼠1型糖尿病模型造模成功[4]。
1.2.2NOD小鼠分组与处理 20只造模成功的NOD小鼠,采用随机数字表法分两组:抗原B处理组(10只),给予浓度为0.54 mg/L的细粒棘球蚴抗原B(由包虫病研究所巩月红老师惠赠,经过纯化后进行注射),100 μg/10 g经腹腔注射,连续5 d;生理盐水处理组(10只),给予同等剂量(100 μg/10 g)的生理盐水经腹腔注射,连续5 d,并记录两组小鼠初始/成模后/用药后1、2、3周的体质量和血糖变化值。观察至造模成功3周后摘眼球取血法,留取成模小鼠血液标本1 mL,并以离心半径15 cm、3000 r/min离心10 min,分离血清,颈椎脱臼处死小鼠;无菌条件下取胰腺组织于无RNA酶的冻存管内,立即放于液氮中,随后保存于-70 ℃冰箱备用。酶联免疫吸附测定法检测IL-2/IL-10在小鼠血清中的水平;实时荧光定量PCR法检测所有小鼠胰腺的两种细胞因子的mRNA表达。
1.3检测方法 小鼠血清IL-2、IL-10测定:按照酶联免疫吸附试验操作说明书进行操作。总RNA提取:采用TRIzol法提取两组小鼠胰腺总RNA,按说明书操作,作纯度鉴定。引物序列设计IL-2、IL-10、β肌动蛋白的引物序列见表1[5]。

表1 目的基因的引物序列
1.4反转录试剂盒说明书操作 将反转录产物进行荧光定量PCR反应,总反应体系:20 μL:2XTaq PCR MasterMix 10 μL,上下游引物各0.5 μL,cDNA2 μL,无RNA酶水7 μL,β肌动蛋白mRNA扩增作为内对照,PCR反应条件为:95 ℃预变性3 min、95 ℃ 30 s,IL-2/IL-10 55/58.5 ℃ 30 s,72 ℃ 30 s,72 ℃延伸5 min,共35个循环,所有待测样品均做2个平行副孔,并设立阴性对照,反应结束后进行相关曲线及数值分析后每份组织标本所含的2种细胞因子的拷贝数可通过SQ值与β肌动蛋白的SQ值比较得到。

2 结 果
2.1各组小鼠体质量变化 各组小鼠初始的体质量、成模后体质量、用药后1、2周的体质量差异无统计学意义(P>0.05),而在用药后3周两组小鼠体质量比较差异有统计学意义,生理盐水处理组体质量较抗原B处理组下降显著(表2、图1)。
2.2各组小鼠血糖变化 两组小鼠成模后血糖水平、用药1、2、3周时血糖水平均呈上升趋势,差异有统计学意义(P<0.05),且抗原B处理组血糖升高水平低于生理盐水处理组(P<0.05)(表3、图2)。
2.3各组小鼠血清IL-2测定结果 IL-2OD值=0.44388892926+0.002669698,r=0.9984。抗原B处理组IL-2水平低于生理盐水处理组,差异有统计学的意义(P<0.05)(表4)。
2.4各组小鼠血清IL-10测定结果 IL-10OD值=0.725213594+0.002728013,r=0.9978。抗原B处理组IL-10水平高于生理盐水处理组,差异有统计学意义(P<0.05)(表5)。

表2 各组小鼠体质量的变化 (g)

图1 各组小鼠体质量变化折线

表3 各组小鼠血糖变化 mmol/L)

图2 各组小鼠血糖变化折线

表4 小鼠血清IL-2 OD值与实际值

表5 小鼠血清IL-10 OD值与实际值
2.5各组小鼠PCR定量结果 每次定量 PCR 反应完毕后的融解曲线均为单峰,说明扩增产物单一,无杂带,与SYBR Green荧光染料结合的RNA为目的片段,进一步验证了引物的特异性(图3、图4,见封三),抗原B处理组IL-2表达量较生理盐水处理组显著下调,IL-10显著上调,差异有统计学意义(表6)。

图3 IL-2溶解曲线 图4 IL-10 溶解曲线
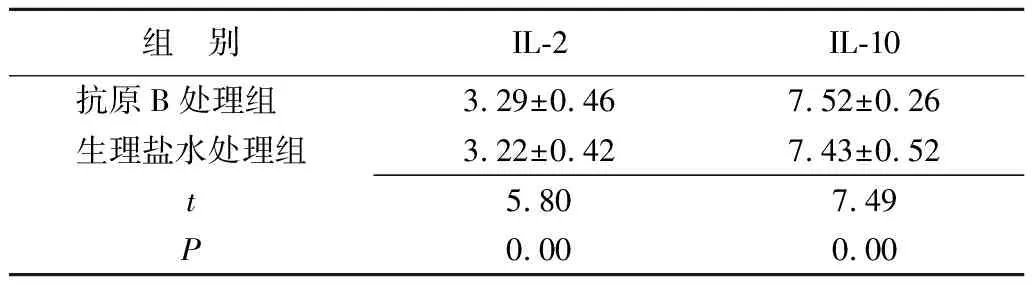
表6 待测标本mRNA定量的结果(拷贝数/微克胰腺组织)
3 讨 论
1型糖尿病是由于遗传易患基因的基础和某些环境因素的作用下[6],诱发针对β细胞的免疫炎症,β细胞受破坏而致功能严重损坏或丧失引起的一类自身免疫性疾病。1型糖尿病患者胰岛β细胞破坏高达90%以上,胰岛素绝对缺乏,因而1型糖尿病病理生理过程及糖蛋白质、脂肪分解紊乱与胰岛素的缺乏有关,从而导致血糖的持续上升,出现糖尿病,以识别抗原,激活淋巴细胞,启动损毁胰岛β细胞的过程[7]。现已证实,由于致病性T细胞和调节性T细胞之比失衡,调节性T细胞数目减少且功能降低,加快了1型糖尿病的发生[7]。随着疾病的进展,当胰岛β细胞数目破坏至85%~90%时,即可表现为临床期1型糖尿病。由于1型糖尿病在临床发病之前有一个较长的糖尿病前期阶段,通常维持3~6个月,最长可达2年,在此阶段应用免疫干预治疗,以及纠正致病性T细胞和调节性T细胞比例的破坏,阻断破坏胰岛β细胞的过程,使之恢复合成和分泌胰岛素的功能,可达到预防或减轻1型糖尿病的作用,因此纠正Th1/Th2细胞亚群的失衡可能预防或治疗1型糖尿病。在1型糖尿病的自身免疫过程中,Th1型细胞及细胞因子介导的自身免疫反应,激活细胞毒性T细胞,诱导的氧自由基产生的信号转导通路的开放,从而产生更多的氧自由基,直接破坏胰岛β细胞,影响胰岛素的分泌和胰岛β细胞的凋亡[2-4],最终导致1型糖尿病的发生。因此预防胰岛β细胞破坏及1型糖尿病的发生应着眼于激活Th2型细胞因子,抑制Th1型细胞因子的活化剂释放。IL-4和IL-10作为Th2细胞分泌的细胞因子可以抑制T淋巴细胞和B淋巴细胞的增殖,下调自身免疫性细胞因子。有研究表明[8-10],将含有IL-10基因的重组腺病毒表达载体转染给胰岛β细胞,使其自身分泌更多的IL-10从而延缓胰岛炎和糖尿病的发生,而IL-2可诱导外周CD8+T细胞迁移进入炎性胰岛,其机制可能通过诱导特异性的表达细胞毒性CD8+T细胞以产生颗粒酶、穿孔素等物质介导胰腺β细胞凋亡,最终诱发1型糖尿病。
本实验中,给予细粒棘球蚴抗原B注射的小鼠,在发病后血糖升高较生理盐水组缓慢,且血糖升高不明显,而相应的体重的变化未向血糖一样逐步升高,而是比较平稳。酶联免疫吸附实验表明:与对照组相比,抗原B处理组小鼠血清IL-2水平降低,而IL-10水平升高,说明抗原B有降低IL-2水平、提升IL-10水平、防止胰岛β细胞的进一步破坏的作用;荧光定量PCR实验进一步证明了抗原B的作用,表明棘球蚴抗原B可以诱发免疫耐受,抑制Th1细胞生成,使发生免疫向右偏移,从而保护胰岛。
棘球蚴囊液含多种抗原,抗原B(AgB)是其主要成分[11],大量研究证实,宿主体内IgG1、IgG4和IgE水平及嗜酸性粒细胞的增高均提示细粒棘球蚴感染过程中的免疫应答是以Th2细胞占优势的。有研究表明[12],通过AgB对健康人外周血单核细胞源的树突状细胞进行干预,发现细粒棘球蚴能够长期逃避宿主的免疫监视而在宿主体内长期存活。包虫病为新疆地区的多发病和特色病,新疆糖尿病的患病率极高,因此研究棘球蚴抗原B对1型糖尿病病免疫机制的影响,可以为利用细粒棘球蚴B抗原对1型糖尿病进行免疫调节治疗提供新的理论基础。本实验仅是初步认为细粒棘球蚴抗原B可以降低IL-2水平,升高IL-10水平,可使Th1/Th2细胞发生免疫偏移,向着有利于胰岛保护的方向,但由于数量偏少,不排除实验结果的局限性,需进一步大量的动物实验证实。
[1] 叶剑,齐晖,李富荣,等,免疫抑制剂在预防1型糖尿病发病中的作用[J].中国免疫学,2011,27(8):760-763.
[2] 黄河,温浩,赵晋明,等.棘球蚴抗B诱导小鼠皮肤移植免疫逃避的实验研究[J].新疆医科大学学报,2009,32(6):92-94.
[3] 冯春颜,张永顶,胡纪文,等.免疫印迹法检测1型糖尿病自身抗体的临床应用[J].国际检验医学杂志,2009,30(6):593-595.
[4] 马海霞,刘光伟,赵勇,等.非肥胖性糖尿病(NOD)小鼠模型及其发病免疫学机制[J].实验动物学,2008,25(3):42-46.
[5] 陈艳红,朱晨露,魏衍财,等.小鼠CCL20 mRNA实时荧光定量PCR检测方法的建立[J].江苏大学学报,2012,22(4):299-302.
[6] 朱大龙,李莉蓉.1型糖尿病的免疫干预及其干细胞治疗[J].国际内分泌代谢杂志,2010,30(5):289-291.
[7] Ko KS,Lee M,Koh JJ,etal.Combined administration of plasmids encoding IL-4 and IL-10 prevents the development of autoimmune diabetes innonobeses diabetic mice[J].Mol Ther,2001,4(4):313-316.
[8] 陈蔚,俞茂华.基因芯片技术研究黄芪多糖对NOD小鼠胰岛基因表达谱的影响[J].中华内分泌代谢杂志,2004,20(6):545.
[9] Makino S,Kunimoto Y,Muraoka Y.Breeding of a nonobese strain of mice[J].Exp Anim,1980,29(1):1-13.
[10] Suk K,Kim S,Kim YH,etal.INF-r/TNF-a synergism as the final effect in autoimmune diabetes Ⅰ a key role for SATAL/INF-γ regulatory factor-1 pathway in pancreatic beta cell death[J].Immunol,2001,166(7):4481-4489.
[11] Falcone M,Yeung B,Tucker L,etal.IL-4 triggers autoimmune diabetes by increasing self-antigen presentation within the pancreatic islets[J].Clin Immunol,2001,98(2):190-199.
[12] Rachele R,Brigitta B.Echinococcus granulosus antigen B impairs human dendritic cell differentiation and polarizes immaturedendritic cell maturation towards a Th2 Cell Response[J].Infect Immunol,2007,75(4):1667-1678.
