三七锈腐病菌的鉴定及不同培养基对其产孢量的影响
2014-03-26毛忠顺龙月娟朱书生陈中坚魏富刚何霞红朱有勇
毛忠顺,龙月娟,朱书生,崔 军,陈中坚,魏富刚,何霞红,朱有勇
(1 云南农业大学 a 植物保护学院,b 园林园艺学院,云南 昆明 650201;2 文山苗乡三七实业有限公司, 云南 文山 663000; 3 文山学院 文山三七研究院,云南 文山 663000;4 文山州植保植检站,云南 文山 663000)
三七Panaxnotoginseng(Burk.) F.H.Chen,又名田七[1]、金不换,为五加科人参属多年生宿根草本植物。三七叶、茎、块根中丰富的皂苷,在给人们提供丰富的药用成分的同时,也给病原菌的发生、发展提供了可能。三七地上部分的主要病害有黑斑病[2]、炭疽病[3]、灰霉病[4]、圆斑病[5]、病毒病[6],地下部分病害主要为三七根腐病。三七的地上部分病害对三七的影响非常大,但可以通过化学或物理防治措施来控制。三七锈腐病是目前三七根腐病中发病率最高、危害最为严重的一种地下部分病害。王勇等[7]报道,三七锈腐病的病原菌是柱孢属真菌Cylindrocarponspp.,常年发病率在10%~30%,严重者可达90%以上,但是对三七锈腐病病原菌的鉴定并没有到种。缪作清等[8]报道,毁灭柱孢Cylindrocarpondestructans和双孢柱孢Cylindrocarpondidymum是三七根腐病的病原菌,其致病力较弱,但病害症状在田间分布范围广,分离频率最高达100%,且可导致典型的黄腐型症状,但是并没有提出三七锈腐病的概念。李世东等[9]研究了不同温度、pH值、多种培养基和碳氮源营养等对三七根腐病主要致病菌C.desstructans(2-8) 和C.didynum(1-1) 菌落扩展、产孢和孢子萌发等的影响。
云南农业大学农业生物多样性与植物病害控制课题组在云南文山州砚山县、广南县等地调查发现,无论是在三七种苗期或是在二、三年七阶段,三七锈腐病是所有根部病害中发病率最高的一种,而目前针对三七锈腐病的研究却较少。在人工培养基上,真菌产孢与否,直接影响着其形态鉴定;而产孢量的多少,影响着致病性的测定。因此,开展三七锈腐病菌在不同培养基上的产孢量研究,优化三七锈腐菌的产孢培养基,有利于三七锈腐病菌的致病性、致病机制以及防治方法的研究。本研究对采自云南省砚山县盘龙乡的三七锈腐病标样进行了分离、纯化,经柯赫氏法则验证后,进行了三七锈腐病菌的形态和分子生物学鉴定,同时对三七锈腐病菌产孢培养基进行了优化,现将研究结果报道如下。
1 材料与方法
1.1 材 料
1.1.1 病原菌 三七锈腐病病株采自云南省文山州砚山县盘龙乡文山三七科技示范园,采集后2 d内分离病原菌。
1.1.2 培养基 4种供试基础培养基为马铃薯蔗糖琼脂培养基(PSA)、马铃薯葡萄糖琼脂培养基(PDA)、察氏培养基(Czapek’s)和胡萝卜琼脂培养基(CA)。
1.2 病原菌菌株的分离与纯化
病原菌分离参照方中达[10]的组织分离法。将三七锈腐病病根洗净后,无菌条件下于根部病健交界处切取大小为5 mm×5 mm的组织块,用体积分数75%酒精消毒30 s,体积分数10%次氯酸钠水溶液消毒1 min,无菌水换洗3次,用无菌滤纸吸干水分后移至PDA平板中,置于培养箱中25 ℃恒温培养,每24 h观察1次。当病变组织长出菌落后,挑取菌落边缘的少许菌丝移入PDA平板上培养,并挑取单孢菌落纯化。
1.3 分离菌株的柯赫氏法则验证
将1.2中得到的单孢纯培养菌株培养14 d后,刮下菌丝体,用无菌水稀释,以血球计数板计数后制成孢子密度为106mL-1的悬浮液。用无菌毛刷蘸取孢子悬浮液涂抹于1年生三七块根表面后移栽于灭菌基质中,每处理10株,重复3次,以涂抹无菌清水的三七块根为对照(CK),按常规方法管理。30 d后取出,用清水冲洗根部,观察三七块根发病情况,记录结果并照相。病害按以下标准分为6级:0级,无病;1级,病斑占表面积5%以下;2级,病斑占表面积6%~10%;3级,病斑占表面积的11%~25%;4级,病斑占表面积的26%~50%;5级,病斑占表面积的51%~75%,块根外观受到严重影响;6级,病斑占表面积75%以上或完全腐烂。病情指数计算公式为:病情指数=∑(各级病害株数×各级代表数值)×100/(调查总株数×最高级代表值)[10]。对发病部位进行病原物再分离并与原分离的病原物进行比较。根据病情指数及分离频率,选取致病性较强的菌株作为产孢试验的供试菌株。
1.4 分离菌株的鉴定
1.4.1 形态学鉴定 将单孢菌株培养10 d后,观察并记录菌落形态,采用徕卡(Leica)DM 2000显微镜观察不同类型孢子的颜色,LAS V4.0照相系统测量分生孢子、分生孢子梗和厚垣孢子的大小等。根据形态学及显微观察数据鉴定病原菌。
1.4.2 分子鉴定 1)DNA的提取。用真菌基因组DNA提取试剂盒(Andy Bio)提取病原菌的DNA。
2)PCR扩增。利用根据ITS区段设计的引物对ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)及ITS4(5′-TCCTCCGCTTATTGATATGC-3′)(由上海生工生物工程有限公司合成)进行PCR扩增。扩增体系50 μL:1×PCR Buffer,200 μmol/L dNTPs,0.24 μmol/L 的ITS1F及ITS4,2 U的TaqDNA 聚合酶(Transgen 公司),50~100 ng模板DNA,用无菌超纯水补足到50 μL。PCR扩增反应在ABi Thermal Cycler 9902上进行,反应程序为:94 ℃预变性3 min;94 ℃变性45 s,55 ℃退火1.5 min,72 ℃延伸2 min,30个循环;72 ℃最终延伸10 min,4 ℃保存[11]。
3)PCR产物。产物用20 g/L琼脂糖凝胶电泳检测,UVP 凝胶成像系统记录影像,PCR产物送交北京六合华大基因股份有限公司测序,测序结果用Mega 4.1 软件中的Neighbor-joining方法进行聚类分析,构建系统发育树[12]。
1.5 产孢培养基的优化
供试产孢培养基以PSA、PDA、Czapek’s和CA为基础培养基。在以PDA和PSA为基础培养基的配方中,将马铃薯的量依次设为200,150,100,50和0 g/L,其他成分的量不变,以PSA为基础培养基的配方分别记为PSA1、PSA2、PSA3、PSA4和PSA5,以PDA为基础培养基的配方分别记为PDA1、PDA2、PDA3、PDA4和PDA5;在以Czapek’s为基础培养基的配方中,将蔗糖的量依次设为30,20,10,5和0 g/L,分别记为Cz1、Cz2、Cz3、Cz4和Cz5,其他成分的量不变;在以CA为基础培养基的配方中,将胡萝卜的量依次设为100,200,400,600,800 g/L,其他成分的量不变,分别记为C1、C2、C3、C4和C5。上述培养基经121 ℃高温湿热灭菌30 min,分装备用。选用1.3中致病性较强的菌株作为供试菌株,将病原菌的纯培养物用直径为6 mm的打孔器打孔后,分别接入上述灭菌培养基中,每处理10个重复。于25 ℃恒温培养,14 d后刮下菌丝体,无菌水倍比稀释后,以血球计数板计数,并用SPSS 17.0进行统计分析[13]。
2 结果与分析
2.1 三七锈腐病菌的分离
将患有锈腐病的三七根部病健交界处的组织块(图1-A)在PDA平板上培养8 d后,从组织块上长出了白色的菌丝,边缘米黄色,背面锈色至浅褐色(图1-B)。从菌落边缘挑取肉眼可见的少许菌丝至PDA平板上,25 ℃恒温培养10 d,挑取单孢菌落纯化后,得到8个单孢菌株,编号分别为Cd-M-1、Cd-M-2、Cd-M-3、Cd-M-4(图1-C)、Cd-M-5、Cd-M-6(图1-D)、Cd-M-7和Cd-M-8。
2.2 分离菌株的柯赫氏法则验证
对分离到的单孢菌株进行柯赫氏法则验证,结果如图2所示。将分离到的单孢菌株在室外活体接种10 d后,观察发现90%以上已接种病原菌的三七植株地上部分出现轻度倒伏,15 d后发病植株的地上部分叶片和茎发黄,严重者甚至干枯、腐烂;30 d后将植株全部取出,洗净根部观察,发现接种不同单孢菌株的三七根部发病程度不一,轻者根部有锈状物,严重者根部出现黑色腐烂症状,而未接种病原菌的对照植株则未发病。对发病植株和对照植株的根部和茎基部进行再分离,均能从发病植株的根部和茎基部分离到病原菌,且形态和结构与原分离的病原菌菌株相同,符合柯赫氏法则,而无菌水对照植株的根部和茎基部均未分离到病原菌(图2)。由此证明,分离到的单孢菌株即为三七锈腐病的病原菌。
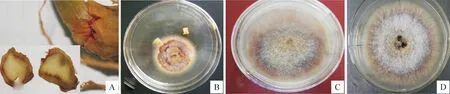
图 1 三七锈腐病发病部位及分离的病原物

图 2 三七锈腐病菌分离菌株的接种及再分离试验结果
8株单孢菌株的接种试验结果(表1)表明,致病菌株有4株,分别为Cd-M-3、Cd-M-6、Cd-M-7和Cd-M-8,其中Cd-M-6的致病性最强,病情指数为68.33±5.11;其次为Cd-M-7,病情指数为34.31±3.12;Cd-M-3的病情指数为24.32±3.09;Cd-M-8的致病力最弱,病情指数为19.21±2.01。

表 1 接种分离菌株30 d后三七锈腐病的发病率及病情指数
2.3 三七锈腐病菌的鉴定
2.3.1 形态学鉴定 根据致病性测定结果,选取致病性最强的单孢菌株Cd-M-6作为鉴定目标菌株。
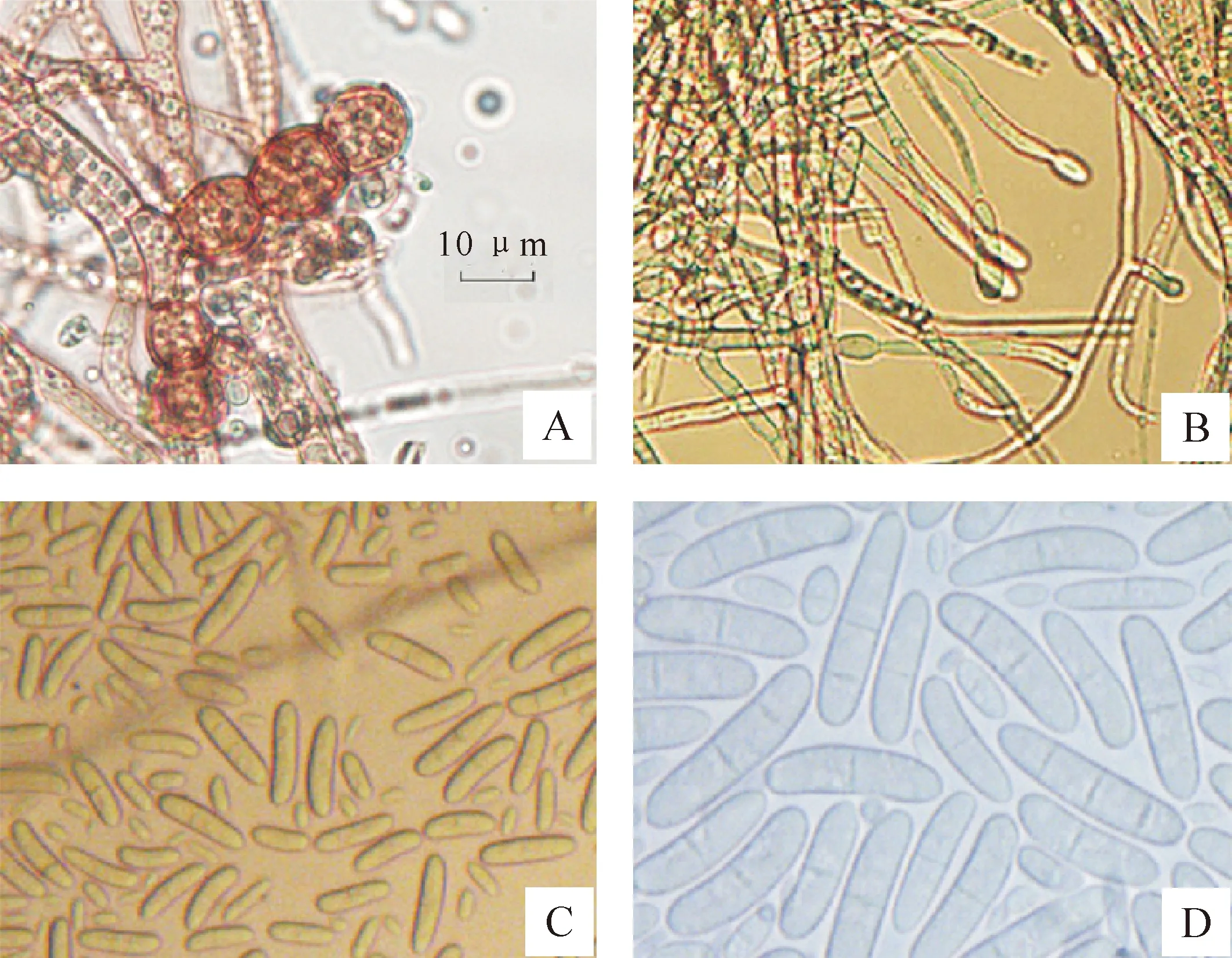
图 3 三七锈腐病菌的显微观察结果
在PSA培养基上,Cd-M-6菌丝绒状,平展,同心状展开,初生菌丝白色,老熟菌丝金黄色,培养基背面锈色至褐色。小型分生孢子梭状,0~1隔。大型分生孢子直立,柱状,基部稍窄,无色至淡金黄色,1~4隔,其中1~2隔的孢子多见,3隔分生孢子少见,偶见4隔分生孢子,在生长后期,多为1~2隔分生孢子。小型分生孢子(5.4~10.9) μm×(2.7~3.2) μm;1隔分生孢子(11.1~29.4) μm×(3.5~5.1) μm;2~3隔分生孢子(18.1~40) μm×(3.6~10.0) μm。产孢梗单生,在分生孢子梗中部长出较短小产孢梗,(18.5~88.0) μm×(1.70~3.32) μm。厚垣孢子锈色,串生或链生,孢子直径大小5.2~12.6 μm。在PSA培养基上,未见有性阶段。 根据其形态特点、培养性状和产孢特点,将分离菌株鉴定为毁灭柱孢Cylindrocarpondestructans(Zins.) Scholten[14-16],有性态为Ilvonectriaradicicola(Gerlach & L.Nilsoon) P.chaverri & C.Salgado[17]。
2.3.2 分子生物学鉴定 前期研究表明,用试剂盒提取的DNA质量浓度在20 ng/μL左右,其纯度较高,可直接用于普通PCR。因此,获得真菌全基因组DNA后,采用ITS1F/ITS4进行PCR,结果见图4。由图4可见,8个泳道均出现了较亮的条带,片段大小在500~750 bp。
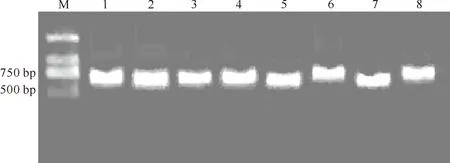
图 4 三七锈腐病菌基因组ITS-PCR产物的电泳结果
将PCR产物送北京六合华大基因股份有限公司纯化后测序,对测序结果进行BLAST比对,取形态接近且与人参属植物锈腐病或其他植物根腐病密切相关的柱孢属真菌C.destructans,C.decumbens,C.didymum,C.macrodidymum,C.obtusisporum,C.liriodendri和C.pauciseptatum菌株登录在GenBank序列的ITS1-5.8S-ITS2作为参考,采用Mega 4.1软件中的Neighbor-joining进行系统发育分析(Bootstrap,1 000次重复),结果如图5所示。
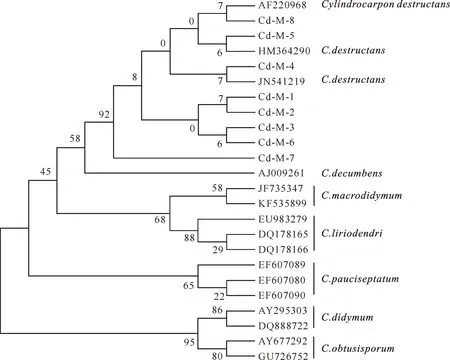
图 5 三七锈腐病菌ITS1-5.8S-ITS2序列的系统发育分析结果
由图5可以看出,在92%水平上,8个三七锈腐病菌的单孢菌株与毁灭柱孢C.destructans的菌株AF220968、HM364290和JN541219聚为一类,相似度最为接近(大于70%)。因此,在分子生物学上,将8个三七锈腐病菌的单孢菌株鉴定为毁灭柱孢C.destructans。
2.4 不同培养基对三七锈腐病菌产孢量的影响
2.4.1 不同配方培养基的产孢量 在各个不同的培养基中,由于每一皿中的产孢量较大,为便于计算,取产孢量数值的对数作为考量指标,再用SPSS 17.0进行统计分析。
由表2可以看出, PSA或PDA培养基中若不添加马铃薯,则三七锈腐病菌不能产孢。在PSA培养基中,马铃薯用量为200 g/L时,产孢量最高,随着马铃薯用量的减少,产孢量逐渐减少,且彼此间差异显著,说明200 g/L的马铃薯用量最适合三七锈腐病菌产孢。在PDA培养基各配方中,也出现了与PSA同样的趋势,但马铃薯用量为150或200 g/L时,对三七锈腐病菌的产孢量没有显著影响。说明在PDA培养基中,马铃薯用量为150 g/L较为适合三七锈腐病菌产孢。
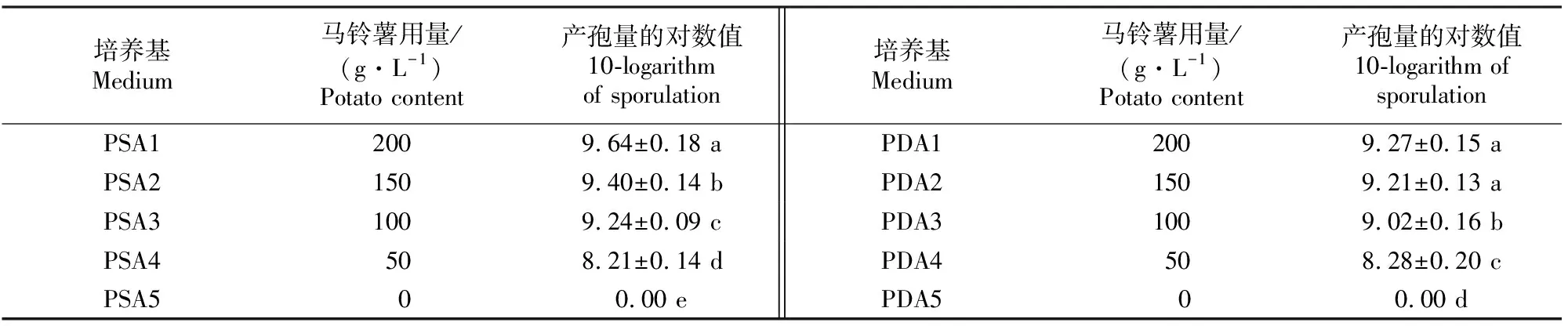
表 2 三七锈腐病菌在不同配方PSA和PDA培养基上的产孢量
由表3可以看出,在Czapek’s培养基各配方中,不添加蔗糖,三七锈腐病菌也能够产孢;蔗糖用量为20和30 g/L时,对三七锈腐病菌的产孢量没有显著(P>0.05)影响;其余各配方中,随着蔗糖用量的减少,产孢量逐渐减少,蔗糖用量为10~30 g/L 时,产孢量差异不显著。说明在Czapek’s培养基中,蔗糖用量为20 g/L较合适。在CA培养基中,胡萝卜用量分别为400和800 g/L时,三七锈腐病菌的产孢量较大,但二者差异不显著;当胡萝卜用量为100 g/L时,三七锈腐病菌的产孢量最少。
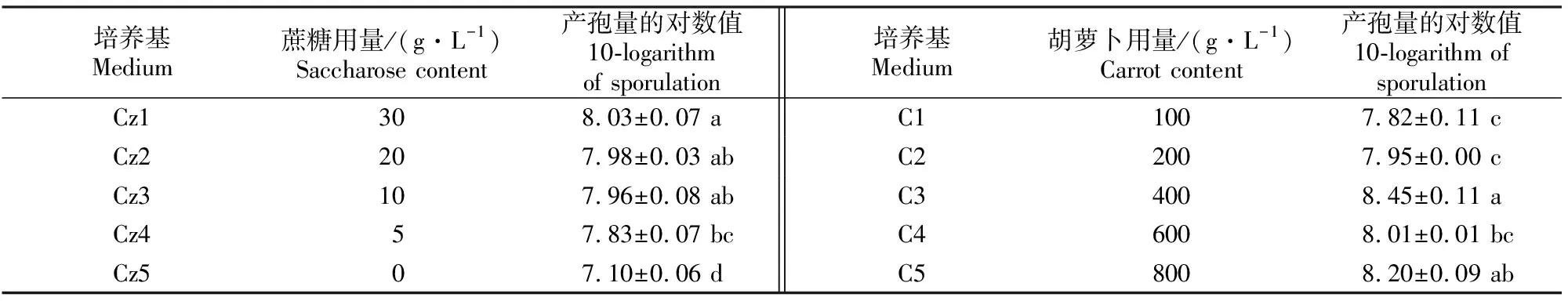
表 3 三七锈腐病菌在不同配方Czapek’s和CA培养基上的产孢量
2.4.2 不同培养基的产孢量 由表4可以看出,在PSA、PDA、Czapek’s和CA培养基中,以PSA的产孢量最大,达到109.5个/皿以上,与其他培养基相比差异显著(P<0.05),然后依次为PDA、CA、Czapek’s培养基。

表 4 三七锈腐病菌在不同培养基中的产孢量
3 结论与讨论
3.1 三七锈腐病的病原菌
三七根腐病是三七生产中的一类重要病害,病原菌有藨草镰孢霉(Fusariumscirpi)[18]、腐皮镰刀菌(F.solani)[19]、腐皮镰刀菌根腐专化型(F.solanif.sp.Radicicola)[20]、尖孢镰刀菌(F.oxysporum)和串珠镰孢中间变种(F.monilliformevar.intermedium)[21]、假单孢杆菌(Pseudomonassp.)[22-23]、双孢柱孢(Cylindrocarpondidymum)、毁灭柱孢(C.destructans)、恶疫霉(Phytophothracactorum)、草茎点霉(Phomaherbarum)[8]。此外,小杆线虫在三七根腐的进程中起到加速作用[24]。本研究发现,毁灭柱孢C.destructans是三七锈腐病的病原菌;同时发现,毁灭柱孢能引起三七块根和鳞茎上产生2种不同的症状,即锈裂和腐烂。这与毁灭柱孢引起的人参锈腐病的症状[25]相似。
3.2 三七锈腐病菌的产孢培养基
在病害研究中,对病原菌孢子萌发和产孢量的关注较多。PSA和PDA通常是真菌分离和纯化的培养基,很少用作产孢培养基。CA被广泛用作各种疫霉的产孢培养基[26-27],察氏培养基是各种病原菌产孢和孢子萌发研究的基础培养基[28-29]。因此,本研究比较了不同培养基对三七锈腐病菌产孢的影响,结果表明,三七锈腐病菌在PSA上产孢量最大,其次为PDA,再次为CA培养基,最后是Czapek’s培养基。在PSA和PDA培养基上,随着马铃薯用量的减少,产孢量减少。当马铃薯用量为200 g/L时,三七锈腐病菌在PSA培养基上的产孢量最大。在PDA上,当马铃薯用量为150 g/L时,较适合三七锈腐病菌产孢。在Czapek’s培养基上,随着蔗糖用量的增加,三七锈腐病菌的产孢量逐渐增加,蔗糖用量为30 g/L最适宜三七锈腐病菌产孢。在CA培养基上,随着胡萝卜用量的增加,三七锈腐病菌产孢量逐渐增加,当胡萝卜用量为400 g/L时,三七锈腐病菌的产孢量最大。
按茎秆颜色来分,三七可分为紫茎三七、绿茎三七和紫绿相间三七。而三七锈腐病菌既能侵染绿茎三七,又能侵染紫茎三七。陈中坚等[30]研究表明,三七的淀粉含量在39.09%~53.97%。这说明三七锈腐病菌具有淀粉酶和相应降解多糖的酶[31-32]。这或许就是三七锈腐病菌在含有淀粉、多糖的PSA和PDA培养基上产孢量高于CA和Czapek’s培养基的主要原因。
[参考文献]
[1] 中国科学院中国植物志编辑委员会.中国植物志:第五十四卷 [M].北京:科学出版社,1978.
Editorial Board of Flora of China,Chinese Academy of Sciences. Flora of China:Volume 54 [M].Beijing: Science Press,1978.(in Chinese)
[2] 王淑琴,于洪军,陈仙华.三七黑斑病的综合防治研究 [J].植物病理学报,1981,11(2):45-52.
Wang S Q,Yu H J,Chen X H.On the black spot (AlternariapanaxWhetz.) of Sanqi (Panaxnotoginseng(Burk) F.H.Chen) [J].Acta Phytopahologyica Sinica,1981,11(2):45-52.(in Chinese)
[3] 韦继光,陈育新,吴景华,等.田七炭疽病的病原鉴定及病原生物学特性的研究 [J].广西农学院学报,1989,8(1):25-33.
Wei J G,Chen Y X,Wu J H,et al.Studies on the identification of pathogens of Tianqi (Panaxnotgoginseng) anthracnose and its biological characteristics [J].Journal of Guangxi Agricultural College,1989,8(1):25-33.(in Chinese)
[4] 陈树旋.三七新病害:灰霉病 [J]. 植物保护,1990,16(S1):27.
Chen S X.New disease ofPanaxnotoginseng:Gray muld [J].Plant Protection,1990,16(S1):27.(in Chinese)
[5] 陈 克,陈树旋,余子畏.三七新病害:圆斑病 [J].植物检疫,1997,11(1):43-44.
Chen K,Chen S X,Yu Z W.New disease ofPanaxnotoginseng:Round spot [J].Plant Quarantine,1997,11(1):43-44.(in Chinese)
[6] 陈燕芳,金 羽,李桂芬,等.三七病毒病鉴定初报 [J].植物检疫,2004,18(4):212-213.
Chen Y F,Jin Y,Li G F,et al.Preliminary report of characterization ofPanaxnotoginsengvirus [J].Plant Quarantine,2004,18(4):212-213.(in Chinese)
[7] 王 勇,陈昱君,范 昌,等.三七锈腐病的发生规律调查研究 [J].现代中药研究与实践,2003(增刊):27-29.
Wang Y,Chen Y J,Fan C,et al.Outbreak regularity of investigation of rust rot ofPanaxnotoginseng[J].Research and Practice of Chinese Medicines,2003(S):27-29.(in Chinese)
[8] 缪作清,李世东,刘杏忠,等.三七根腐病病原研究 [J].中国农业科学,2006,39(7):1371-1378.
Miao Z Q,Li S D,Liu X Z,et al.The causal microorganisms ofPanaxnotoginsengroot rot disease [J].Scientia Agricultura Sinica,2006,39(7):1371-1378.(in Chinese)
[9] 李世东,张克勤,缪作清,等.三七根腐病原菌(Cylindrocarponspp.)生物学特性研究 [J].云南大学学报:自然科学版,2006,28(S1):342-346.
Li S D,Zhang K Q,Miao Z Q,et al.Biological characteristics ofCylindrocarponspp.,pathogens ofPanaxnotoginsengroot rot disease [J].Journal of Yunnan University:Natural Edition,2006,28(S1):342-346.(in Chinese)
[10] 方中达.植病研究方法 [M].3版.北京:中国农业出版社,1998.
Fang Z D.Research methods for plant pathology [M].3rd ed.Beijing:China Agricultural Press,1998.(in Chinese)
[11] Seifert K A,McMullen C R,Yee D,et al.Molecular differentiation and detection of ginseng-adapted isolates of the root rot fungusCylindrocarpondestructans[J].Phytopathology,2003,93(12):1533-1542.
[12] Kumar S,Nei M,Dudley J,et al.MEGA:A biologist-centric software for evolutionary analysis of DNA and protein sequences [J].Brief Bioinform,2008,9(4):299-306.
[13] Zhang J,Yang Y,Yang T,et al.microRNA-22,downregulated in hepatocellular carcinoma and correlated with prognosis,suppresses cell proliferation and tumourigenicity [J].British Journal of Cancer,2010,103:1215-1220.
[14] Booth C.The genusCylindrocarpon[M].Mycological Papers,1966,104:1-56.
[15] Domsh K H,Gams W,Anderson T.Compendium of soil fungi [M].London:Academic Press,1980.
[16] Samuels G J,Brayford D.Variation inNectriaradicicolaand its anamorphCylindrocarpondestructans[J].Mycol Res,1990,94:433-442.
[17] Chaverri P,Salgado C,Hirooka Y,et al.Delimitation ofNeonectriaandCylindrocarpon(Nectriaceae,Hypocreales,Ascomycota) and related genera withCylindrocarpon-like anamorphs [J].Studies in Mycology,2011,68:57-78.
[18] 浙江省卫生局.浙江省栽培药用植物病虫害防治 [M].出版地不详:出版者不详,1952.
Zhejiang Administration of Health.Pests management of cultivated herbs in Zhejiang province [M]. [S.l.]:[s.n.],1952.(in Chinese)
[19] 阮兴业,蒋育昌,罗文富,等.云南植物镰刀菌病害鉴定初报 [J].云南农业科技,1981(2):1-20.
Ruan X Y,Jiang Y C,Luo W F,et al.Preliminary report of characterization ofFusariumplant disease in Yunnan province [J].Yunnan Agricultural Science and Technology,1981(2):1-20.(in Chinese)
[20] 曹福祥,戚佩坤.田七根腐病的病原菌鉴定 [J].植物病理学报,1991,21(2):89-93.
Cao F X,Qi P K.Identification of the pathogen cauing root rot disease of the medicinal herbPseudoginseng[Panaxpseudo-ginsengWall.var.notoginseng(Burkill) Hoo & Tseng] [J].Acta Phytopahologyica Sinica,1991,21(2):89-93.(in Chinese)
[21] 王拱辰, 陈鸿逵, 骆平西. 三七根腐病病原分离、接种和药剂试验 [J].植物病理学报,1991,21(2):144.
Wang G C,Chen H K,Luo P X.Isolation,inoculatioin and fungicidal tests on the pathogens causing root rot ofPanaxpseudo-ginsengWall.var.notoginseng(Burkill) Hoo & Tseng [J].Acta Phytopahologyica Sinica,1991,21(2):144.(in Chinese)
[22] 罗文富,喻盛甫,贺承福,等.三七根腐病病原及复合侵染的研究 [J].植物病理学报,1997,27(1):85-91.
Luo W F,Yu S F,He C F,et al.On the combined infection of root rot pathogens onPanaxnotoginseng[J].Acta Phytopahologyica Sinica,1997,27(1):85-91.(in Chinese)
[23] 罗文富,喻盛甫,黄 琼,等.三七根腐病复合侵染中病原细菌的研究 [J].云南农业大学学报,1999,14(2):123-127.
Luo W F,Yu S F,Huang Q,et al.Studies on pathogenic bacteria in complex infection ofPanaxnotoginsengroot rot [J].Journal of Yunnan Agricultural University,1999,14(2):123-127.(in Chinese)
[24] 喻盛甫,罗文富,胡先奇,等.三七根腐病中线虫病原问题的研究 [J].云南农业大学学报,1998,13(3):276-279.
Yu S F,Luo W F,Hu X Q,et al.Studies on nematodiasis pathogens in root rot onPanaxnotoginseng[J].Journal of Yunnan Agricultural University,1998,13(3):276-279.(in Chinese)
[25] Kim J H,Kim S G,Kim M S,et al.Different structural modifications associated with development of ginseng root rot caused byCylindrocarpondestructans[J].Plant Pathol J,2009,25(1):1-5.
[26] 周志权,廖永梅,林敏敏. 银杏疫病病原种的鉴定 [J].植物病理学报,2003,33(1):30-34.
Zhou Z Q,Liao Y M,Lin M M.Identification ofPhytophthoraspeciescausing gingko wilt [J].Acta Phytopahologyica Sinica,2003,33(1):30-34.(in Chinese)
[27] 王爱英,楼兵干,徐 同.寡雄腐霉分泌物对植物病原真菌的抑制作用及其对番茄灰霉病的防治效果 [J].植物保护学报,2007,34(1):57-60.
Wang A Y,Lou B G,Xu T.Inhibitory effect of the secretion ofPythiumoligandrumon plant pathogenic fungi and the control effect against tomato gray mould [J].Acta Phytophylacica Sinica,2007,34(1):57-60.(in Chinese)
[28] 朱云枝,强 胜.马唐生防真菌弯抱霉菌株一的生物学特性研究 [J].植物病理学报,2003,33(6):524-529.
Zhu Y Z,Qiang S.The biological characteistics of strain QZ-200 ofCurvulariasp.for controllingDigitariasanguinalis[J].Acta Phytopahologyica Sinica,2003,33(6):524-529.(in Chinese)
[29] 罗利娟,习平根,姜子德,等.纯培养下拟茎点霉分生孢子的形成及意义 [J].菌物学报,2004,23(2):375-380.
Luo L J,Xi P G,Jiang Z D,et al.Taxonomic significance of conidial formation ofPhomopsisin pure culture [J].Mycosystma,2004,23(2):375-380.(in Chinese)
[30] 陈中坚,王 勇,曾 江,等.三七植株的性状差异及其对三七产量和质量影响的调查研究 [J].中草药,2001,32(4):357-359.
Chen Z J,Wang Y,Zeng J,et al.Studies on characteristic distinction and its affect on yield and quality ofPanaxnotoginseng[J].Chinese Traditional and Herbal Drugs,2001,32(4):357-359.(in Chinese)
[31] Lee C,Kim K Y,Lee J E,et al.Enzymes hydrolyzing structural components and ferrous ion cause rusty-root symptom on ginseng (Panaxginseng) [J].J Microbiol Biotechnol,2011,21(2):192-196.
[32] Morris L L,Mann L K.Wound healing,keeping quality,and compositional changes during curing and storage of sweet potatoes [J].Hilgardia,1955,24:143-183.
