2013年版日本生物制剂治疗银屑病指南
2014-03-26肖玉娟梁燕华
肖玉娟 梁燕华*
(广东省广州市南方医科大学南方医院皮肤科,广东 广州 510515)
2013年版日本生物制剂治疗银屑病指南
肖玉娟 梁燕华*
(广东省广州市南方医科大学南方医院皮肤科,广东 广州 510515)
2010年1月,肿瘤坏死因子(TNF)-α单克隆抗体—阿达木单抗(adalimumab)和英夫利西单抗(infliximab)开始用于临床治疗银屑病。2011年1月,人类抗白细胞介素-12/23p40(IL-12/23p40)单克隆抗体—乌司奴单抗(ustekinumab)作为第三种生物制剂,被新批准用于治疗银屑病。虽然所有这些生物制剂有望达到治疗银屑病的极佳疗效,并有助于提高患者的生活质量(QOL),但在使用这些药物之前,必须采取谨慎的安全措施以预防药物不良反应,如严重感染。本英文版指南基于2011年版日本生物制剂治疗银屑病指导及安全手册修订而成,旨在为生物制剂使用提供最新的、具有循证基础的建议和安全措施,并陈述了这三种生物制剂使用的最佳方案、使用生物制剂的医疗设施要求,避免激活结核和HBV感染的安全措施细节,并且推荐了生物制剂的联合治疗方案。
阿达木单抗;生物制剂;指南;英夫利西单抗;银屑病;乌司奴单抗
2010年1月,TNF-α单克隆抗体——阿达木单抗和英夫利西单抗作为银屑病的适应证药物,被批准用于临床。2011年1月,人类抗白细胞介素-12/23p40(IL-12/23p40)单克隆抗体,乌司奴单抗(ustekinumab),作为第三种生物制剂,被新近批准用于治疗银屑病。虽然所有这些生物制剂有望治疗银屑病达到极佳疗效,并可提高患者的生活质量(QOL),但在使用这些药物之前,必须采取谨慎的安全措施以预防药物不良反应,例如严重感染。
2011年[1],通过对日本皮肤科协会(JDA)生物制剂审查委员会所颁布的TNF-α拮抗剂治疗银屑病的指南/安全手册[2](2010年2月版本)进行修订,日本颁布了生物制剂治疗银屑病的指导/安全手册。
新指南旨在为生物制剂使用提供最新的、具有循证基础的建议和安全措施,并陈述了这三种生物制剂使用的最佳方案、使用生物制剂的医疗设施要求,避免激活结核和HBV感染的安全措施细节,并且推荐了生物制剂的联合治疗方案。本指南主要旨在确保皮肤科医师能够安全、合理地使用生物制剂治疗银屑病。
1 对临床医师和医疗机构的要求
截止2013年4月,JDA共批准了525家认证的医疗机构有权使用生物制剂(见JDA官方网站)[3]。部分患者因各种原因,无法经常定期前往认证医院复诊,为方便此类患者,认证医院和其他医院、私人诊所应紧密合作,建立持续长期治疗支持系统。因此,应做到以下三点:①应在JDA认证的皮肤科医师管理、监督、指导下使用生物制剂。这些医师应具备以下条件:对于银屑病的诊断和治疗有丰富的经验,熟知与银屑病相关的并发症,掌握生物制剂的风险,并且有能力处理相关的不良反应。应定期管理生物制剂的安全性资料,并为确保生物制剂长期使用的安全性持续保持谨慎的态度。②医疗机构(医院)应具备以下条件:必须定期进行检查;当突发严重不良反应时,具有紧急处理的能力;与呼吸科、放射科、感染科及其他相关专科医师保持紧密合作。确切的说,这些医院应达到以下要求:经过JDA鉴定的主要皮肤病学培训机构;JDA生物制剂审查委员会认证的设施;且符合以上生物制剂使用的要求。主治皮肤科医师在办公期间或之后,不能得到同医院其他专家的合作也是允许的,但是条件是,必须取得附近医院全职呼吸科医师的书面合作同意(具体细节见JDA官网)。③原则上,在其他医院和私人诊所使用生物制剂仅限于维持治疗的患者,而这些患者已经在上述认证的医院开始进行治疗或症状已经得到明显缓解。因此,生物制剂审查委员会无需批准新的医院或机构,但在日常医疗操作中,必须与认证的医院维持恰当的医院-医院、医院-诊所之间的合作。根据医院-诊所合作安排,应在认证医院进行紧急治疗,即使患者处于维持治疗阶段,应推荐患者在认证医院进行定期随访(如每6个月进行血液、影像学及其他检测)。为了引进生物制剂疗法,不具备上述条件的医院和私人诊所应满足以下要求:a.一名以上通过资格认证的皮肤科医师;b.参加过至少一次生物制剂临床研究;以及c.在紧急情况下,能够及时可靠地与就近医院合作。在JDA生物制剂审查委员会仔细审查和核实递交的文件之后,授予医院和私人诊所认证资格。
2 生物制剂治疗适应证患者的筛选
生物制剂适用于如下所述患者,但应谨慎考虑到治疗因素(如治疗特点、合并治疗)、疾病因素(如疾病类型、严重程度、既往史、并发症)、患者背景(如年龄、性别、治疗记录、性格特点、治疗期望值)以及疾病影响患者QOL的程度;且应密切参考稍后所述的适应证患者重要预防措施及安全手册。系统疗法适用于16岁及其以上年龄的患者,且必须符合以下标准之一:①伴或不伴有银屑病关节炎的斑块型银屑病患者,兼具以下情况之一:a.患者对任何一种标准系统疗法未显示适当疗效,包括光疗法,皮疹面积达到或超过10%体表面积(BSA);以及b.系统疗法难以奏效的顽固性皮疹或关节症状,并且严重影响患者的QOL。②泛发性脓疱型银屑病患者。治疗应依据JDA颁布的泛发性脓疱型银屑病诊疗指南(2010年版)[4]。③红皮病型银屑病患者。应综合考虑既往治疗方案的疗效、并发症、全身情况及其他因素决定是否为适应证患者(仅有英夫利西单抗被允许用于治疗脓疱型银屑病和红皮病型银屑病)。
3 适应证患者的重要预防措施
一般来说,在使用生物制剂治疗无关节炎的斑块型银屑病(寻常型银屑病)患者之前,应首先考虑其他的系统疗法。因此,生物制剂治疗斑块型银屑病患者的适应证有:a.环孢素、阿维A、PUVA和窄谱中波紫外线UVB等疗法未见充分疗效;b.由于既往治疗的不良反应,患者不能耐受这些药物或照射的足够剂量;c.对上述疗法有效,但在减量或停药后病情易于反弹,而由于这些治疗需长期使用,患者对累积治疗不良反应的担忧日益增加;或者d.存在与这些治疗相矛盾的合并症而难以实施这些治疗方案。
与此同时,由于银屑病关节炎造成患者进行性关节毁损而致残,严重影响患者生活质量,所以,在致残前使用生物制剂控制银屑病关节毁损至关重要。因此,推荐在银屑病关节炎的早期阶段使用生物制剂。日本和国外的临床研究显示乌司奴单抗可改善银屑病关节炎患者的关节症状。然而,时至今日,由于缺乏乌司奴单抗抑制关节损害的证据,在国外,乌司奴单抗尚未被批准用于治疗银屑病关节炎。
3.1 伴或不伴有银屑病关节炎的斑块型银屑病(寻常型银屑病/关节病型银屑病)。患者对包括光疗法在内的标准系统疗法无充分反应、皮疹面积≥10%体表面积、或者是顽固性皮疹、对标准系统疗法无效的关节症状并且严重损害患者的QOL。值得注意的是,乌司奴单抗治疗银屑病关节炎应限于皮疹面积≥10%体表面积者,或顽固性皮损造成QOL严重影响者,也就是说,并不只是具有关节症状。
3.2 系统疗法的标准。在日本,阿达木单抗[5]、英夫利西单抗[6]和乌司奴单抗[7]的临床研究对象均为斑块型银屑病患者,这些患者可伴或不伴有关节炎(寻常型银屑病/银屑病关节炎),患者均需要系统疗法,包括光疗法在内;皮疹面积≥10%体表面积;银屑病面积与严重程度指数(PASI)达到或超过12分。实际上,这些标准相当于美国和欧洲的中度至重度银屑病分级。10分法则:BSA≥10%;PASI≥10或者皮肤病生活质量指数(DLQI)≥10[8],为适用于系统疗法的有用标准,并在全世界均广泛使用。
3.3 生活质量(QOL)。由于银屑病患者通常表现出外观上的变化和症状,包括瘙痒和关节痛,因此,无论在心理和社会方面,患者的生活质量均受到严重影响,据报道,其严重程度与癌症、心血管疾病和糖尿病等类似甚至更重。由于这个原因,在美国[9,10]和欧洲[11-13],治疗策略已发展至重点关注患者的QOL。DLQI达到10分及其以上者,则严重影响患者的QOL,通常为重度分级。DLQI独立于BSA及PASI评分,被视为适用系统疗法的标准。一般来说,严重影响QOL的顽固性皮疹部位有:头颈部、手掌、足掌、手指及指甲。日本的临床试验均未将QOL作为纳入标准。但在这些临床试验中,DLQI的平均基线分别为:英夫利西单抗13.0;阿达木单抗8.0;乌司奴单抗10.0。银屑病致残指数(PDI)为银屑病的特异性参数,对于QOL评估有重要意义,而DLQI对于此方面亦有意义,但主要用于评估一般性皮肤疾病。在日本,PDI主要用于乌司奴单抗的临床试验,其平均基线为14.0。
3.4 关节症状
3.4.1 银屑病关节炎的传统疗法包括非甾体类抗炎药、缓解病情的抗风湿药物和口服皮质类固醇激素。慢性进展性关节炎,通常伴随着银屑病出现,其主要特征为,与类风湿性关节炎(RA)相类似的关节毁损和变形,随着疾病的进展导致患者运动功能障碍,从而严重影响患者的QOL。因此,在本病出现临床症状而影响患者的日常生活、活动之前,进行早期干预、抑制关节毁损至关重要。
3.4.2 国外临床试验显示TNF-α抑制剂可预防银屑病关节炎患者的关节毁损进展。因此,在美国,指南推荐对于中度至重度银屑病关节炎,应在疾病早期阶段进行TNF-α抑制剂治疗。同时,在国外进行的一项针对银屑病关节炎患者的II期临床研究显示,乌司奴单抗可改善患者的病情活动(美国风湿病协会评分)和疼痛症状(视觉模拟评分法),但值得注意的是,此项研究中涉及的剂量方案与日本研究有所不同[11,12]。然而,研究并未评估乌司奴单抗对于关节结构损害的预防作用,而对于关节毁损的抑制作用,国外正在进行III期临床研究。
3.4.3 外周关节炎的具体标准为:①≥3个肿胀关节;②≥3个疼痛关节;③C反应蛋白(CRP)≥1.5 mg/dL。符合上述所有标准的患者可予以生物制剂治疗。然而,若患者出现致残性破坏性关节炎,或者伴随着QOL严重受影响、具有类似严重度的关节症状,亦可考虑行生物制剂治疗。
3.4.4 巴氏强直性脊柱炎疾病活动度指数≥4分的轴向型关节炎患者,亦为生物制剂治疗的适应证。
3.4.5 阿达木单抗、英夫利西单抗和乌司奴单抗治疗斑块型银屑病患者的有效率较高。阿达木单抗的75%有效率为63%~71%(治疗16周后);英夫利西单抗为69%~80%(治疗10周以后);乌司奴单抗为60%~67%(治疗12周以后)。
3.4.6 目前尚未建立治疗斑块型银屑病患者的生物制剂选择标准。根据英国(UK)指南(2009年版)[11],乌司奴单抗的适应证仅限于银屑病,并不适用于类风湿关节炎(RA)或炎症性肠病,其定位是需要生物制剂治疗但不适宜TNF-α抑制剂治疗或对其无效的患者。然而,根据美国指南(2010年版)[10],乌司奴单抗的适应证与TNF-α抑制剂相类似。
3.4.7 若斑块型银屑病患者因使用英夫利西单抗而导致继发性失效(例如:虽然在一段时间内有效,但疗效却逐渐减退,或者比治疗之前更加严重),则可寄希望于阿达木单抗,虽然在一定程度上疗效也会下降。此外,乌司奴单抗亦可用于对于TNF-α抑制剂不敏感的患者,且可无需考虑既往治疗。
3.4.8 国外对于银屑病关节炎的共识为:无论既往治疗如何,由于TNF-α抑制剂在预防关节毁损进展中的作用,应视其为一线治疗方案,乌司奴单抗为二线治疗方案。
3.5 泛发性脓疱型银屑病(GPP)。由于GPP患者数量有限,目前尚无生物制剂治疗GPP的随机、双盲临床研究。然而,在日本,有报道已表明TNF-α抑制剂治疗GPP有效,且已证实:GPP为英夫利西单抗的适应证。为了确保TNF-α抑制剂治疗GPP患者的安全性,在全国范围内,收集和分析已经接受此治疗方案的相关数据很有必要。GPP的诊断标准应依据2010年JDA所颁布的泛发性脓疱型银屑病诊疗指南[4]。掌跖脓疱病、角膜下脓疱病和急性发疹性脓疱病并不属于GPP范畴,均不为生物制剂治疗的适应证。
3.6 红皮病型银屑病。由于红皮病型银屑病患者数量有限,目前尚无生物制剂治疗本病的随机、双盲临床研究。然而,有报道已显示了阿达木单抗和乌司奴单抗治疗此病的疗效,亦包括英夫利西单抗,而在日本,英夫利西单抗为治疗红皮病型银屑病的唯一适应证药物。
4 剂量和用法
4.1 阿达木单抗。通常,阿达木单抗首次给药(0周)为80 mg皮下注射(s.c);从第2周开始,每两周皮下注射40 mg,若患者未获得充分疗效,可增加剂量至80 mg。
4.2 英夫利西单抗。英夫利西单抗,以5 mg/kg体质量首次剂量缓慢静脉滴注(i.v.),持续时间需≥2 h。2周及6周后再次给药,此后,每隔8周给药。如果在前三次的治疗中,未出现输液反应,可从第14周开始,输液时间可减至1 h。
4.3 乌司奴单抗。通常为45 mg乌司奴单抗皮下注射。一般来说,乌司奴单抗治疗方案为:第0周(首次给药)及第4周皮下注射,此后每隔12周给药1次。若患者未显示充分疗效,可增加剂量至90 mg。
5 给药方式和剂量的预防措施
5.1 剂量调整
5.1.1 阿达木单抗:通常,阿达木单抗的显效时间为开始治疗后的4~16周。如果在16周内病情未见好转,应谨慎考虑是否继续治疗,如调整剂量40~80 mg。如4周或4周以后症状明显加重,可增加用药剂量。
5.1.2 英夫利西单抗:由于英夫利西单抗给药方式是以5 mg/kg体质量静脉输注,因此,剂量可按照体质量调整,然而,与治疗类风湿性关节炎不同的是,在治疗银屑病的过程中,不得由于疗效降低而增加或缩短治疗间隔时间(临床研究正在进行中)。
5.1.3 乌司奴单抗:如果在首次治疗后的28周内,患者病情未见好转,应改变治疗计划,可考虑将剂量从45 mg增加至90 mg。如果剂量增加后,患者病情仍未见好转,应谨慎考虑是够继续进行治疗。
5.2 给药部位:建议每次更换阿达木单抗和乌司奴单抗的注射部位。若皮肤有任何异常(例如:伤口、皮疹、发红、硬化),包括银屑病皮损和皮肤敏感,均应避免皮下注射。
5.2.1 自行注射:由于阿达木单抗可自行注射,能满足患者不同的需要,因此是一个很方便的药物。然而,当使用阿达木单抗时,应尤其谨慎小心。在患者自行注射之前,医师应对患者进行恰当宣教和培训,并阐明此药的作用机制。在确保患者充分理解自行注射的风险,且能够正确操作后,在医师的监管和指导之下方可自行注射。如果在首次注射之后,局部出现疑似感染等不良反应,或出现妨碍自行注射的情况,应指示立即停止自行注射,且应采取恰当措施,例如在医师的密切监管下,谨慎操作。乌司奴单抗和阿达木单抗给药方式相同,均为皮下注射(s.c.),但不允许自行注射。
5.2.2 输液反应:英夫利西单抗可引起严重输液反应,如类过敏反应。鉴于此,医疗机构应建立能够予以患者紧急治疗的环境,也就是说,在紧急情况下,予以吸氧、肾上腺素及皮质类固醇时,可在床边行气道管理。在一项临床研究中,日本对接受英夫利西单抗治疗的类风湿关节炎患者进行了上市后不良反应监测,结果表明,中断2年或以上英夫利西单抗治疗后再次接受治疗者,严重输液反应的发生率明显增高。因此,对于长期中断或治疗失败再次接受治疗的患者,应采取相当谨慎的预防措施。因此,对于英夫利西单抗既往有过严重输液反应史、以及长时间中断治疗再次接受治疗者,应遵循以下原则,使用下述药物以预防输液反应。从输液前1周直至输液的当天,应予以组胺H1受体拮抗剂口服(p.o.)(亦可使用组胺H2受体拮抗剂)。首次输注的前1.5 h,应口服25~50 mg苯海拉明(亦可使用其他抗组胺药)。应予以口服650 mg对乙酰氨基酚。对于既往有过严重输液反应的患者,应从治疗前1 d至治疗后1 d(总计3 d),口服皮质类固醇(强的松20 mg/d)。在即将输注英夫利西单抗的前20 min,应予以氢化可的松100 mg或甲强龙20~40 mg静脉输注,二者择其一。
5.3 禁忌证
5.3.1 存在严重感染灶的患者,例如活动性肺结核。若患者存在严重感染,则应首要恰当治疗感染。在予以生物制剂治疗之前,应对患者行病毒检测,例如乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)。虽然目前尚无乌司奴单抗致乙型肝炎病情活动和加重的报道,但TNF-α抑制剂,却有相关的报道。因此,不应对HBV感染的患者行生物制剂治疗。生物制剂对于HCV的不良反应,目前尚未达成共识。但是,在予以患者生物制剂治疗之前,应对其行HCV检测,此外,如果HCV阳性患者迫切需要生物制剂治疗,应进行谨慎随访。
5.3.2 心功能III级或以上的充血性心力衰竭患者。根据纽约心脏协会(NYHA,1964年版)所颁布的心功能分级具体如下:Ⅰ级:无症状,体力活动不受限。Ⅱ级:体力活动轻度受限。日常活动即可引起乏力、心悸、呼吸困难或心绞痛等症状。Ⅲ级:活动明显受限,轻于日常的活动即可引起上述症状。Ⅳ级:休息时亦有上述症状,最轻的体力活动亦可加重。对于NYHA心功能分级II级或以上的患者,使用生物制剂时,应谨慎评估疗效与不良反应,应对接受治疗患者密切随访。
5.3.3 正在接受恶性肿瘤治疗的患者。
5.3.4 既往或目前患有脱髓鞘疾病的患者(例如多发性硬化)。众所周知,TNF-α抑制剂可导致脱髓鞘疾病患者病情复发或加重。目前国外正在进行乌司奴单抗治疗伴有脱髓鞘疾病患者的临床研究。在这些研究中,虽然与安慰剂相比,疗效无明显差异,但多发性硬化病情并未显示复发或加重。
5.4 对易发生不良反应患者应采取的预防措施和安全手册。筛选适应证患者的重要检测内容包括面谈、结核筛查、胸部检查(推荐行X线及CT平扫检查如果不能同时进行,推荐CT平扫)。此外,建议行干扰素(IFN)-γ释放试验(QuantiFERON检测或T-SPOT)。应基于所有的检测结果,进行全面评估,必要时,与呼吸科、放射科、感染科专家共同探讨,全面检查既有或尚未排除的呼吸道感染,包括肺结核在内(见如下第2条)[14]。
对于HBV患者,乙肝表面抗原(HBs-Ag)阴性,但乙肝表面抗体(HBs-Ab)或乙肝核心抗体(HBc-Ab)均阳性,激活HBV后,可能有发生严重肝炎的风险。因此,推荐除了乙肝表面抗原(HBs-Ag),亦应对乙肝表面抗体(HBs-Ab)或乙肝核心抗体(HBc-Ab)进行筛查(见如下第3条)[15,16]。开始行生物制剂治疗前,需行检测和谈话内容列表,见表1;开始生物制剂治疗后,需定期检测内容列表,见表2;生物制剂治疗过程中,预防肺结核的措施,见图1;预防免疫抑制剂诱发HBV再激活的措施,见图2;生物制剂治疗过程,应对发热、咳嗽、呼吸困难的方法流程图,见图3。
生物制剂治疗期间,若患者诉不适症状,例如发热、咳嗽或呼吸短促,则应排查呼吸道感染或间质性肺炎,且应按肺炎诊断流程图进行诊断(图3)。
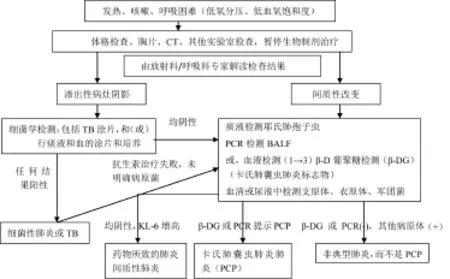
图3 生物制剂治疗期间肺炎的诊断流程缩略语:CT,计算机断层扫描;MTX:甲氨蝶呤;PCR:聚合酶链式反应;TB:肺结核;TNF:肿瘤坏死因子
5.4.1 明确或疑似感染的患者:①生物制剂能够减弱免疫反应,亦有可能影响正常的免疫反应。因此,应首要治疗感染,在感染得到恰当

表1 首次生物制剂治疗的检查列表(筛查适应证患者用) ロ必填项目


表2 生物制剂治疗开始后的检测列表(监控用)

图2 免疫抑制剂治疗或化疗诱发HBV感染再激活的预防和治疗缩略语表:HBsAg:乙肝表面抗原;HbcAb:乙肝核心抗体;HbsAb:乙肝表面抗体; HbeAg:乙肝e抗原;HBV:乙型肝炎病毒
因此,推荐每半年行复查临床指标。若HBs-Ab或HBc-Ab阳性,则应更更频繁。若ANA阳性,则应行ds-DNA检测。控制后方可行生物制剂治疗。如果患者患有慢性感染性疾病,例如非典型结核分支杆菌感染,若治疗收益明显大于风险,主治医师应征得患者同意,谨慎评估后方可考虑行生物制剂治疗。如果患者患有慢性感染性并发症,主治医师应与此方面的专家密切合作。②生物制剂治疗过程中,对于细菌、真菌、原虫和病毒感染应相当谨慎。必要时,可行适当检测。当出现发热、咳嗽、呼吸困难时,应考虑到细菌性肺炎、肺结核、卡氏肺囊虫肺炎并采取相应措施(图3)。对于伴有以下风险因素的患者,例如老年患者、患有肺病病史、因并发症正在接受系统皮质类固醇治疗者,由于这些因素可致严重感染,可考虑预防性使用复方磺胺甲恶唑。③目前尚无接受生物制剂治疗过程中,活疫苗导致感染的报道。然而,由于不能排除这种情况发生的可能性,在生物制剂治疗过程中,不应使用活疫苗。
5.4.2 既往有肺结核病史患者,或胸部影像学存在陈旧性病灶(如钙化、条索化、胸膜增厚),结核菌素试验(直径≥10 mm),IFN-γ释放试验(QuantiFERON检测或T-SPOT)均阳性者。①生物制剂可激活潜在感染。对于结核激活存在高风险的患者,从首次治疗后的第三周开始,应预防性口服异烟肼(IHN;通常剂量为300 mg/d,对于低体质量患者,予以5 mg/(kg·d),连续服用6个月。若患者同时患有糖尿病,或疑似免疫功能不全患者,IHN应连续服用9个月。预防性给药仍不能完全排除发生结核的可能性。因此,应定期(每8~16周)复查胸片及IFN-γ释放试验(QuantiFERON检测或T-SPOT),必要时,可再次行IHN治疗[14]。②生物制剂治疗过程中,应相当谨慎,以预防肺结核的发生。应定期行胸部影像学检查(如每6个月行胸部X线检查),必要时,可行QuantiFERON或T-SPOT检测。通常在肺结核感染后的8周后,出现结核菌素皮肤检测的变化和呼吸道症状。生物制剂治疗过程中,QuantiFERON检测和T-SPOT均为结核再激活的快速敏感指标。③即使结核菌素试验和IFN-γ释放试验均阴性的患者,在开始行生物制剂治疗后,亦可能发生活动性肺结核。因此,只要患者持续接受生物制剂治疗,应谨慎关注肺结核的发生。④应密切关注肺外结核发生的可能性,推荐与呼吸科、放射科和(或)感染科专家及时合作。
5.4.3 HBV感染患者(包括HBs-Ab阳性或HBc-Ab阳性患者)。①HBs-Ag阴性、HBs-Ab或HBc-Ab阳性者为HBV既往感染,现已临床治愈患者。然而,有报道显示,这些HBV既往感染者,在很长一段时间内,HBV-DNA在肝脏和外周血单核细胞中持续以低水平复制,因此,在移植或者使用强效免疫抑制剂后,病毒再激活可发生严重肝炎。因此,日本颁布了免疫移植治疗或化疗所致HBV感染再激活预防措施[15],并于2013年,编入HBV感染治疗指南[16]。该指南推荐所有正在接受免疫移植治疗和化疗患者,除了检测HBs-Ag外,均应检测HBs-Ab和HBc-Ab。因此,根据该指南,推荐接受生物制剂患者均应进行HBs-Ag、HBs-Ab和HBc-Ab检测。②如果HBs-Ab或HBc-Ab阳性,推荐行HBV-DNA定量检测。若HBV-DNA水平高于检测值(如2.1log 拷贝/mL),患者应转诊至肝脏病专家(消化科专家),可考虑行核酸类似物治疗。若HBV-DNA水平小于检测值,可开始行生物制剂治疗;但应定期检测肝功和HBV-DNA复制水平(HBV再激活后,由于抗体滴度会下降,对于Hbs-Ab阳性者,应随访抗体滴度的变化)。如果生物制剂治疗期间,HBV-DNA水平高于检测值(此时,HBs-Ag亦可呈现阳性状态),应与肝脏病专家协商,谨慎决定是否继续或中断治疗,同时,可开始行核酸类似物治疗(图2)。
5.4.4 目前有症状提示或有脱髓鞘患者家族史的患者。①TNF-α可诱发脱髓鞘疾病,或导致其病情复发、加重。通过神经系统检查和影像学诊断,谨慎权衡风险和疗效之后,方可考虑行生物制剂治疗,且首次行生物制剂治疗后,应对患者密切观察。②迄今为止,虽然尚无临床研究显示乌司奴单抗可诱发脱髓鞘疾病,但推荐首次乌司奴单抗治疗后,对患者进行适当随访。
5.4.5 既往或目前患有严重血液系统疾病的患者(如全血细胞减少症,再生障碍性贫血)。虽然罕见,但目前有文献报道了TNF-α抑制剂相关的血液系统不良事件,包括严重的全血细胞减少症(例如血小板减少症、白细胞减少症)。如果患者出现任何症状和体征提示血液恶液质(例如持续发热、皮下出血、皮肤出血或苍白),患者应立即前往相关医疗部门进行咨询。
5.4.6 既往有恶性肿瘤病史或治疗史、或存在癌前期病变患者。①由生物制剂作用机制推断,其有增加恶性肿瘤发生率的可能性,但由于缺少足够的数据,目前尚未达成定论。因此,对于既往有恶性肿瘤病史或治疗史、或存在癌前期病变(如食道、宫颈、结肠的病变)的患者,应在权衡利弊基础上,谨慎使用生物制剂。在生物制剂治疗过程中,应密切关注是否出现新的恶性肿瘤。②根据英国指南[11],在恶性肿瘤根除术5年后,及确认目前无病情复发或转移后,方可使用生物制剂。③据指出,长期频繁接受紫外线疗法的患者,其皮肤癌发生率明显增高。如果长时间紫外线疗法之后使用生物制剂,建议持续密切观察患者皮肤癌的发生。
5.4.7 患有先天性或获得性免疫缺陷综合征、或由于使用其他系统免疫抑制剂导致免疫功能受损的患者。生物制剂减弱免疫反应,可能影响正常免疫反应。如果患者使用其他免疫抑制剂造成免疫功能下降,则生物制剂可能增加感染的风险。因此,应在谨慎评估风险与收益基础上,方可考虑使用生物制剂,治疗开始后,亦应密切观察患者。
5.4.8 老年患者:①由于65岁及其以上的银屑病老年患者纳入临床研究的数量有限,关于老年患者(≥65岁)和非老年患者(<65岁)的严重不良事件发生倾向,目前尚无定论。然而,生物制剂治疗类风湿关节炎的临床研究显示:老年患者严重不良事件的发生率有增加趋势。鉴于老年患者生理功能,包括免疫功能普遍下降,因此,老年患者使用生物制剂时,有必要进行密切观察,并注意感染等不良反应。②可考虑使用流感疫苗或肺炎球菌疫苗以尽可能预防呼吸道感染。注:报告已显示,TNF-α并不影响流感疫苗产生中和性抗体。
5.4.9 儿童:由于目前尚未建立生物制剂治疗儿童的安全性资料,因此,一般来说,不应对儿童使用该类药物。然而,目前已有英夫利西单抗治疗儿童GPP的病例报道。当患儿伴有全身症状且处于急性加重期,无其他系统治疗方案可供选择时,TNF-α抑制剂,例如英夫利西单抗,可为紧急治疗的有用选择。在此种情况下使用生物制剂,推荐参照JDA所颁布的泛发性脓疱型银屑病诊疗指南(2012年版)[4],但症状缓解后,应尽可能予以非生物制剂治疗方案。
5.4.10 妊娠、分娩或哺乳期患者。动物实验研究显示,英夫利西单抗和乌司奴单抗可通过胎盘屏障,并可通过乳汁排泄(阿达木单抗并未得到确定),目前尚未建立胎儿和婴儿使用生物制剂的安全性资料。因此,生物制剂治疗期间,应避免妊娠和哺乳。然而,迄今为止,动物实验和人类治疗经验的少有报道显示生物制剂治疗可致后代毒性和致畸性。因此,如胎儿非可控性地暴露于生物制剂,建议立即停止生物制剂使用,并在妊娠过程中密切随访。
5.4.11 接受手术的患者。生物制剂可能影响术后伤口愈合和感染。因此,推荐阿达木单抗末次治疗至少2周后、英夫利西单抗末次治疗至少4周后、乌司奴单抗末次治疗至少8周后方可行外科手术。术后,在确保伤口已经全部愈合以及无感染并发症情况下,方可再次行生物制剂治疗。
提示1:一旦发生狼疮样综合征,以及ANA、ds-DNA呈现阳性改变,应立即中断生物制剂治疗(TNF-α可诱发ANA、ds-DNA阳性改变,以及促发狼疮样综合征症状)。虽然目前尚无乌司奴单抗诱发狼疮样综合征的报道,然而,由于目前无充分的经验,以及抗体转阳率仍不明确,而难以正确的评估。
提示2:已有报道显示,其他生物制剂可诱发致命性进行性多灶性脑白质脑病(PML),如那他珠单抗(抗A4整联蛋白抗体治疗多发性硬化),利妥昔单抗(抗-CD20抗体治疗恶性淋巴瘤),以及依法珠单抗(抗-CD11a抗体,国外曾用于治疗银屑病,但在2009年被撤销)。
虽然TNF-α抑制剂不易引起PML,但应保证相关预防措施。此病首发症状为步态蹒跚,随后为口齿不清的讲话和健忘,随着疾病进展,会出现意识障碍。报道显示,HIV患者和接受多种免疫抑制剂(包括环孢素)治疗的患者可出现类似症状。这些研究结果表明,PML的发生与持续性免疫抑制状态相关。此外,国外有报道发现,乌司奴单抗治疗患者后出现可逆性后部白质脑病综合征,但因果关系仍不清楚。
6 生物制剂联合治疗
6.1 联合局部治疗:日本临床研究显示,生物制剂联合局部皮质类固醇或活性维生素D3治疗后,并未出现严重临床不良反应。然而,生物制剂联合局部药物使用时,应密切观察不良反应和皮肤感染的发生。
6.2 联合系统治疗
6.2.1 目前尚未建立生物制剂联合其他系统疗法或系统紫外线疗法的安全性和有效性资料。如果联合治疗实有必要,应谨慎评估疗效与风险,联合治疗开始后,应对患者进行密切随访。
6.2.2 除了脑白质病的风险,环孢素可进一步降低机体免疫功能低下状况,可增加严重感染的风险。因此,作为一般原则,环孢素不应与生物制剂同时使用。在日本临床研究中,当患者从使用环孢素转换成英夫利西单抗时[17],PASI评分快速下降,并未出现病情恶化,且并未出现值得关注的安全性问题,即使是转换治疗方案之前立即停止环孢素。然而,症状复发仍确为环孢素转换成生物制剂时的一个顾虑。在这种情况下,可考虑联合使用环孢素和生物制剂几周,以平稳度过转换期,这不失为一种有效的方法。且美国指南[10],推荐了一种类似的、相对短持续时间的联合疗法。欧洲指南[11,12]建议可联合使用阿达木单抗和环孢素,在同样情况下,亦可联合使用阿达木单抗和甲氨蝶呤,这意味着这些系统药物联合使用不是绝对受限的。然而,当联合使用药物时,必须慎重考虑患者的年龄和其他背景因素,向患者清楚明确地解释感染的风险,且治疗过程中,应密切监测。
6.2.3 阿维A,为类维生素A药物,并未在日本上市,但国外有报道显示,联合生物制剂治疗并未出现显著临床不良反应。然而,阿维A在日本可自行购买,因此,建议谨慎评估风险收益后,方可联合使用。
6.2.4 甲氨蝶呤在国外广泛使用。美国指南推荐长期甲氨蝶呤治疗后,行肝脏活检。在日本,甲氨蝶呤不为斑块型银屑病或银屑病关节炎的适应证药物,然而,美国指南尚无甲氨蝶呤治疗的安全准则。按规定,当甲氨蝶呤单药治疗RA疗效不佳时,方可联合英夫利西单抗治疗。此外,据报道,对于RA,联合使用英夫利西单抗和甲氨蝶呤疗效优于单用英夫利西单抗。然而,对于伴或不伴银屑病关节炎的斑块型银屑病,目前尚无研究评估联合使用英夫利西单抗和甲氨蝶呤的有效性。
[1] Ohtsuki M,Terui T,Ozawa A,et al.Guideline and safety manual for use of biologic agents in psoriasis (the 2011 version)[J].Jpn J Dermatol,2011,121(10):1561-1572.
[2] Ohtsuki M,Terui T,Ozawa A,et al.The guideline and safety manual for use of anti-TNFa agents in psoriasis[J].Jpn J Dermato l,2010,120(1):163-171.
[3] JDA website.http://www.dermatol.or.jp/.
[4] Iwatsuki K,Terui T,Ozawa A,et al.The guidelines for diagnosis and treatment of generalized pustular psoriasis 2010 (Treatment guidelines incorporating TNFa inhibitors) [J].Jpn J Dermatol 2010,120(7):815-839.
[5] Asahina A,Nakagawa H,Etoh T,et al.Adalimumab in Japanese patients with moderate to severe chronic plaque psoriasis:efficacy and safety results from a phase 2/3 randomized controlled study[J].J Dermatol,2010,37(4):299-310.
[6] Torii H,Nakagawa H.Japanese Infliximab Study Investigators. Infliximab monotherapy in Japanese patients with moderateto-severe plaque psoriasis and psoriatic arthritis.A randomized,double-blind,placebo-controlled multicenter trial[J]. J Dermatol Sci,2010,59(1):40-49.
[7] Igarashi A,Kato T,Kato M,et al.Japanese Us-tekianmab Study Group.Efficacy and safety of ustekinumab in Japanese patients with moderate-to-severe plaque-type psoriasis:long-term results from a phase 2/3 clinical trial[J].J Dermatol,2012,39(3):242-252.
[8] Finlay AY.Current severe psoriasis and the rule of tens[J].Br J Dermatol,2005,152(5):861-867.
[9] Menter A,Gottlieb A,Feldman SR,et al.Guidelines of care for the management of psoriasis and psoriatic arthritis.Section 1.Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics[J].J Am Acad Dermatol,2008,58(5):826-850.
[10] Menter A,Korman NJ,Elmets CA,et al.Guidelines of care for the management of psoriasis and psoriatic arthritis. Section 6.Guidelines of care for the treatment of psoriasis and psoriatic arthritis:case-based presentations and evidence-based conclusions[J].J Am Acad Dermatol,2011,65(1):137-174.
[11] Smith CH,Anstey AV,Barker JNWN,et al.British Association of Dermatologists’ guidelines for biologic interventions for psoriasis 2009[J].Br J Dermatol,2009,161(5):987-1019.
[12] Pathirana D,Ormerod AD,Saiag P,et al.European S3-guidelines on the systemic treatment of psoriasis vulgaris[J].J Eur Acad Dermatol Venereol,2009,23(Suppl.2):5-70.
[13] Nast A,Boehncke WH,Mrowietz U,et al.S3-guidelines on the treatment of psoriasis vulgaris[J].J Dtsch Dermatol Ges,2012,10(Suppl.2):S1-S95.
[14] The Prevention Committee of the Japanese Society for Tuberculosis.Treatment guidelines for latent tuberculosis[J]. Kekkeku (Jpn J of Tuberculosis),2013,88(5):497-512.
[15] Tsubouchi H,Kumada H,Kiyosawa K,et al.Prevention of immunosuppressive therapy- or chemotherapy-induced reactivation of hepatitis B virus infection—Joint report of the intractable liver diseases study group of Japan and the Japanese study group of the standard antiviral therapy for viral hepatitis[J].Kanzo(Jpn J Hepatol),2009,50(1):38-42.
[16] Asahina Y,Izumi N,Oketani M,et al.Guidelines for the management of hepatitis B virus infection[J].Kanzo (Jpn J Hepatol),2013,54(3):402-472.
[17] Torii H,Nakagawa H.Japanese Infliximab Study Investigators. Long-term study of infliximab in Japanese patients with plaque psoriasis,psoriatic arthritis,pustular psoriasis and psoriatic erythroderma[J].J Dermatol,2011,38(3):321-334.
R758.63
:A
:1671-8194(2014)31-0394-06
*通讯作者:E-mail: liangdoctor@163.com
