球形活性炭的制备及其对苯并噻吩的吸附研究
2014-03-25崔安磊李文秀范俊刚孙向乐张志刚
崔安磊, 李文秀, 范俊刚, 孙向乐, 张志刚
(沈阳化工大学 辽宁省化工分离技术重点实验室, 辽宁 沈阳 110142)
近年来雾霾天气困扰中国,空气污染问题受到人们的关注.燃油中的硫化物燃烧产生的SOx会导致尾气处理催化剂中毒,造成尾气中有害气体排放增多,进而导致酸雨、雾霾天气和空气污染.因此,燃油脱硫成为世界范围内的重要研究课题[1-2].催化加氢技术是最传统燃油脱硫技术,但存在操作条件苛刻、汽油辛烷值损失较大和对苯并噻吩及其衍生物的脱除效果不好等缺点[3].
近年来,在常温、常压条件下进行吸附脱硫逐渐成为国内外学者研究的热点[4-7],选择合适的吸附剂是吸附脱硫的关键.球形活性炭是一种应用广泛的吸附剂和催化剂载体材料,具有球形度好、机械强度高和微孔丰富等优点[8].本文选用弱酸性酚醛系阳离子交换树脂为原材料,对其进行高温炭化和CO2活化,得到具有微孔结构的球形活性炭吸附剂.从吸附平衡和吸附动力学两方面考察吸附剂对模拟汽油中苯并噻吩的吸附性能.
1 实验部分
1.1 原料和仪器
122型弱酸性酚醛系阳离子交换树脂,安徽三星树脂厂;正庚烷、苯并噻吩,国药集团化学试剂沈阳有限公司.所用试剂均为分析纯.
气相色谱(SP-3420,FPD检测器),北京北分瑞利分析仪器(集团)有限责任公司;真空管式炉(HTL1400-80),上海皓越仪器设备有限公司.
1.2 球形活性炭的制备
将一定量经预处理的122型树脂置于真空管式炉中,在N2保护下以5 ℃·min-1升温到600 ℃,炭化1 h,再以同样升温速率升至850 ℃,通入CO2,活化2 h,最后在N2保护下冷却至室温,得到球形活性炭材料.
1.3 球形活性炭的表征
离子交换树脂的热重分析在日本精工的EXSTAR6300型综合热分析仪上进行,样品在测试前经70 ℃真空干燥24 h以除去其含有的大量水分.球形活性炭的表面形貌采用日本电子公司生产的JSM-6360LV型扫描电子显微镜观察.红外光谱表征在美国热电公司生产的NEXUS470型红外光谱仪上进行,采用KBr压片,样品与KBr的质量比为1/500~1/1 000,空白KBr为背景.测试条件:分辨率为0.4 cm-1,扫描谱的范围为4 000~400 cm-1.样品的比表面积和孔结构分析采用低温 N2吸附方法测定,所用仪器为SSA-4300孔隙比表面分析仪.
1.4 球形活性炭对苯并噻吩的吸附性能
1.4.1 吸附动力学实验
用苯并噻吩(BT)模拟真实汽油中的硫化物,用正庚烷模拟真实汽油中烷烃.将0.2 g球形活性炭放入玻璃瓶中,加入6 mL一定硫浓度的模拟汽油.以吸附剂质量(g)与模拟油体积(mL)比为1∶>30(剂油比)进行动力学实验,定时取样测定其硫的质量浓度,通过公式(1)计算吸附硫容.
qt=V(ρ0-ρt)/m
(1)
其中,qt是时间t时的吸附硫容(以硫元素质量分数计算), mg/g;V是溶液体积,L;ρ0、ρt分别是初始和时间t时溶液中硫的质量浓度,mg/L;m是所用吸附剂的质量,g.
1.4.2 吸附平衡实验
将一系列不同质量的球形活性炭放入玻璃瓶中,加入等体积的一定硫浓度的模拟汽油,静态吸附12 h,用气相色谱测定其硫的质量浓度.通过公式(2)计算平衡硫容.
qe=V(ρ0-ρe)/m
(2)
其中,qe为平衡硫容(以硫元素质量分数计算), mg/g;ρe为平衡时溶液中硫的质量浓度,mg/L.
2 结果和讨论
2.1 热重分析
122型离子交换树脂在N2气氛下的热重曲线如图1所示.离子交换树脂是一种具有网状结构的高分子聚合物.在受热过程中,经历小分子端基的解聚、分子骨架收缩和重排等过程,最终形成具有乱层堆积的石墨微晶结构[9].由图1可见,122型树脂的失重主要分为4个阶段[10]:第一阶段是在30~280 ℃,树脂中水分蒸发和小分子化合物的脱除;第二阶段是在280 ℃左右,树脂中活性较高的亚甲基部分发生断链反应,树脂部分裂解;第三阶段在280~400 ℃,失重较缓慢,释放CO、CO2和CH4等小分子有机物;第四阶段在400~600 ℃,失重迅速,树脂上的酚羟基之间发生缩合反应,并进一步进行结构重排.600 ℃之后失重趋于平稳,最终残炭率为42.45 %.因此,选择炭化温度为600 ℃,时间为1 h.
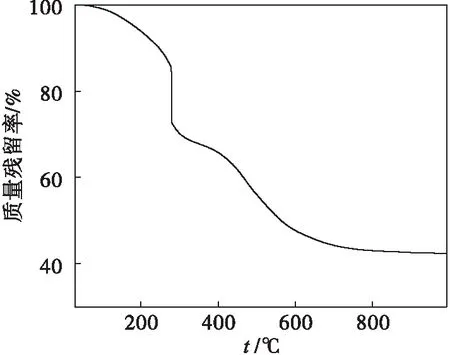
图1 122型树脂的热重曲线Fig.1 TG curves of 122 resin
2.2 红外光谱分析
图2为122型树脂和球形活性炭(SAC)的红外光谱图.

图2 122型树脂和球形活性炭的红外光谱图Fig.2 Infrared spectra of 122 resin and SAC
由图2可知:树脂在经过炭化和活化后,表面基团发生较大变化.其中以波数3 421 cm-1为中心的强而宽的吸收带为缔合羟基(酚羟基和羧基中的—OH)的伸缩振动峰,而球形活性炭在3 444 cm-1的峰明显变弱,表明制备过程中随着温度的升高,树脂发生缩聚,羟基结合氢原子变成水被脱除;2 922 cm-1处的峰为—CH2的反对称伸缩振动峰,而球形活性炭在此波数无明显峰,说明大分子长链可能发生部分断裂;1 622、1 563和1 469 cm-1附近的峰为苯环的骨架振动峰,经历炭化和活化后基本消失,说明苯环基本裂解,形成碳骨架结构;1 203 cm-1处的峰为酚的C—O的伸缩振动峰,在炭化和活化后消失,这可能是酚羟基发生缩合反应使其数量减少导致的;884和799 cm-1附近的峰为取代苯环指纹区的特征峰,而球形活性炭在此波数吸收不明显,表明苯环上的取代基基本消失.因此,经过炭化和活化后形成的球形活性炭表面仍留有一定量的酚羟基和少量羧基.
2.3 扫描电镜分析
图3为球形活性炭的扫描电镜图,可以看到树脂经过炭化活化过程后,依然保持球状形貌,表面变粗糙,孔隙发达,孔道密布,较树脂发生明显变化.这些孔道的形成可能是由于炭化过程中小分子气体的逸出,以及活化过程中活化剂CO2对炭表面的刻蚀导致的.

图3 球形活性炭的扫描电镜图Fig.3 SEM photographs of SAC
2.4 比表面积和孔结构
从表1可以看出:122型离子交换树脂的比表面积和孔容都很小,仅为3.261 m2/g和0.003 cm3/g,但经过炭化和活化处理后,比表面积和孔容显著增大.这是因为在炭化过程中,树脂骨架收缩,微孔孔隙生成并被逐渐拓宽,同时CO2在活化过程中能够起到造孔和扩孔的作用,使得制备的球形活性炭具有较大的比表面积和丰富的孔结构.
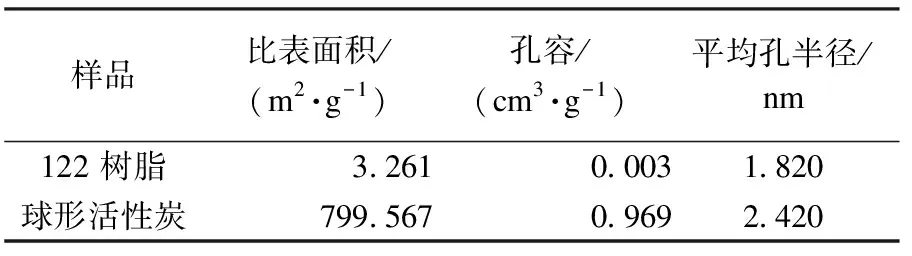
表1 122型离子交换树脂和球形活性炭的孔结构数据Table 1 Pore structural data of 122 resin and SAC
球形活性炭的孔径分布见图4.从图4可以看出球形活性炭的孔径分布主要集中在小于2 nm的微孔部分.Conchi O.Ania等[11]在不同孔径分布的活性炭吸附脱除二苯并噻吩性能的研究中,发现二苯并噻吩的吸附主要发生在与其分子尺寸相当的微孔中,而苯并噻吩的分子尺寸为0.692 nm[12],根据分子尺寸选择机理,苯并噻吩能够进入球形活性炭的微孔中并发生吸附.
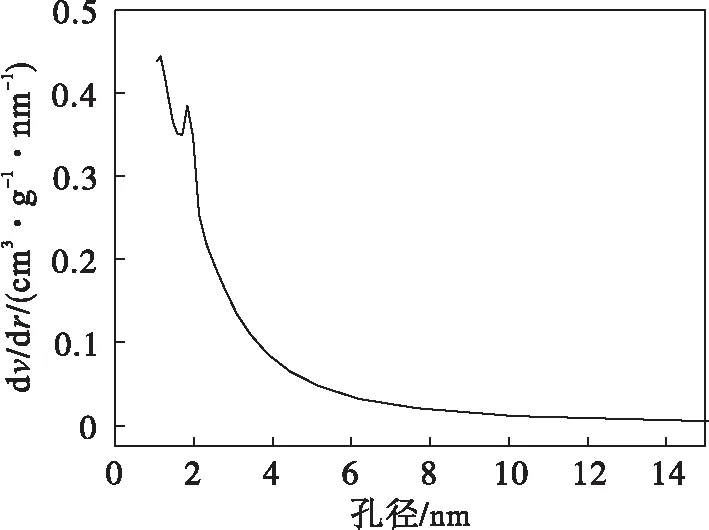
图4 球形活性炭的孔径分布Fig.4 Pore size distribution of SAC
2.5 吸附等温线
吸附等温线是评价吸附剂性能的重要参数,实验选用Frendlich和Langmuir吸附模型对吸附等温线的实验数据进行拟合,其表达式分别如公式(3)和公式(4)所示.
(3)
其中,qe为单位质量吸附剂的吸附硫的质量, mg/g;ρe为平衡时硫的质量浓度,mg/L;K和n为Frendlich常数:K,mg(1-1/n)/Ln·g;n为无量纲参数.
(4)
其中:K1和K2为Langmuir参数;K1:mg /g,K2:L /mg.
用Frendlich和Langmuir吸附模型拟合吸附平衡数据得到的吸附等温线及模型参数见图5及表2.其中,Langmuir吸附等温线主要基于以下假设:吸附为单分子层,吸附剂表面活性位分布是均匀的,被吸附的分子间相互不作用;Freundlich模型是基于吸附剂表面不均匀性的假定,吸附量与平衡浓度存在指数关系,常数n反映了吸附作用的强度.由表2可以看出,Frenudlich模型(R2=0.996 9)比Langmuir模型(R2=0.968 6)的拟合度更高,说明球形活性炭上的吸附活性位具有不均匀性.由球形活性炭的BET和红外分析可以看出,球形活性炭的孔径分布不均匀,同时表面存在羧基和酚羟基等不同的官能团,而活性炭对硫化物的吸附取决于孔结构和表面化学性质两个方面[13],因此,球形活性炭吸附苯并噻吩的活性位是不均匀分布的.

图5 球形活性炭对苯并噻吩吸附的吸附等温线Fig.5 Adsorption isotherms of benzothiophene on SAC 表2 吸附等温线参数 Table 2 Parameters of adsorption isotherms

吸附剂Freundlich 模型KnR2Langmuir 模型K1K2R2SAC0.634 52.080 10.996 912.508 80.009 00.968 6
2.6 吸附动力学
球形活性炭对苯并噻吩的吸附动力学曲线如图6所示.

图6 球形活性炭对苯并噻吩的吸附速率曲线Fig.6 Adsorption rate curve of benzothiophene on SAC
由图6可以看出:球形活性炭对苯并噻吩的吸附硫容随着时间增加而逐渐增大.在60 min之前吸附速率很大,这是由于吸附开始时,溶液中吸附质浓度较大,吸附推动力较大,故而吸附速率高.超过60 min之后,由于随着吸附的进行,吸附质浓度越来越小,吸附推动力减小,同时吸附活性位数量减少,吸附速率减小.在300 min时,吸附达到平衡,吸附硫容基本不变,达到10.3 mg/g.
为进一步探讨吸附的动力学,使用准一级(PFO)、准二级(PSO)、修正的准n级(MPnO)[14]和混阶(MOE)[15]速率方程对所得数据进行拟合,其表达式分别如式(5)~(8)所示.
qt=qe(1-e-k1t)
(5)
其中,qt、qe分别为时间t和平衡时吸附剂的吸附硫容, mg/g;k1为准一级速率常数,min-1.
(6)
其中,k2为准二级速率常数,g·mg-1·min-1.
qt=qe(1-e-nk′t)1/n
(7)

(8)
其中,F2(F2<1)为二阶方程占混合阶的比例.
4种动力学模型对实验数据的拟合曲线及模型参数见图7及表3.由表3可以看出:修正的准n级速率方程对实验数据的拟合度最高,为0.999 0,并且由该速率方程得到的qe与实验得到的qe值(10.3 mg/g)最为接近;准二级速率曲线和混阶速率曲线几乎重合,其拟合度较高,均为0.997 0,两者的qe值与实验值有一些偏差;准一级速率方程对实验数据的拟合度最低,拟合计算得到的qe与实验值相差很大.因此,修正的准n级速率方程最适合描述球形活性炭对苯并噻吩的吸附动力学过程.由于混阶和修正的
准n级速率方程均适用于异质性的表面吸附行为[16],拟合结果表明球形活性炭是作为异质性表面进行吸附的,这与吸附等温线得到的结果一致.

图7 球形活性炭对苯并噻吩吸附的动力学拟合曲线Fig.7 Adsorption kinetics fitting curves of benzothiophene on SAC 表3 动力学拟合参数 Table 3 Parameters of adsorption kinetic models

吸附剂PFOk1qeR2PSOk2qeR2SAC0.060 19.863 80.965 60.009 110.477 40.997 0吸附剂MPnOK'qenR2MOEK1qeF2R2SAC0.003 810.284 33.460 70.999 00.000 810.432 40.991 20.997 0
3 结 论
(1) 制备的球形活性炭有丰富的微孔结构,比表面和孔容分别达到799.567 m2/g和0.969 cm3/g,材料表面存在酚羟基和少量羧基.
(2) 在剂油比为1∶>30 g/mL时,球形活性炭对苯并噻吩的吸附硫容达到10.3 mg/g.
(3) 球形活性炭对苯并噻吩的吸附符合Freundlich吸附模型,表明球形活性炭的表面是异质性的,吸附活性位不均匀分布.
(4) 修正的准n级动力学模型最适宜描述球形活性炭对苯并噻吩的吸附过程,准二级和混阶速率方程的拟合度也较高.
参考文献:
[1] Song C S.An Overview of New Approaches to Deep Desulfurization for Ultraclean Gasoline,Diesel Fuel and Jet Fuel[J].Catalysis Today,2003,86(1/4):211-263.
[2] Velu S,Ma X L,Song C S.Selective Adsorption for Removing Sulfur from Jet Fuel over Zeolite-based Adsorbents[J].Ind.Eng.Chem.Res.,2003,42(21):5293-5304.
[3] WANG Qin,LIANG Xiaoyi,ZHANG Rui,et al.Preparation of Polystyrene-based Activated Carbon Spheres and Their Adsorption of Dibenzothiophene[J].New Carbon Material,2009,24(1):55-60.
[4] 宋丽娟,潘明雪,秦玉才,等.NiY 分子筛选择性吸附脱硫性能及作用机理[J].高等学校化学学报,2011,32(3):787-792.
[5] 唐克,洪新,宋丽娟,等.二次合成 Y 型杂原子分子筛的吸附脱硫研究[J].燃料化学学报,2012,40(4):507-512.
[6] Kim J H,Ma X L,Zhou A,et al.Ultra-deep Desulfurization and Denitrogenation of Diesel Fuel by Selective Adsorption over Three Different Adsorbents:A Study on Adsorptive Selectivity and Mechanism[J].Catalysis Today,2006,111(1/2):74-83.
[7] Wang Y H,Yang R T.Desulfurization of Liquid Fuels by Adsorption on Carbon-based Sorbents and Ultrasound-assisted Sorbent Regeneration[J].Langmuir,2007,23(7):3825-3831.
[8] Yenisoy-Karakas S,Aygeun A,Geunes M,et al.Physical and Chemical Characteristics of Polymer-based Spherical Activated Carbon and Its Ability to Adsorb Organics[J].Carbon,2004,42(3):477-484.
[9] 于维昭,郑经堂,何小超,等.负载金属球形活性炭的制备及其噻吩吸附性能[J].化工学报,2008,59(11):2824-2829.
[10] 蒋海云,王继刚,吴申庆.酚醛树脂的高温裂解色谱质谱分析[J].功能材料,2008,39(6):1024-1026.
[11] Ania Conchi O,Bandosz Teresa J.Importance of Structural and Chemical Heterogeneity of Activated Carbon Surfaces for Adsorption of Dibenzothiophene[J].Langmuir,2005,21(17):7752-7759.
[12] 肖静,雷筱娱,刘冰,等.苯并噻吩/二苯并噻吩在改性Y型分子筛上的吸附[J].功能材料,2008,39(8):1373-1376.
[13] Mykola Seredych,Jakub Lison,Urs Jans,et al.Textural and Chemical Factors Affecting Adsorption Capacity of Activated Carbon in Highly Efficient Desulfurization of Diesel Fuel[J].Carbon,2009,47(10):2491-2450.
[14] Azizian S,Fallah R N.A New Empirical Rate Equation for Adsorption Kinetics at Solid/Solution Interface[J].Applied Surface Science,2010,256(17):5153-5156.
[15] Marczewski A W.Application of Mixed Order Rate Equations to Adsorption of Methylene Blue on Mesoporous Carbons[J].Applied Surface Science,2010,256(11):5145-5152.
[16] Fallah R N,Azizia S.Removal of Thiophenic Compounds from Liquid Fuel by Different Modi?ed Activated Carbon Cloths[J].Fuel Processing Technology,2012,93(1):45-52.
