杏鲍菇多糖抗疲劳作用的研究
2014-03-25李鹏飞李志鹏于婷李雪崔承弼
李鹏飞, 李志鹏, 于婷, 李雪, 崔承弼*
( 1.延边大学基础医学院, 吉林 延吉 133002;2.延边大学长白山生物资源与健康产业协同创新中心, 吉林 延吉 133002 )
0 引言
杏鲍菇(Pleurotuseryngii)别名刺芹侧耳,为担子菌亚门(Basidiomycotina)担子菌纲(Basidio-mycetes)层菌亚纲(Hymenomycetes)无隔担子菌亚纲(Hom-obasidiomycetidae)伞菌目(Agaricales)侧耳科(Pleurotaceae)侧耳属(Pleurotus)食用菌,其菌肉因具有杏仁味和鲍鱼味而被称杏仁鲍鱼菇,简称杏鲍菇[1].杏鲍菇营养丰富,具有“平菇王”的美誉[2].资料[3-4]显示,其干品含蛋白质21.44%、游离氨基酸2.36%、甘露醇2.27%、灰分7.83%,其子实体和菌丝体的维生素C含量分别高达21.4 mg/100 g和13.9 mg/100 g;除此,杏鲍菇还含有丰富的钙、镁、铜、锌等矿物质.研究[5]表明,杏鲍菇具有润肠胃、降血脂、抗癌、美容、增强人体免疫力等作用,因此深受人们的喜爱.
杏鲍菇多糖(Pleurotuseryngiipolysaccharides,PEP)是一种从杏鲍菇子实体中提取出来的多糖,具有清除自由基、抗氧化、抗病毒、增强免疫力、抗肿瘤和抑菌等生理功能[6-9].Li Siqian等[10]研究表明,经过磺化作用后的杏鲍菇多糖的抗氧化性能显著提高,并且其抗菌作用也明显提高,其中对大肠杆菌ATCC 25922和金黄色葡萄球菌CMCC 26003的抑制效果最好.Alfred Mugambi Mariga等[11]从杏鲍菇中提取出了一种主要由精氨酸、丝氨酸和甘氨酸组成的分子量为63 kDa的新型蛋白质,它能够显著抑制A549、HepG2等癌细胞的增殖,并能促进巨噬细胞的增殖,具有一定的免疫增强作用.Chen Jingjing等[12]的研究显示,杏鲍菇多糖可以通过下调CD36基因的转录与蛋白的表达,抑制泡沫细胞中脂质的积累,从而降低血脂和预防动脉粥样硬化.Lin Jautien等[13]还研究了不同的杏鲍菇收获时间对其抗氧化与抗炎能力的影响,实验分别将子实体形成10,12,15 d的杏鲍菇采摘后进行成分的测定和抗氧化、抗炎能力的测定,结果显示子实体形成10 d时杏鲍菇的酚酸、黄酮、生育酚和胡萝卜素类物质含量最高,且其抗氧化与抗炎能力也最强.杨立红等[14]分离出了两种具有生物活性的杏鲍菇多糖单体,其研究成果在我国尚属首次.本文以杏鲍菇多糖为受试物,通过动物实验研究其抗疲劳作用.
1 材料与方法
1.1 实验动物及饲育条件
小鼠(24只)购于延边大学实验动物中心(健康雄性CL级KM种),小鼠4 w龄,体重为(20±2) g;购买后于延边大学食品研究中心动物室饲养,室温为(24±2) ℃,相对湿度为45%~65%,及时供给食物和饮水,使其适应1周后进行实验.
1.2 样品
新鲜杏鲍菇子实体购于吉林省图们市石岘镇延边深山源生物技术有限公司.
1.3 仪器设备
主要仪器有:HK-168正方形调节式中药切片机(广州市旭朗机械设备有限公司);YZN-50煎药机(北京东华原医疗设备有限责任公司);R202-2旋转蒸发仪(常州诺基仪器有限公司);SW-CJ-2FD双人单面净化工作台(苏州净化设备有限公司);HA2000-A电热油汀(慈溪市祥和电器有限公司);FJ全模终端独立送风净化笼具(苏州新区枫桥净化设备厂);HH-6数显恒温水浴锅(金坛市科析仪器有限公司);U-3900分光光度计(日立仪器有限公司);DY89-Ⅱ电动玻璃匀浆机(宁波新芝生物科技股份有限公司);8O-2高速离心机(上海手术器械厂);TG16A-WS离心机(上海卢湘仪器有限公司);FA2004分析天平(上海上平仪器有限公司).
1.4 试剂
主要试剂有生理盐水、95%乙醇溶液、5%三氯乙酸、硫酸(分析纯)、蒽酮(分析纯)、葡萄糖(分析纯)、硫脲(分析纯).蒽酮试剂用浓度为72%浓硫酸配制,其中加入蒽酮与硫脲的比例分别为0.05%和1%,配成后用锡箔纸包好存置冰箱中.
1.5 杏鲍茹多糖的制备
将称取的4 kg新鲜杏鲍菇预处理后用切片机切成薄片,置于真空浓缩煎药机中加入20倍体积浓度为70%的乙醇煎药3 h,将挤压出来的液体浓缩至2 000 mL后过滤;在滤液中加乙醇至70%醇沉[15],抽滤后使滤渣溶于1 000 mL蒸馏水中,用Sevag法去蛋白(氯仿与正丁醇4∶1,0.5倍体积),分层后取上层溶液加乙醇至70%;将滤出的沉淀低温烘干后研磨成粉末,用蒸馏水配制成浓度分别为22.22,11.11,5.556 mg/mL的溶液,即杏鲍菇多糖低、中、高剂量.
1.6 实验方法
1.6.1受试物剂量设计 将24只小鼠随机分为对照组、低浓度杏鲍菇多糖溶液组、中浓度杏鲍菇多糖溶液组、高浓度杏鲍菇多糖溶液组,每组6只.杨娟等[16]在研究香菇多糖的抗疲劳作用时将其3种剂量分别设定为10,20,50 mg/(kg·d).故以香菇多糖高剂量为杏鲍菇多糖低剂量,将3个剂量分别设定为50,100,200 mg/(kg·d),经口灌胃摄入药物,同时以相等体积蒸馏水作为空白组灌胃物.
1.6.2小鼠爬杆时间的测定 末次灌胃30 min后,对小鼠进行爬杆实验,记录其从放上爬杆架到滑落的时间间隔,爬杆时间为其3次累计时间[17].
1.6.3小鼠力竭性游泳时间的测定 在各组小鼠末次灌胃0.5 h后,将小鼠依次放置于游泳箱中,并将质量为小鼠体重5%的铅皮绑在小鼠尾部进行力竭性游泳实验[18].游泳箱规格为90 cm×45 cm×45 cm,水深约35 cm,水温为(25±1) ℃.小鼠的游泳时间为小鼠自游泳开始至力竭沉入水中死亡的时间[19].
1.6.4小鼠体重及脏器系数的测定 实验过程中每3 d测一次小鼠的体重,解剖后测定各实验剂量组小鼠的心脏、肝脏、肾脏、脾脏的湿重,并计算它们与单位体重(100 g)的比值[20].
1.6.5小鼠肝糖原和肌糖原储备量的测定
1) 葡萄糖标准曲线的绘制.采用蒽酮法绘制葡萄糖标准曲线.配制浓度分别为0,0.5,1.0,1.5,2.0,2.5 mg/mL的标准葡萄糖溶液各100 mL,然后分别依次取2 mL标准葡糖糖溶液和10 mL蒽酮试剂于试管中,沸水浴15 min,冷却后在620 nm波长下测定OD值.以标准葡萄糖溶液的浓度为横坐标,吸光度值为纵坐标,绘出标准曲线,如图1所示.回归方程为y=2.360x+0.097.
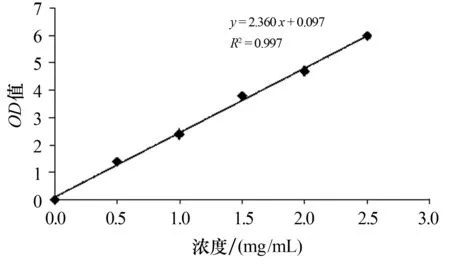
图1 葡萄糖标准曲线
2) 小鼠肝糖原和肌糖原含量的测定.小鼠力竭性游泳后立即解剖,将其后肢肌肉和肝脏取出后用生理盐水漂洗再用滤纸吸干;精确称量100 mg后肢肌肉和肝脏,取5%的三氯乙酸8 mL分别加入后肢肌肉和肝脏后研磨成匀浆,匀浆以3 000 r/min离心15 min.取1 mL上清液加入4 mL 95%的乙醇溶液,放置过夜使多糖完全沉淀析出,以3 000 r/min离心15 min;去上清液,控干10 min后,使糖原溶解于2 mL蒸馏水中.以同量蒸馏水为试剂空白.向各试管中分别加入10 mL蒽酮试剂,沸水浴15 min,在620 nm波长下测定吸光度[21].将各组试管的吸光度代入标准方程
肝/肌糖原含量(mg/100 g)=
其中OD为样品管吸光度,2为溶解糖原时用的蒸馏水体积(mL),V为提取液体积(mL),m为肝脏/肌肉组织的质量(g),0.9为葡萄糖和糖原转换系数.
1.6.6统计方法 实验所得数据用SPSS 16.0软件进行统计分析,P<0.05时认为有显著性差异.
2 结果与分析
2.1 杏鲍菇多糖对小鼠体重的影响
杏鲍菇多糖对各组小鼠体重的影响如表1所示.由表1可知,对KM种小鼠连续灌胃4 w期间,各实验剂量组小鼠的体重都显示出了逐步增长的趋势.用SPSS 16.0软件处理数据后再经多重比较发现,各时间段各组小鼠体重之间不存在显著性差异,这表明一段时间一定剂量杏鲍菇多糖的摄入未对小鼠的体重造成影响.
表1 杏鲍菇多糖对小鼠体重的影响
2.2 杏鲍菇多糖对小鼠脏器系数的影响
杏鲍菇多糖对各组小鼠脏器系数的影响如表2所示.用SPSS 16.0软件进行多重比较后发现,各组小鼠的脏器系数之间不存在显著性差异,这表明一段时间一定剂量杏鲍菇多糖的摄入未对小鼠的脏器系数造成影响,即说明杏鲍菇多糖在一段时间一定剂量下对小鼠脏器没有显著的损害.
表2 杏鲍菇多糖对小鼠脏器系数的影响 g/100 g
2.3 杏鲍菇多糖对小鼠爬杆时间的影响
杏鲍菇多糖对小鼠爬杆时间的影响如表3所示.由表3可知,杏鲍菇多糖3个剂量组的小鼠爬杆时间与空白组比较均显著增长,其中高剂量组与其他两组间均有显著性差异.这说明一定剂量的杏鲍菇多糖的摄入,能够延长小鼠的爬杆时间.
表3 杏鲍菇多糖对小鼠爬杆时间的影响
注:相同字母的为差异不显著,不同字母的为差异显著;表4—表6同.
2.4 杏鲍菇多糖对小鼠力竭性游泳时间的影响
杏鲍菇多糖对小鼠力竭性游泳时间的影响如表4所示.由表4可知,杏鲍菇多糖3个剂量组的小鼠力竭性游泳时间与空白组比较也呈显著增长,并且高剂量组的效果与其他两组相比较均有显著性差异.从实验结果可知,一定剂量的杏鲍菇多糖的摄入,能够显著延长小鼠的力竭性游泳时间.
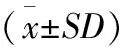
表4 杏鲍菇多糖对小鼠游泳时间的影响
2.5 杏鲍菇多糖对小鼠肝糖原储备量的影响
杏鲍菇多糖对小鼠肝糖原储备量的影响如表5所示.由表5可知,杏鲍菇多糖3个剂量组的小鼠肝糖原储备量与空白组相比显著增高,其中高剂量组效果与其他两组相比较均有显著差异,这说明杏鲍菇多糖的摄入能够使小鼠的肝糖原储备量显著增加.
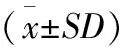
表5 杏鲍菇多糖对小鼠肝糖原储备量的影响
2.6 杏鲍菇多糖对小鼠肌糖原储备量的影响
杏鲍菇多糖对小鼠肌糖原储备量的影响如表6所示.由表6可知,杏鲍菇多糖3个剂量组的小鼠肌糖原储备量均显著高于空白组,并且高剂量组效果与其他两组相比较均有显著差异.这说明一定时间一定剂量的杏鲍菇多糖的摄入,能够提高小鼠的肌糖原储备量,为小鼠的运动供能提供一定程度上的保障.
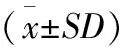
表6 杏鲍菇多糖对小鼠肌糖原储备量的影响
3 讨论
缓解体力疲劳的功能性食品评价方法包括运动耐力实验和生化指标测定.运动耐力实验包括游泳实验和爬杆实验,生化指标主要有血清尿素氮、肝糖原与肌糖原、血乳酸和乳酸脱氢酶活性等.一般认为,不少于一项运动耐力实验和不少于两项生化指标为阳性时,即可判定受试物具有抗疲劳活性[22].
爬杆时间和游泳时间的长短可以体现运动耐力的强弱.本实验中,低、中、高3剂量组小鼠的爬杆时间和游泳时间均显著长于空白对照组,其中以高剂量组效果最为明显,说明一段时间一定剂量杏鲍菇多糖的摄入增强了小鼠的运动耐力.
肌肉活动时,能量的主要来源是糖类,人体内的糖类主要有血糖、肝糖原、肌糖原3种.由于血糖在血液中可以直接转化为ATP,所以其为最直接的供能物质,长时间的剧烈运动,使得血糖水平降低,导致中枢神经系统供能不足,这可能是导致疲劳的重要原因之一[23].血糖水平降低后,其平衡依赖肝糖原和肌糖原分解生成的葡萄糖进入血液来维持.由于肌肉中缺乏葡萄糖磷酸酶,肌糖原分解生成的葡萄糖不能直接到达血管,只能先通过糖酵解生成丙酮酸,之后以丙氨酸的形式运输到肝脏糖异生为葡萄糖,再通过血液循环为肌组织供能[24].持续运动导致肝糖原和肌糖原持续大量消耗,而最终出现低血糖,使得机体不能维持运动的继续从而产生疲劳,因此肝糖原和肌糖原含量也是评价机体运动耐力的重要指标.
本实验对比了实验组和对照组小鼠力竭性游泳之后肝糖原和肌糖原的含量,结果发现,杏鲍菇多糖3个剂量组(低、中、高)小鼠的肝糖原和肌糖原含量与空白组相比显著增高,其中以高剂量组小鼠肝糖原和肌糖原增加最为显著,且表现出一定的剂量效应.这也是杏鲍菇多糖具有抗疲劳功能的原因之一.
参考文献:
[1] 李树锦,李海强,孙国娟,等.杏鲍菇多糖研究进展[J].现代农业科技,2012,(4):43-44.
[2] 郭金龙,邢丽萍,王玉芬,等.杏鲍菇菌丝体多糖提取条件的优化研究[J].食药用菌,2012,20(4):152-156.
[3] 王凤芳.杏鲍菇中营养成分的分析测定[J].食用菌学报,2002,11(5):143-146.
[4] 杨梅.杏鲍菇菌丝深层培养及氨基酸分析研究[J].食用菌,2000,27(5):81-84.
[5] 颜明娟,江和枝,蔡顺香.杏鲍菇营养成分的分析[J].云南师范大学学报,2002,35(3):22-23.
[6] 刘海英,张运峰,范永山,等.平菇、杏鲍菇和白灵菇菌丝多糖对·OH、DPPH·和NO2-的体外清除作用[J].中国农学通报,2010,37(28):37-41.
[7] 迟桂荣,徐琳,吴继卫,等.杏鲍菇多糖的抗病毒、抗肿瘤研究[J].食用菌,2006,34(2):67-69.
[8] 迟桂荣.杏鲍菇多糖对鸡群免疫功能调节的研究[J].莱阳农学院学报:自然科学版,2007,24(25):4559-4561.
[9] 张丽,彭小列,张建锋,等.杏鲍菇多糖的提取及其抑菌作用[J].贵州农业科学,2010,27(8):79-81.
[10] Li Siqian, Nagendra P Shah. Antioxidant and antibacterial activities of sulphated polysaccharides fromPleurotuseryngiiand Streptococcus thermophiles ASCC 1275[J]. Food Chemistry, 2014,165(15):262-270.
[11] Alfred Mugambi Mariga, Pei Fei, Yang Wenjian, et al. Immunopotentiation ofPleurotuseryngii(DC. ex Fr.) Quel[J]. Journal of Ethnopharmacology, 2014,153(3):604-614.
[12] Chen Jingjing, Yong Yangyang, Xia Xian, et al. The excreted polysaccharide ofPleurotuseryngiiinhibits the foam-cell formation via down-regulation of CD36[J]. Carbohydrate Polymers, 2014,112(4):16-23.
[13] Lin Jautien, Liu Chengwei, Chen Yichen, et al. Chemical composition, antioxidant and anti-inflammatory properties for ethanolic extracts fromPleurotuseryngiifruiting bodies harvested at different time[J]. LWT-Food Science and Technology, 2014,55(1):374-382.
[14] 杨立红,史亚丽,王晓洁,等.杏鲍菇多糖的分离纯化及生物活性的研究[J].食品科技,2005,12(6):29-32.
[15] 孟思,刘晓宇,李信辉,等.杏鲍菇水溶性多糖提取工艺研究[J].食品科学,2007,28(9):141-144.
[16] 杨娟,吴谋成,张声华,等.香菇蛋白多糖抗疲劳作用研究[J].食品科学,2001,12(4):362-365.
[17] 冯炜权.运动性疲劳和疲劳恢复过程研究的新进展[J].中国运医学志,1993,12(3):16-19.
[18] Matsumoto K, Ishihara K, Tanaka K, et al. An adjustable-current swimming pool for the evaluation of endurance capacity of mice[J]. Journal of Applied Physiology(Bethesda, Md.:1985), 1996,81:1843-1849.
[19] 王小雪,邱隽,宋宇,等.茶氨酸的抗疲劳作用研究[J].中国公共卫生,2002,18(3):315-317.
[20] 王继岚,吴晶,李振华.大豆异黄酮粉长期摄入对大鼠生理指标的影响[J].长春中医药大学学报,2007,23(6):13-14.
[21] 徐峰,赵江燕,刘天硕.刺五加提取物抗疲劳作用的研究[J].食品科学,2005,26(9):453-456.
[22] 毛根年,许牡丹.功能食品生理特性与检测技术[M].北京:化学工业出版社,2005:351-354.
[23] 刘景圣,孟宪军.功能性食品[M].北京:中国农业出版社,2005:234-238.
[24] 张丽萍,杨建雄.生物化学简明教程[M].北京:高等教育出版社,2009:252-258.
