M13噬菌体多克隆抗体的制备与鉴定
2014-03-23谭慧王冰冰卢徐涟侯柏龙林晓云刘巧琼张丽芳陈筱菲
谭慧,王冰冰,卢徐涟,侯柏龙,林晓云,刘巧琼,张丽芳,陈筱菲
(1.温州医科大学附属第一医院 检验科,浙江 温州 325015;2.温州医科大学 分子病毒与免疫研究所/微生物学与免疫学教研室, 浙江 温州 325035)
M13K07辅助噬菌体进行兔免疫制备了M13噬菌体多克隆抗体,为噬菌体展示技术研究提供检测抗体。
M13噬菌体多克隆抗体的制备与鉴定
谭慧1,王冰冰2,卢徐涟2,侯柏龙2,林晓云2,刘巧琼2,张丽芳2,陈筱菲1
(1.温州医科大学附属第一医院 检验科,浙江 温州 325015;2.温州医科大学 分子病毒与免疫研究所/微生物学与免疫学教研室, 浙江 温州 325035)
目的:制备M13K07辅助噬菌体多克隆抗体。方法:将M13K07辅助噬菌体进行大量扩增,以此作为免疫原于1、3、5周进行兔免疫,收集0周和免疫后2、4、6、8周免疫血清,用间接ELISA法对兔免疫血清的效价进行检测,进一步用免疫斑点实验检测兔多克隆抗体与M13K07辅助噬菌体的特异性结合能力。结果:M13K07辅助噬菌体免疫兔可产生高效价的多克隆抗体,效价达1:3 200,并能特异性识别M13K07辅助噬菌体。结论:成功制备了高效价的M13K07辅助噬菌体多克隆抗体,为噬菌体展示技术研究提供了检测抗体。
M13K07辅助噬菌体;多克隆抗体;免疫斑点实验;酶联免疫吸附试验;兔
噬菌体展示技术是将外源基因表达产物与噬菌体衣壳蛋白融合,使外源基因随外壳蛋白的表达而表达,同时将其遗传密码信息整合到噬菌体的基因组中,在此过程中,辅助噬菌体对噬菌粒的复制和
组装发挥着至关重要的作用,只有在辅助噬菌体的协助下,噬菌体才能完成单链DNA复制[1-2]。M13K07是M13噬菌体的一个突变体,为最常用的辅助噬菌体,带有一个质粒复制起始点、卡那霉素抗性基因以及G6125T的突变基因I I[3],其抗体被广泛应用于噬菌体展示技术中筛选结果的检测。尽管M13K07辅助噬菌体单克隆抗体已商品化,但单抗仅针对一个抗原表位且价格十分昂贵,因而有一定的应用局限性。侯晓红等[4]利用沙眼衣原体进行兔免疫成功制备了高效价的多克隆抗体。基于上述,本研究用
M13K07辅助噬菌体进行兔免疫制备了M13噬菌体多克隆抗体,为噬菌体展示技术研究提供检测抗体。
1 材料和方法
1.1 材料辅助噬菌体M13K07由温州医科大学分子病毒与免疫实验室购买保存;辣根过氧化物酶(HRP)标记山羊抗兔HRP-IgG购自中国杭州格朗瑞生物科技有限公司;新西兰大白兔由温州医科大学实验动物中心提供,体质量1.5 kg,雌性;弗氏佐剂购自美国Sigma公司;ECL发光剂购自中国北京天根生化科技有限公司。
1.2 方法
1.2.1 M13 K07辅助噬菌体扩增:将辅助噬菌体M13K07感染对数生长期的大肠杆菌TG1(E.coliTG1),于37 ℃,200 r/min摇床中振摇孵育30 min后,加入预热至50 ℃融化的顶层琼脂,混匀后立即转入37 ℃预热的2YT平板,铺匀,室温放置5 min,37 ℃培养过夜。将培养板上的单个噬菌斑接种到3~4 mL TG1的菌液中,37 ℃,200 r/min摇床中震荡孵育2 h,转至500 mL 2YT培养基,37 ℃,200 r/min继续培养1 h,加入50μg/mL卡那霉素继续振荡培养16 h,5 000 r/min,4 ℃离心15 min收集上清,经PEG/NaCl沉析1 h。于4 ℃,10 000 r/min离心15 min,弃上清,将沉淀溶于2YT缓冲液,经0.45μm膜过滤即为M13K07辅助噬菌体,4℃保存备用。
1.2.2 M13 K07辅助噬菌体滴度的测定:将M13K07辅助噬菌体作梯度稀释(101,102,103,…………1012),各取100μ L M13K07辅助噬菌体与500μL对数生长期的E.coliTG1混匀,加入含2YT顶层琼脂并平铺于预热的2YT培养平板,37 ℃,200 r/min摇床孵育20 min,室温放置5 min后,37 ℃培养过夜。计数平板上的空斑数,乘以稀释倍数,即为噬菌体的滴度。
1.2.3 兔抗M13K07辅助噬菌体免疫血清的制备:6只新西兰大白兔随机分为两组:3只为M13K07辅助噬菌体免疫组,将M13K07辅助噬菌体与等体积弗氏佐剂混匀,以1×1010/只背部皮下多点注射大白兔;另3只背部皮下多点注射等体积PBS,作为阴性对照组。分别于1、3、5周免疫,并于0、2、4、6、8周通过兔耳缘静脉取血,分离血清,-80 ℃保存备用。
1.2.4 免疫斑点实验检测M13K07辅助噬菌体多克隆抗体的特异性:取2 μL灭活的1×1010M13K07辅助噬菌体点于硝酸纤维素膜上,置于37 ℃温箱中30 min,用5%脱脂奶粉4 ℃封闭过夜,PBST洗涤,加入1:1 000稀释的第6周免疫兔血清,用PBST洗涤3次,加1:5 000稀释HRP-山羊抗兔IgG,37 ℃作用2 h,经吐温-20磷酸缓冲液(PBST)洗涤后加入ECL发光剂显色5 min,压片曝光。
1.2.5 间接ELISA法检测M13K07辅助噬菌体多克隆抗体的效价:灭活的1×1010/mL M13K07辅助噬菌体包被96孔酶标板,100μ L/孔,4 ℃过夜,5%脱脂奶粉37 ℃封闭1 h,分别加入1:100稀释的0、2、4、6、8周免疫血清,37 ℃作用1 h,经PBST洗涤,加1:6 000稀释的HRP-山羊抗兔IgG,37 ℃作用1.5 h,洗涤后加HRP-OPD显色液显色30 min后,加入终止液(2%稀硫酸)终止反应,测定波长450 nm吸收值。同时,将第6周的免疫兔血清进行倍比稀释(免疫血清分别以1:100、1:200、1:400、1:800、1:1 600、1:3 200、1:6 400和1:12 800的倍比稀释),用ELISA检测方法(步骤同上)进行滴度检测,以分析兔多克隆抗体的效价。
2 结果
2.1 M13 K07 辅助噬菌体的扩增及滴度鉴定结果辅助噬菌体M13K07扩增后,在平板上可观察到菌斑(透亮的斑点)(见图1A),通过计数平板上的菌斑数乘以稀释倍数,结果显示噬菌体的滴度为1.7× 1014。不加M13K07辅助噬菌体的细菌培养平板没有观察到菌斑(见图1B)。
图1 M13K07辅助噬菌体在2YT平板上的单克隆菌斑
2.2 免疫斑点杂交检测M13K07辅助噬菌体免疫兔血清抗体特异性结果第6周免疫兔血清以1:1 000稀释作为一抗与M13K07辅助噬菌体进行免疫斑点夹杂检测,结果显示免疫血清能特异识别M13K07辅助噬菌体,出现阳性反应斑点(见图2A),而免疫前血清则未出现阳性反应斑点(见图2B),同时商品化M13单抗作为阳性对照与M13K07辅助噬菌体进行了免疫斑点杂交实验,可见阳性反应斑点(见图2C)。
2.3 M13 K07 辅助噬菌体多克隆抗体反应及效价的测定用M13K07辅助噬菌体作为包被抗原,检测多克隆兔血清抗体的效价,其检测数据结果显示,M13K07辅助噬菌体免疫组兔于免疫后第2周开始产生特异性IgG,至第6周达到高峰(见图3A),多克隆抗体血清的效价可达1:3 200(见图3B)。

图2 免疫斑点实验检测M13K07辅助噬菌体免疫血清抗体的特异性结果
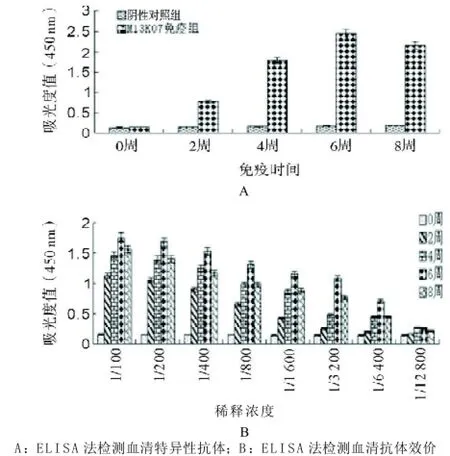
图3 M13K07辅助噬菌体多克隆血清抗体效价的ELISA检测结果
3 讨论
噬菌体展示技术自1985年由Smith[5]发明以来,由于其鲜明的技术优势并经不断发展与完善,目前已广泛应用于各个领域[6-10],如抗体工程、抗原表位研究、新药研发、疾病诊断、疫苗研究及肿瘤治疗等。该技术将外源多肽或蛋白质与噬菌体衣壳蛋白融合,并在其表面展示,再根据其配体的特异性亲和力,将所需的多肽或蛋白质筛选出来,其原理为肽库与固相上的靶蛋白分子经一定时间孵育后,游离噬菌体经洗涤除去,与靶分子结合吸附的噬菌体再以竞争受体或酸洗脱下,洗脱下的噬菌体用以感染宿主细胞并经繁殖扩增后,进行下一轮洗脱,经过3~5轮的“吸附-洗脱-扩增”后,与靶分子特异结合的噬菌体得到高度富集[11-12],使靶蛋白得以筛选。由于ELISA技术是较敏感和简单的筛选方法,且该方法相较于其他筛选检测方法更能直接的反映多肽亲和力和特异性[13],因此ELISA技术成为噬菌体展示筛选的最常用方法,而ELISA检测方法中,M13噬菌体抗体是必不可少的试剂,虽然目前市场不乏商品化的M13噬菌体单抗,但价格昂贵且仅针对一个抗原表位有其应用的局限性。
本研究用M13K07辅助噬菌体进行大量扩增,以此作为免疫原对新西兰大白兔进行免疫,成功制备了可特异性识别M13K07辅助噬菌体的较高效价的多克隆抗体。噬菌斑实验结果表明:噬菌斑的成功制备,使得M13K07辅助噬菌体的浓度和滴度得以准确计算,为后续实验奠定了基础。ELISA检测数据显示:M13K07辅助噬菌体具有较强的免疫原性,于免疫第2周开始产生特异性抗体,免疫第6周血清抗体滴度达到最高值,免疫第8周血清抗体滴度开始下降,免疫第6周血清效价可达1:3 200。通过免疫斑点实验证实了制备的兔多克隆抗体能与M13K07辅助噬菌体发生特异性结合,与商品化M13单抗结合M13K07辅助噬菌体特异性一致。本研究与先前任晓峰等[14]和胡巍等[15]报道的M13噬菌体多克隆抗体制备相比较,优势在于:用M13K07辅助噬菌体作为免疫原特异性更好,并用免疫斑点实验对多克隆抗体与M13K07辅助噬菌体的特异性结合力进行了鉴定,证实了该多克隆抗体能特异识别M13噬菌体。
本研究成功制备了M13噬菌体多克隆抗体,为噬菌体展示技术研究提供了检测抗体。利用免疫兔制备的多克隆抗体,具有制备简单快速、来源方便、物美价廉等优点,在噬菌体展示技术靶抗原的筛选和研究应用方面具有较为广泛的应用前景。
[1]杜东霞, 张冉. 辅助噬菌体在噬菌体展示中的应用及研究进展[J]. 微生物学通报, 2009, 36(2): 261-266.
[2]Soltes G, Hust M, Bansal A, et al. On the influence of vector design on antibody phage display[J]. Biotchnol, 2007, 127 (4): 626-637.
[3]Vieira J, Messing J. Production of single-stranded plasmid DNA[J]. Methods Enzymol, 1987, 15(3): 3-11.
[4]侯晓红, 朱珊丽, 王乐丹. E血清型沙眼衣原体抗体的制备及检测[J]. 温州医学院学报, 2007, 37(4): 344-346.
[5]Smith GP. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface[J]. Science, 1985, 228(4705): 1315-1317.
[6]Hayden MS, Gilliland LK, Ledbetter JA. Antibody engineering[J].Curropin Immunol, 1997(9): 201-212.
[7]Les ski GB, West rink J. Novel vaccine strategies to T-independent antigens[J]. J Microbiol Methods, 2001, 47(2): 135-149
[8]Kay BK, Kura kin AV. From peptides to drugs via phage display[J]. Drug DiscovToday, 1998(3): 370-378.
[9]Ren X, Wang M, Yin J. Phages harboring specific peptides that recognize the N protein of the porcine reproductive and respiratory syndrome virus distinguish the virus from other viruses[J]. Clin Microbiol, 2010, 48(5): 1875-1881.
[10]Pini A,Bracci L. Phage display of antibody fragments[J]. Science, 2000, 1(2): 155-169.
[11]唐丽, 田海波, 李广兴, 等. 噬菌体展示技术原理及其在生物学研究中的应用[J]. 黑龙江畜牧兽医, 2009, 8(1): 23-24.
[12]Ren X, Liu B, Yin J, Li G. Phage displayed peptide recognizing porcine amino peptidase N inhibit transmissible enteritis corona virus infection in vitro[J]. Virology, 2011, 410 (2): 299-306.
[13]石娜, 李广兴, 任晓峰, 等. 猪IL-15与PRRS病毒GP5基因核酸疫苗免疫效力[J]. 东北农业大学学报, 2010, 41(1): 97-102.
[14]任晓峰, 马晓微. M13噬菌体肽库扩增及兔抗血清制备[J]. 东北农业大学学报, 2013, 44(3): 79-82.
[15]胡巍, 刘文, 宋晓国. 兔抗M13噬菌体酶标抗体的制备[J]. 淄博学院学报, 2002, 4(4): 9-11.
(本文编辑:吴健敏)
Preparation and identification of polyclonal antibodies against M13 phage
TAN Hui1, WANG Bingbing2,LU Xulian2, HOU Bolong2, LIN Xiaoyun2, LIU Qiaoqiong2, ZHANG Lifang2, CHEN Xiaofei1.1.Department of Clinical Laboratory, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2. Department of Microboilogy Immunology/Institute of Molecular Virology and Immunology, Wenzhou Medical University, Wenzhou, 325035
Objective:To prepare and characterize rabbit-anti M13K07 helper phage polyclonal antibodies.Methods:The helper phage was amplified and used to immunize rabbits to obtain polyclonal antibodies. Begin from the first week, the same immunization schedule of subcutaneous multipoint injection was repeated three times at 2 weeks intervals. Begin from 0 week, take blood serum collection from ear vein every other week. The immunogenicity of the M13K07 helper phage was detected with Dot Immunobinding Assay and indirect ELISA was used to demonstrate the titer of antiserum in the immunized rabbit.Results:It showed that the specific rabbit antibody against M13K07 helper phage could combined with M13K07 with Dot Immunobinding Assay. Indirect ELISA analysis showed that the helper page can stimulate high levels specific IgG antibody. Along with the increase of immunization times, antibody levels keep rising, reached the peak at the 6th week. The titer of the polyclonal antibody was approximately1:3 200. Conclusion: In this study, polyclonal antibodies against this M13K07 helper phage is successfully generated and such helper phage polyclonal antibodies is important reagent for functional analysis for phage.
M13K07 helper phage; polyclonal antibodies; dot immunobinding assay; ELISA; rabbit
R373.9
A
1000-2138(2014)04-0245-04
2013-10-23
国家自然科学基金资助项目(81172463)。
谭慧(1986-),女,湖北利川人,硕士生。
陈筱菲,教授,硕士生导师,Email:13706692998@ 163.com。
