miR-195在乳腺癌患者血浆中的表达及其临床意义
2014-03-23许践刚林峰张宪波胡芝王昭君赵挺沈洁
许践刚,林峰,张宪波,胡芝,王昭君,赵挺,沈洁
(1.温州市中心医院 肿瘤外科,浙江 温州 325000;2.台州市第一人民医院 普外科,浙江 台州 318020;3.温州市中心医院 妇瘤科,浙江 温州 325000)
·论 著·
miR-195在乳腺癌患者血浆中的表达及其临床意义
许践刚1,林峰2,张宪波1,胡芝3,王昭君1,赵挺1,沈洁2
(1.温州市中心医院 肿瘤外科,浙江 温州 325000;2.台州市第一人民医院 普外科,浙江 台州 318020;3.温州市中心医院 妇瘤科,浙江 温州 325000)
目的:探讨miR-195在乳腺浸润性导管癌患者术前、术后2周血浆中的表达及其与乳腺癌临床病理特征的相关性。方法:以miR-16为内参,采用茎环RT-qPCR方法检测48例术前、术后2周乳腺浸润性导管癌患者及35例健康对照者血浆中miR-195的表达,并分析其表达与乳腺浸润性导管癌临床病理指标的关系。结果:乳腺浸润性导管癌患者血浆中miR-195的表达较健康对照者明显升高(P<0.05),术后2周表达明显降低至健康对照者水平。ROC曲线显示,血浆miR-195评价乳腺浸润性导管癌的敏感性和特异性可达94.4%和68.8%。与临床特征相关性分析统计未见血浆miR-195表达与乳腺浸润性导管癌肿块大小、雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体-2(Her-2)状态及淋巴结转移状态等临床病理特征有明显相关(P>0.05)。结论:血浆中miR-195的异常表达可作为乳腺癌诊断的新的肿瘤标志物。
微RNAs;miR-195;乳腺肿瘤
近年来新发现的一类内源性微RNA,即microRNA(miRNA),长度只有22 nt左右,不编码任何蛋白质,但能够高效调控癌基因或抑癌基因的表达而在肿瘤的发生发展中起着关键的调控作用,是目前肿瘤研究领域的热点。除外细胞内表达,在血清、眼泪、母乳、支气管灌洗液、脑脊液、羊水等体液均可检测到miRNA[1]。有研究发现,这些细胞外miRNA可通过exosome转运至受体细胞发挥调控效应[2-5],因此被认为是非常理想的肿瘤早期诊断和筛查、治疗效果判断、预后评价的手段。最近有报道称miR-195的失调表达不但与肾上腺皮质肿瘤[6]、结肠癌[7]、肝癌[8]、胃癌[9]等相关,而且与乳腺癌[10-11]相关。但血浆miR-195表达与乳腺癌的关系鲜有研究。为此,本研究通过茎环RT-qPCR方法比较乳腺浸润性导管癌患者及健康对照者血浆标本中miR-195的表达,并分析其术后2周时表达的变化及其与乳腺浸润性导管癌临床病理特征的关系。
1 资料和方法
1.1 一般资料48例乳腺浸润性导管癌术前及术后2周血浆标本采自2011年1月至2012年11月间温州市中心医院肿瘤外科及台州市第一人民医院普外科住院患者。所有患者均为女性,年龄31~78岁,平均(52.2±11.5)岁。所有患者均经病理确诊,乳腺浸润性导管癌组织病理的诊断标准参照WHO乳腺肿瘤的病理学分类。雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体-2(Her-2)的免疫组化判断参照美国临床肿瘤学会(ASCO)与美国病理家学会(CAP)的检测指南。
1.2 材料Tri-Reagent BD试剂购自Sigma公司;ReverTra Ace反转录试剂盒、SYBR Mastermix等试剂购自Toyobo公司;DEPC水购自宝生物工程(大连)有限公司;引物由上海英骏生物技术有限公司合成。
1.3 方法
1.3.1 血浆收集:取枸橼酸钠抗凝的外周静脉血5 mL,3 000 r/min、离心10 min,取血浆,进一步12 000 r/min、离心10 min后,将血浆置-80 ℃冰箱保存备用。同时收集同时期年龄匹配的、无肿瘤病史的健康对照者35例,同样方法收集血浆备用。
1.3.2 血浆RNA提取:取血浆标本200 μL,加入1 μL 5 mg/mL糖原、20 μL 5 mol/L的冰醋酸及750μL的TRI Regent BD,充分混匀,按试剂说明书步骤抽提RNA。RNA沉淀经80%乙醇洗涤后,加入DEPC处理水20μL,-80 ℃保存。
1.3.3 miR-195表达检测:根据Wu等[9]报道的miRNA检测的茎环RT-qPCR方法,以miR-16作为内参,分析miR-195表达。相关分析的引物序列如表1所示。取5μL提取的RNA分别以miR-195及miR-16茎环RT引物进行反转录。反应条件为:16 ℃ 30 min,42 ℃ 30 min,75 ℃ 15 min,反应结束后-20 ℃保存。以15μL反应体系进行Real-time定量PCR。miRNA检测反应体系包括:1 μL RT产物,1×SYBR Green I Mastermix,0.5μmol/L miRNA特异前向引物、0.5μmol/L通用的反向引物。Realtime定量PCR条件为:95 ℃ 10 min后,95 ℃ 15 s,60 ℃ 1 min,40个循环。Real-time定量PCR技术使用Applied Biosystems 7500仪器进行。所有样品做3复孔。根据待测标本的Ct值,以miR-16作为内参照,采用定量PCR中的相对定量法,以N=2-△Ct表示标本中miR-195相对表达量,其中△Ct=CtmiR-195-CtmiR-16。以N=2-△△Ct表示手术后2周血浆miR-195表达相对于术前血浆标本的变化倍数,其中△△Ct=(CtmiR-195-CtmiR-16)术后-(CtmiR-195-CtmiR-16)术前。

表1 引物序列
1.4 统计学处理方法采用SPSS 17.0统计软件进行统计分析。miR-195表达数据以中位数和四分位数间距表示。配对样本间比较采用Wilcoxon符号秩检验,两组独立样本间比较采用Mann-Whitney U检验,ROC曲线分析敏感性和特异性。P<0.05为差异有统计学意义。
2 结果
2.1 血浆miR-16及miR-195检测特异性分析如图1显示,miR-16及miR-195的RT-PCR产物的熔解曲线为单峰,说明茎环RT-qPCR可以特异检测miR-16及miR-195。
2.2 miR-195在乳腺浸润性导管癌患者术前、术后2周及健康对照者血浆中的表达乳腺浸润性导管癌患者术前、术后2周及健康对照者血浆中miR-195表达结果如图2所示,提示乳腺浸润性导管癌患者术前血浆miR-195表达明显高于健康对照者(P<0.001),术后2周明显降低(P<0.001)。术后2周与健康对照者相比差异无统计学意义(P>0.05),其相对表达值分别为:5.12、2.20及2.66。

图1 miR-195及miR-16茎环RT-qPCR熔解曲线

图2 乳腺癌患者术前、术后2周及健康对照者血浆中miR-195表达水平
2.3 血浆miR-195作为乳腺癌患者筛选指标的评价
基于上述结果,我们进一步采用ROC曲线分析血浆miR-195表达筛选乳腺浸润性导管癌的特异性和敏感性。如图3所示,比较乳腺浸润性导管癌患者及健康对照者血浆miR-195表达的ROC曲线下面积(area under curve,AUC)为0.884(95% CI=0.815~0.952,P<0.001),提示血浆miR-195可作为乳腺浸润性导管癌的筛选指标。以血浆miR-195相对表达量4.26作为评价临界值判断乳腺浸润性导管癌的敏感性和特异性分别为94.4%和68.8%。
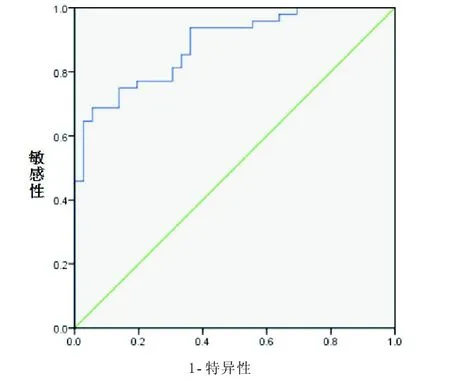
图3 ROC曲线分析乳腺浸润性导管癌患者血浆miR-195的表达
2.4 血浆miR-195表达与乳腺浸润性导管癌临床病理特征的关系进一步分析血浆中表达上调的miR-195的相对表达量和肿瘤大小,ER、PR、Her-2状态及淋巴结转移状态等乳腺浸润性导管癌的临床病理特征的相关性,结果显示,血浆miR-195的表达水平与这些临床病理特征无明显相关(P>0.05)。见表2。

表2 血浆miR-195表达和乳腺癌临床病理因素的相关性分析
3 讨论
越来越多的研究表明,miRNA在肿瘤发生发展中发挥重要作用。乳腺癌的发生发展也是一个多基因改变的过程,同样接受miRNA的调控作用。而肿瘤标志物是由肿瘤组织和细胞产生的与肿瘤形成、发生相关的物质,一种良好的肿瘤标志物对肿瘤的早期发现,判断疗效及预后等方面均有重要的意义。来自血液中的肿瘤标志物因其无创、高效尤其适用于临床。近年来已发现许多与来自于肿瘤细胞本身的与乳腺癌TMN分期、血管侵犯、增殖指数、ER和/或PR状态等预后因子相关的miRNA[12-13],最近还发现miRNA可稳定存在于血清和血浆中[1]。为此,使用循环miRNA作为潜在的早期肿瘤筛选标记引起了人们的极大的兴趣。最近的一些病例对照研究[14-17]发现了一些乳腺癌血液特征的miRNA。
miR-195属于miR-15家族成员,基因位于17p13.1区域,与miR-497成簇分布。已经发现肿瘤组织miR-195表达失调与多种肿瘤关系密切。最近基于全血miRNA研究证明,乳腺癌患者全血系统的miR-195表达明显高于健康对照者[18],而且与前列腺癌、肾癌、结肠癌等比较,全血系统miR-195是乳腺癌具有相对特征性的miRNA[19]。但血浆miR-195的表达与乳腺癌临床特征关系少有研究报道。
为分析miR-195在乳腺癌患者血浆中的表达及其临床意义,本研究以miR-16为内参,应用茎环RT-qPCR技术检测乳腺浸润性导管癌患者术前、术后2周及健康对照者血浆中miR-195表达。与全血检测结果类似,本研究乳腺浸润性导管癌患者血浆miR-195表达明显高于健康对照者。而且我们还发现,乳腺浸润性导管癌患者术后2周血浆miR-195降低到健康对照者的水平。ROC曲线显示血浆中miR-195的异常表达有较好的乳腺癌诊断价值,其敏感性和特异性可达94.4%和68.8%。但与临床病理特征相关性分析统计未见血浆miR-195表达与乳腺浸润性导管癌肿瘤大小、ER、PR、Her-2状态及淋巴结转移状态等乳腺癌的临床病理因素有明显相关。
研究已证实,游离的miRNA容易被RNA酶降解,血浆中的miRNA主要通过外分泌泡(exosome)、Ago2蛋白、高密度脂蛋白等不同载体运输[20],但循环miRNA的起源迄今尚未完全阐明,曾经被认为来源于循环肿瘤细胞[21]、血液中血细胞[22]或疾病部位组织细胞[23]等。研究已经表明miR-195在乳腺癌组织中低表达[10],而全血[18]及本研究的血浆中miR-195的检测结果是明显上调,提示乳腺癌患者血浆miR-195可能不是起源于肿瘤组织,其来源有待于进一步研究确定,但这并不影响其作为一种乳腺浸润性导管癌血液学肿瘤标志物的良好潜质。
[1]Weber JA, Baxter DH, Zhang S, et al. The microRNA spectrum in 12 body fluids[J]. Clin Chem, 2010, 56(11): 1733-1741.
[2]Iguchi H, Kosaka N, Ochiya T. Secretory microRNAs as a versatile communication tool[J]. Commun Integr Biol, 2010, 3(5): 478-481.
[3]Iguchi H, Kosaka N, Ochiya T. Versatile applications of microRNA in anti-cancer drug discovery: from therapeutics to biomarkers[J]. Curr Drug Discov Technol, 2010, 7(2): 95-105.
[4]Kosaka N, Iguchi H, Yoshioka Y, et al. Competitive interactions of cancer cells and normal cells via secretory microRNAs[J]. J Biol Chem, 2012, 287(2): 1397-1405.
[5]Kosaka N, Iguchi H, Yoshioka Y, et al. Secretory mechanisms and intercellular transfer of microRNAs in living cells [J]. J Biol Chem, 2010, 285(23): 17442-17452.
[6]Soon PS, Tacon LJ, Gill AJ, et al. miR-195 and miR-483-5p Identified as Predictors of Poor Prognosis in Adrenocortical Cancer[J]. Clin Cancer Res, 2009, 15(24): 7684-7692.
[7]Liu L, Chen L, Xu Y, et al. microRNA-195 promotes apoptosis and suppresses tumorigenicity of human colorectal cancer cells[J]. Biochem Biophys Res Commun, 2010, 400 (2): 236-240.
[8]Yang X, Yu J, Yin J, et al. MiR-195 regulates cell apoptosis of human hepatocellular carcinoma cells by targeting LATS2 [J]. Pharmazie, 2012, 67(7): 645-651.
[9]Wu WY, Xue XY, Chen ZJ, et al. Potentially predictive microRNAs of gastric cancer with metastasis to lymph node [J]. World J Gastroenterol, 2011, 17(31): 3645-3651.
[10]Li D, Zhao Y, Liu C, et al. Analysis of MiR-195 and MiR-497 expression, regulation and role in breast cancer[J]. Clin Cancer Res, 2011, 17(7): 1722-1730.
[11]Yang G, Wu D, Zhu J, et al. Upregulation of miR-195 increases the sensitivity of breast cancer cells to Adriamycin treatment through inhibition of Raf-1[J]. Oncol Rep, 2013, 30(2): 877-889.
[12]Iorio MV, Ferracin M, Liu CG, et al. MicroRNA gene expression deregulation in human breast cancer[J]. Cancer Res, 2005, 65(16): 7065-7070.
[13]Mattie MD, Benz CC, Bowers J, et al. Optimized highthroughput microRNA expression profiling provides novel biomarker assessment of clinical prostate and breast cancer biopsies[J]. Mol Cancer, 2006, 5(1): 24.
[14]Asaga S, Kuo C, Nguyen T, et al. Direct serum assay for microRNA-21 concentrations in early and advanced breast cancer[J]. Clin Chem, 2011, 57(1): 84-91.
[15]van Schooneveld E, Wouters MC, Van der Auwera I, et al. Expression profiling of cancerous and normal breast tissues identifies microRNAs that are differentially expressed in serum from patients with (metastatic) breast cancer and healthy volunteers[J]. Breast Cancer Res, 2012, 14(1): R34.
[16]Wu Q, Wang C, Lu Z, et al. Analysis of serum genome-wide microRNAs for breast cancer detection[J]. Clin Chim Acta, 2012, 413(13-14): 1058-1065.
[17] 黄关立, 薛向阳, 曾瑞超, 等. 乳腺癌患者血浆中相关microRNA的表达及其临床意义[J]. 温州医学院学报, 2013, 43(5): 286-290.
[18]Heneghan HM, Miller N, Lowery AJ, et al. Circulating microRNAs as novel minimally invasive biomarkers for breast cancer[J]. Ann Surg, 2010, 251(3): 499-505.
[19]Heneghan HM, Miller N, Kelly R, et al. Systemic miRNA-195 differentiates breast cancer from other malignancies and is a potential biomarker for detecting noninvasive and early stage disease[J]. Oncologist, 2010, 15(7): 673-682.
[20]Vickers KC, Remaley AT. Lipid-based carriers of microRNAsand intercellular communication[J]. Curr Opin Lipidol, 2012, 23(2): 91-97.
[21]Zhao H, Shen J, Medico L, et al. A pilot study of circulating miRNAs as potential biomarkers of early stage breast cancer[J]. PLoS One, 2010, 5(10): e13735.
[22]Chin LJ, Slack FJ. A truth serum for cancer-microRNAs have major potential as cancer biomarkers[J]. Cell Res, 2008, 18(10): 983-984.
[23]Chen X, Ba Y, Ma L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18(10): 997-1006.
(本文编辑:胡苗苗)
Expression of miR-195 in plasma of patients with breast cancer and its clinical significance
XU Jiangang1,
LIN Feng, ZHANG Xianbo, HU Zhi, WANG Zhaojun, ZHAO Ting, SHEN Jie.1.Department of Oncological Surgery , Wenzhou Central Hospital, Wenzhou, 325000; 2.Department of General Surgery, Taizhou First People’s Hospital, Taizhou, 318020; 3.Department of Gynecologic Oncology, Wenzhou Central Hospital, Wenzhou, 325000
Objective: To explore the expression of miR-195 in plasma of patients with breast cancer in preoperative and postoperative and two weeks and it correlation with clinicopathologic features of breast cancer.Methods:By normalized to miR-16, the expressions of miR-195 in 48 invasive ductal carcinoma of the breast cancer at preoperative and postoperative 2 weeks and 35 healthy controls were examined by stem-loop real-time RT-qPCR method. The relationship between miR-195 expression and clinicopathological characteristics were further analyzed.Results:Expression of miR-195 in plasma of patients with breast cancer was obviously higher than that in the healthy controls (P<0.05). At 2 weeks postopratively, a significant decrease of plasma miR-195 was observed, reaching levels of the healthy control subjects. ROC curve showed plasma levels of miR-195 could detect individuals with breast cancer with 94.4% sensitivity and 68.8% specificity. Correlative analysis of clinical features showed that there was no significant association between plasma miR-195 expression and the size of tumor, the state of ER, PR, lymph node metastasis and Her-2 receptor of breast cancer.Conclusion:Aberrant expression of miR-195 in plasma of breast cancer patients has potential use as novel noninvasive biomarkers for breast cancer. Key words:microRNA; miR-195; breast tumor
R730
A
1000-2138(2014)02-0105-05213112
2013-09-15
温州市科技计划项目(Y20110119)。
许践刚(1973-),男,浙江泰顺人,副主任医师,医学硕士。
沈洁,主任医师,Email:Linfeng0316@aliyun. com。
