绿原酸对紫外线损伤的HaCaT细胞肿瘤坏死因子α和白细胞介素6表达的调节
2014-03-23王业秋陈巧云李建民
王业秋,陈巧云,李建民,张 宁
(黑龙江中医药大学佳木斯学院,黑龙江佳木斯 154007)
绿原酸对紫外线损伤的HaCaT细胞肿瘤坏死因子α和白细胞介素6表达的调节
王业秋,陈巧云,李建民,张 宁
(黑龙江中医药大学佳木斯学院,黑龙江佳木斯 154007)
目的研究绿原酸对紫外线(UVB)损伤HaCaT细胞的保护作用及其机制。方法取对数生长期的HaCaT细胞,用总剂量64 m J·cm-2(照射强度0.61 mW·cm-2×照射时间105 s)的UVB照射细胞建立光损伤模型,以0.1,1和10μmol·L-1的绿原酸处理光损伤细胞24 h,用试剂盒分别检测细胞中超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-Px)活性和丙二醛(MDA)含量,RT-PCR法检测细胞中P38、肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)m RNA的表达,ELISA检测细胞上清液中TNF-α和IL-6的含量。结果与正常对照组相比,模型组SOD活性、GSH-Px活性和CAT活性明显降低,MDA含量、P38 mRNA表达、TNF-α和IL-6 mRNA及蛋白表达明显升高(P<0.01)。与模型对照组相比,绿原酸1和10μmol·L-1能明显提高细胞中SOD,GSH-Px和CAT活性,降低MDA含量(P<0.05),降低细胞中P38,TNF-α和IL-6 m RNA的表达(P<0.05),降低上清液中TNF-α和IL-6的含量(P<0.05)。结论绿原酸能抵抗UVB对HaCaT细胞的损伤,其机制可能与抑制氧化损伤、调控P38信号通路和调节TNF-α和IL-6表达有关。
绿原酸;紫外线;细胞,HaCaT;光损伤
DO l:10.3867/j.issn.1000-3002.2014.01.010
随着环境污染不断加剧,臭氧层破坏程度日益严重,使辐射到地球表面的紫外线(ultraviolet,UV)显著增多,皮肤紫外损伤现象越来越严重,严重影响着人们的身心健康。波长短能量较高的UVB(290~320 nm)主要作用于表皮,角质形成细胞是其靶细胞,UVB可以使角质形成细胞产生大量活性氧簇(reactive oxygen species,ROS),诱发氧化反应,引起一系列的氧化性损伤[1-2],另外角质形成细胞在UVB辐射后可释放多种介导炎症反应、调节免疫应答和诱导细胞凋亡等生物学作用的细胞因子,这些细胞因子以负反馈形式作用于细胞,进一步加剧皮肤细胞的损伤[3-5]。人们通过各种物理或化学方法预防和治疗皮肤光损伤,不能达到理想的效果,且具有一定的副作用,远远不能满足临床的需要,中医药以其毒性作用小等独特的优势,在抗皮肤光损伤方面得到较为广泛的研究。
杜仲(Cortex Eucommiae)为杜仲科植物杜仲(Eucommia ulmoides Oliv.)干燥茎皮,是名贵滋补药材,补中益精气,强筋骨,强志,安胎,有久服轻身耐老之功效。杜仲中主要含有木脂素类、环烯醚萜类和黄酮类等有机化合物[6],其中所含的绿原酸(chlorogenic acid,CGA)是一种重要的天然抗氧化剂,其抗氧化能力强于咖啡酸、对羟苯酸、阿魏酸、丁香酸、丁羟茴醚(丁基羟基茴香醚,batylated hydroxyanisole)和生育酚,可有效清除1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟基自由基和超氧阴离子自由基[7-8]。但关于CGA对光损伤细胞的保护作用机制未见相关报道。本研究通过观察CGA对UVB损伤HaCaT细胞抗氧化系统、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6)及上游通路中关键因子表达的影响,综合阐明CGA抗光损伤的作用机制,为CGA及杜仲的进一步开发和应用提供理论依据。
1 材料与方法
1.1 主要试剂和仪器
人皮肤角质形成细胞HaCaT(武汉大学细胞中心),MEM培养基、胎牛血清、胰蛋白酶和双抗〔赛默飞世尔科技(中国)有限公司〕,超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)和丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程公司),Trizo l(美国Invitrogen公司),第一链cDNA合成试剂盒、PCR扩增试剂盒、目的基因及内参引物和琼脂糖〔生工生物工程(上海)有限公司〕,IL-6和TNF-α ELISA试剂盒(上海研吉生物科技有限公司),CGA(纯度>98%,上海锐谷生物科技有限公司)。
紫外照射仪(美国Sigma公司),紫外线辐照计(北京师范大学光电仪器厂),Research UV UF型超纯水制备系统(上海和泰仪器有限公司),IX-71-21PH型O lym pus倒置显微镜(日本O lym pus株式会社),HF90型二氧化碳培养箱(上海智城分析仪器有限公司),MS-500A半自动生化分析仪(美生科技有限公司),MK3酶标仪(美国热电公司),TGL-16G-C型高速冷冻离心机(上海安亭科学仪器厂),Tprofessiona l型PCR扩增仪(德国Biom etra公司),DYY-10C型电泳仪(北京市六一仪器厂),Cham pGe l5000型凝胶成像系统(北京赛智创业有限公司)。
1.2 HaCaT细胞的体外培养及分组处理
HaCaT细胞在含有10%胎牛血清的MEM,37℃,5%CO2和饱和湿度条件下培养。取对数生长期的细胞随机分为①空白对照组:不加任何处理因素,换同体积的新鲜MEM培养;②模型对照组:用强度为0.61 mW·cm-2的UVB照射105 s(照射剂量为64 m J·cm-2),换同体积新鲜MEM培养;③CGA 0.1,1和10μmol·L-1剂量组(预实验确定CGA浓度>10μm o l·L-1时对HaCaT细胞产生毒性):用强度为0.61 mW·cm-2的UVB照射105 s,MEM中加入终浓度为0.1,1和10μm o l·L-1的CGA培养。
1.3 检测细胞中SOD,GSH-Px和CAT活性及MDA含量
给药24 h后,收集6孔板中各组细胞,用冷PBS清洗2次,超声破碎,严格按照试剂盒说明书操作,检测SOD,GSH-Px和CAT活性及MDA含量。
1.4 RT-PCR法检测细胞中P38,TNF-α和lL-6 m RNA表达
给药24 h后,使用Trizol分别提取6孔板中各组每孔细胞的总RNA;以RNA为模板按照第一链cDNA合成试剂盒操作说明书分别逆转录为cDNA;以cDNA为模板进行PCR反应,以β-肌动蛋白为TNF-α的内参,GAPDH为P38和IL-6的内参,内参基因与目的基因同时扩增,各基因的引物序列、产物长度及退火温度见表1,反应条件:94℃预变性2 m in,94℃变性30 s,退火40 s,72℃延伸40 s,35个循环,72℃延伸10 m in;取扩增产物4μL上样于1.5%琼脂糖凝胶(含0.5 g·L-1EB),100 V电泳30 m in,将凝胶放入凝胶成像系统摄像,计算TNF-α,P38,IL-6基因与β肌动蛋白,GAPDH基因扩增条带积分吸光度的比值表示TNF-α,P38和IL-6 m RNA表达的相对水平。

Tab.1 Primer sequences of P38,tumor necrosis factor-α(TNF-α),interleukin-6(lL-6),β-ac tin and GAPDH
1.5 ELlSA法检测细胞上清液中TNF-α和lL-6含量
给药24 h后收集96孔板各组细胞的上清液,严格按照ELISA试剂盒操作说明书检测TNF-α和IL-6含量。
1.6 统计学分析
2 结果
2.1 绿原酸对HaCaT细胞中SOD,GSH-Px和CAT活性及MDA含量的影响
表2结果显示,与正常对照组相比,模型对照组SOD,GSH-Px和CAT活性明显降低,MDA含量明显升高(P<0.01)。与模型对照组相比,加入CGA 1和10μmol·L-1组SOD,GSH-Px和CAT活性显著升高,MDA含量显著降低(P<0.05,P<0.01)。表明UVB 64 m J·cm-2照射HaCaT细胞造成了氧化损伤,CGA对UVB诱导的HaCaT细胞损伤有抑制作用;而CGA 0.1μm ol·L-1作用不明显。
2.2 绿原酸对HaCaT细胞中P38,TNF-α和lL-6 m RNA表达的影响
图1和表3结果显示,模型对照组中P38,TNF-α和IL-6 mRNA表达与正常对照组相比明显升高(P<0.01)。与模型对照组相比,加入CGA 1和10μmo l·L-1组P38,TNF-α和IL-6 m RNA的表达降低(P<0.05,P<0.01);提示CGA对UVB诱导的P38,TNF-α和IL-6基因表达有明显的抑制作用;而CGA 0.1μmol·L-1作用不明显。
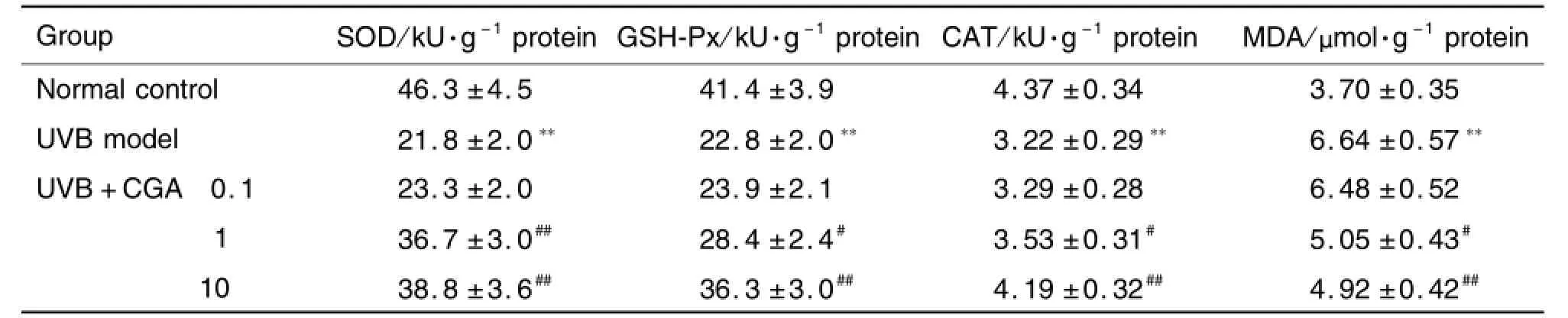
Tab.2 Effect of chlorogenic acid(CGA)on superoxide dismutase(SOD),glutathione peroxidase(GSH-Px),catalase(CAT)activities and malondialdehyde(MDA)content in HaCaT cells
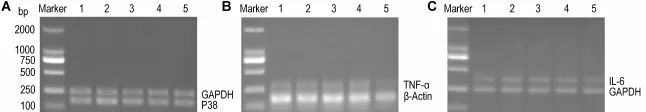
Fig.1 Effect of CGA on mRNA expression of P38(A),TNF-α(B)and lL-6(C)in HaCat cells injured by UVB.See Tab.1 for the treatment.Lane 1:normal control;lane 2:UVB model;lane 3:UVB+CGA 0.1μmol·L-1;lane 4:UVB+CGA 1μmol·L-1;lane 5:UVB+CGA 10μm ol·L-1.
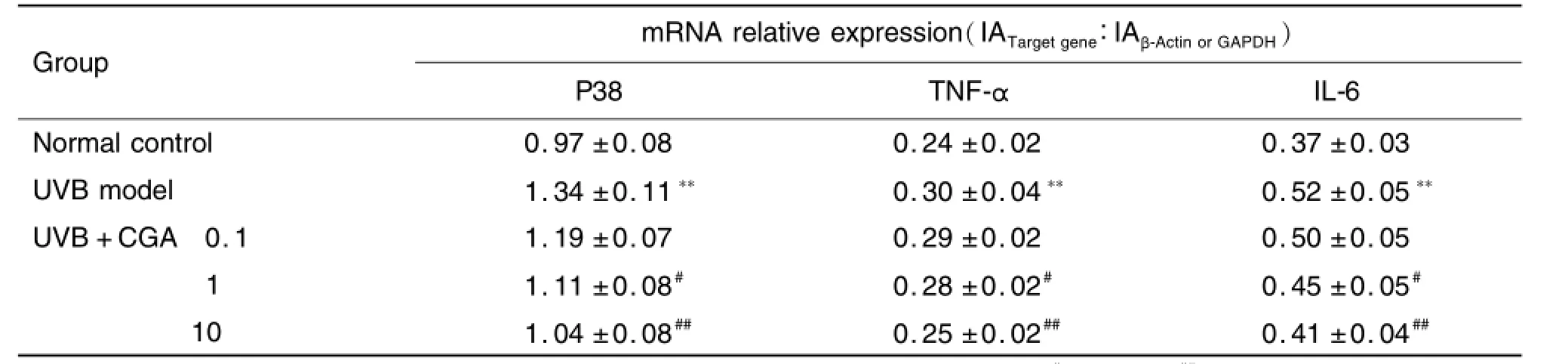
Tab.3 Effect of CGA on m RNA relative expression
2.3 绿原酸对HaCaT细胞上清液中TNF-α和lL-6含量的影响
表4显示,与正常对照组相比,模型对照组细胞上清液中TNF-α和IL-6含量明显升高(P<0.01);与模型对照组相比,CGA 1和10μmol·L-1能降低上清液中TNF-α和IL-6含量(P<0.05,P<0.01),且随着CGA浓度的增加,TNF-α和IL-6含量下降越明显;但CGA 0.1μmo l·L-1作用不明显。
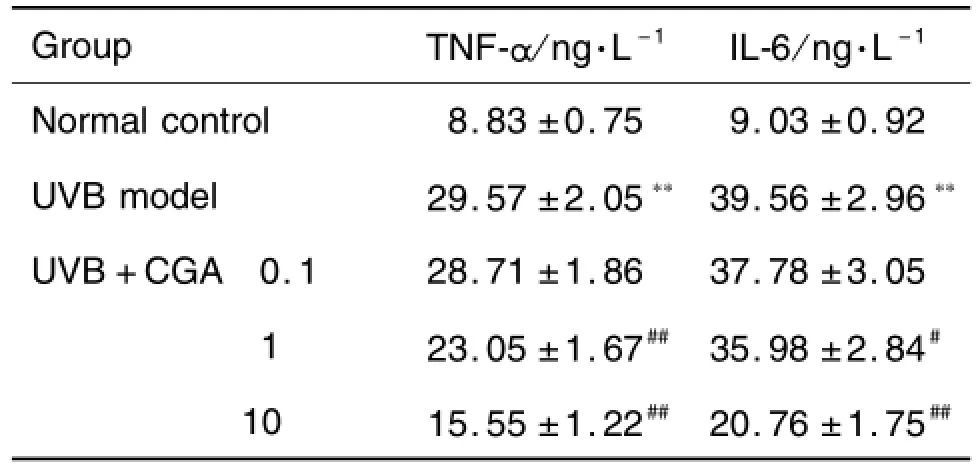
Tab.4 Effect of CGA on TNF-αand lL-6 content in HaCaT cell supernatant
3 讨论
越来越多的证据表明,UV照射使皮肤细胞抗氧化防御系统较正常细胞活性下降,细胞中ROS数量增加,ROS可直接攻击细胞膜脂质、蛋白质和DNA引起氧化性损伤[9]。本研究发现,UVB 64 m J·cm-2照射HaCaT细胞,导致细胞发生严重的氧化性损伤,使细胞内SOD,GSH-Px和CAT的活性下降,MDA含量升高。加入CGA处理24 h后,SOD,GSH-Px和CAT的活性升高,MDA含量降低,说明CGA对UVB引起的氧化损伤具有明显的对抗作用。
在UVB导致细胞损伤的发生发展过程中炎症是重要因素。TNF-α是一种具有介导炎症、免疫应答和凋亡等多种生物学效应的细胞因子,并可促进其他致炎细胞因子如IL-1,IL-6,IL-8和IL-12等的合成[10]。IL-6是一重要的细胞因子,是角质形成细胞-成纤维细胞相互作用环路中的重要中介物质,在炎症发生、免疫调节及UV等刺激引发的急性红斑中起着很重要的作用。角质形成细胞本身可分泌TNF-α和IL-6等多种细胞因子,但其基础分泌量不多,当受到UV等外来因素刺激时,其分泌量增加,进一步激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK),其中P38MAPK是控制炎症反应最主要的MAPK家族成员,可影响多种细胞因子如TNF-α,IL-1,IL-6和IL-8等的产生,这些细胞因子表达反过来又促进P38MAPK的活化,形成恶性循环,进一步加剧细胞损伤[11-12]。对这几种细胞因子的表达进行调控,能够缓解UV造成的损伤。本研究结果表明,UVB 64 m J·cm-2照射HaCaT细胞,细胞中P38,TNF-α和IL-6 m RNA表达量增加,上清液中TNF-α和IL-6含量增加,提示UVB照射诱导炎症反应的发生。CGA能显著降低HaCaT细胞中P38,TNF-α和IL-6 m RNA表达,显著降低上清液中TNF-α和IL-6的含量,提示CGA可能通过抑制P38,TNF-α和IL-6的表达,减轻细胞的炎症反应,保护UVB损伤的HaCaT细胞。
[1] Halliday GM.Inflammation,gene mutation and photoimmunosuppression in response to UVR-induced oxidative damage con tributes to photocarcinogenesis[J].Mutat Res,2005,571(1-2):107-120.
[2] Jagdeo J,Adam s L,Lev-Tov H,Sieminska J,Michl J,Brody N.Dose-dependent antioxidant function of resveratrol demonstrated via modulation of reactive oxygen species in normal human skin fibroblasts in vitro[J].J Drugs Dermatol,2010,9(12):1523-1526.
[3] Marionnet AV,Chardonnet Y,Viac J,Schmitt D.Differences in responses of interleukin-1 and tumor necrosis factor alpha production and secretion to cyclosporin-A and ultraviolet B-irradiation by normal and transformed keratinocyte cultures[J].Exp Dermatol,1997,6(1):22-28.
[4] Di Girolamo N,Wakefield D,Coroneo MT.UVB-mediated induction of cytokines and grow th factors in pterygium epithelial cells involves cell surface receptors and in tracellular signaling[J].Invest Ophthalmol Vis Sci,2006,47(6):2430-2437.
[5] Bennett MF,Robinson MK,Baron ED,Cooper KD.Skin immune system s and inflammation:protector of the skin or promoter of aging?[J].J Investig Dermatol Symp Proc,2008,13(1):15-19.
[6] Li X,Liu Y,Zhu WX,Bai XT,Wang N,Liu SY.Study advancement about chemical com position and pharmacological effects of Eucommia ulmoides Oliv[J].Sci Technol Food Industry(食品工业科技),2012,33(10):378-382.
[7] Ohnishi M,Morishita H,Iwahashi H,Toda S,Shirataki Y,Kimura M,et al.Inhibitory effects ofchlorogenic acids on linoleic acid peroxidation and haemolysis[J].Phytochemistry,1994,36(3):579-583.
[8] Sato Y,Itagaki S,Kurokawa T,Ogura J,Kobayashi M,Hirano T,et a l.In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid[J].Int J Pharm,2011,403(1-2):136-138.
[9] Kang S,Chung JH,Lee JH,Fisher GJ,Wan YS,Duell EA,et a l.Topical N-acetyl cysteine and genistein p revent ultravio le t-light-induced signaling that leads to photoaging in human skin in vivo[J].J Invest Dermatol,2003,120(5):835-841.
[10] Frank S,Käm p fer H,Wetzler C,Stallmeyer B,Pfeilschifter J.Large induction of the chemotactic cytokine RANTES during cutaneous wound repair:a regulatory role for nitric oxide in kera tinocyte-derived RANTES expression[J].Biochem J,2000,347(Pt1):265-273.
[11] Kirkwood KL,Rossa C Jr.The potential of p38 MAPK inhibitors to modulate periodontal infections[J].Curr Drug Metab,2009,10(1):55-67.
[12] Gaestel M,Kracht M.Peptides as signaling inhibito rs fo r mamm alian MAP kinase cascades[J].Curr Pharm Des,2009,15(21):2471-2480.
Regulation of chlorogenic acid on expression of tumor necrosis factor-αand in terleukin-6 in HaCat cells dam aged by ultroviolet
WANG Ye-qiu,CHEN Qiao-yun,LI Jian-m in,ZHANG Ning
(Jiamusi College,Heilongjiang University of Chinese Medicine,Jiamusi 154007,China)
OBJECTlVETo study the protective effect of chlorogenic acid(CGA)on HaCaT damaged by ultroviolet B(UVB)and explore its possible mechanism.METHODSIn the logarithmic growth phase,photo-dam aged HaCaT cells were established by subjecting the cells to irradiation of 64 m J·cm-2(intensity of0.61 mW·cm-2multiply time of105 s)UVB.After irradiation,CGA 0.1,1 and 10μmo l·L-1were added for 24 h.The superoxide dismutase(SOD)activity,catalase(CAT)activity,glutathione peroxidase(GSH-Px)activity,malondialdehyde(MDA)content were assayed by kits respectively.The m RNA levels of P38,tum or necrosis factor-α(TNF-α)and interleukin-6(IL-6)were determined by RT-PCR.The secretion levels of TNF-αand IL-6 of cultured HaCaT cells were detected by ELISA.RESULTSCompared with normal control group,the activities of SOD,CAT and GSH-Px were decreased,while the content of MDA,TNF-αand IL-6,the mRNA levels of P38,TNF-αand IL-6 were increased in UVB damaged HaCaT cells(P<0.01).Compared with UVB model group,after treatment with CGA 1 and 10μm ol·L-1,the activities of SOD,CAT and GSH-Px were increased,while the content of MDA was decreased(P<0.05).The expression levels of P38,TNF-αand IL-6 were decreased in cells,so did the content of TNF-αand IL-6 in the supernatant.CONCLUSlONCGA can inhibit the in jury by UVB to HaCaT cells.The mechanism may be re lated to the inhibition of oxidative damage,regulation of P38 signal pathway,and adjustment of the expression of TNF-αand IL-6.
chlorogenic acid;ultroviolet;cells,HaCaT;photo dam age
CHEN Qiao-yun,E-mail:chenqy0114@163.com,Tel:(0454)6050350
R986
A
1000-3002(2014)01-0063-05
Foundation item:The project supported by National Natural Science Foundation of China(81274035);Youth Natural Science Foundation of Heilongjiang Province(QC2010085);Administration of Traditional Chinese Medicine Natural Science Foundation of Heilongjiang Province(ZHY12-W 012);and Innovation Science Foundation of Heilongjiang University of Chinese Medicine
2013-07-23 接受日期:2013-12-13)
(本文编辑:乔 虹)
国家自然科学基金项目(81274035);黑龙江省青年科学基金项目(QC2010085);黑龙江省中医药管理局科研基金项目(ZHY12-W012);黑龙江中医药大学创新人才支持计划项目
王业秋(1979-),男,讲师,主要从事中药抗光损伤研究,E-mail:wyq8119@163.com。
陈巧云,E-mail:chenqy0114@163.com,Tel:(0454)6050350
