应用高内涵分析技术识别雄激素受体激动剂
2014-03-23王莉莉
冯 帆,龙 隆,李 微,王莉莉
(军事医学科学院毒物药物研究所药物合成研究室,北京 100850)
应用高内涵分析技术识别雄激素受体激动剂
冯 帆,龙 隆,李 微,王莉莉
(军事医学科学院毒物药物研究所药物合成研究室,北京 100850)
目的应用高内涵分析(HCA)技术快速识别对雄激素受体(AR)具有激动作用的药物。方法以稳定表达AR-增强绿色荧光蛋白融合蛋白(AR-EGFP)的人骨肉瘤细胞U2OS为模型,采用HCA技术观察本实验室收集的98个上市药物或优选化合物对AR-EGFP细胞核转位和核颗粒形成的影响,筛选对AR具有激活作用的化合物,分析其浓度效应关系;并用前列腺癌细胞PC-3(AR-/-)和LINCaP(AR+/+)的AR荧光素酶报告基因的筛选方法进行验证。结果HCA筛选发现,在98个受试药物中,乐卡地平、螺内酯、异丙肾上腺素和组胺能浓度依赖地促进AR-EGFP细胞核转位,其EC50分别为0.067±0.008,0.21±0.04,0.87±0.26和(4.53±1.04)μm o l·L-1;促进AR-EGFP细胞核颗粒形成,其EC50分别为0.023±0.006,0.82±0.13,3.00±1.68和(4.76±1.57)μm o l·L-1;地塞米松≥3μm ol·L-1时也表现出促进AR-EGFP细胞核转位和颗粒形成的作用。荧光素酶报告基因结果显示,在PC-3和LINCaP细胞中,乐卡地平、异丙肾上腺素、螺内酯、组胺和地塞米松均可促进外源和内源AR的转录活性,与HCA结果基本一致,但结果高于HCA筛选测得的EC50。结论以荧光标记细胞为基础的HCA技术是灵敏和快速识别AR激动剂的分析方法。乐卡地平、螺内酯、异丙肾上腺素、组胺和地塞米松具有AR激动活性。
高内涵分析;雄激素受体;激动剂
DO l:10.3867/j.issn.1000-3002.2014.01.007
雄激素受体(androgen receptor,AR)在前列腺增生、前列腺肥大、原发性前列腺癌以及前列腺癌复发和转移等多个病理阶段发挥重要作用[1-3]。AR为核受体超家族成员之一,当细胞中存在雄激素包括二氢睾酮(dihydrotestosterone,DHT)、人工合成雄激素如R1881、能激活AR的环境激素及药物时[4-5],AR即与上述分子结合,通过其DNA结合结构域结合到其调控基因的启动子雄激素反应元件(androgen response element,ARE)序列上,开启下游基因如前列腺癌血清抗原等的转录,促进前列腺癌细胞增殖,促进前列腺癌的发生和进展[6-7]。目前,前列腺临床组织标本中AR表达水平的检测及对AR有激动活性的药物和环境激素的筛查等已成为前列腺癌研究的重要内容[8-11]。因此,建立快速和高效的AR激动剂样分子的识别和筛查方法对于发现具有潜在的诱发和促进前列腺癌发展的药物以及预测其临床风险具有重要意义。
高内涵分析(high content analysis,HCA)技术作为一种新的筛选技术,能在活细胞上高通量和定量检测受试分子对特定和全部细胞表型的影响,在发现受试分子生物活性的同时,还可全面地了解其毒性信息,在新的活性实体分子的识别及其作用特征谱研究等方面具有优势[12-13]。荧光标记的细胞是HCA的主要模型,通过观察受试分子对细胞中稳定表达增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)-靶点(标志性信号分子)融合蛋白的表达和转位的影响,定量分析受试分子对特定靶点或通路的影响[14-17]。本研究采用稳定表达AR-EGFP融合蛋白的U2OS细胞分析模型,通过检测药物对AR-EGFP迁移进入细胞核并募集在DNA的ARE序列上形成颗粒的荧光强度的变化,从本实验室收集的98个药物或候选药物中快速筛选出了一些具有激活AR的分子,并在前列腺癌细胞PC-3(AR-/-)和LINCaP(AR+/+)上,用经典的荧光素酶报告基因的方法进行了验证。
1 材料与方法
1.1 药物和细胞
本实验室收集的98个药物或候选药物均采用质谱确证其结构正确,并采用HPLC检测其纯度>98%。上述药物均用DMSO配制成30 mmo l·L-1的母液,4℃保存。
稳定表达AR-EGFP融合蛋白的人骨肉瘤U2OS细胞购自美国Termo公司;前列腺癌细胞系PC-3和LINCaP细胞系及所用质粒均由首都医科大学基础医学研究所杨予涛博士惠赐。
1.2 试剂和仪器
DMEM高糖培养基和F12培养基,美国Hyclone公司;新霉素(G418),美国Merck公司;DHT(用DMSO配制成1 mmol·L-1的母液备用,4℃保存)和L-谷氨酰胺,美国Sigma公司;胎牛血清(feta l bovine serum,FBS),美国Hyclone公司;Hoechst 33342和Lipofectamine 2000购自美国Invitrogen公司;AR单抗购自美国Cell Signaling Technology公司;兔抗人GAPDH多抗购自北京天根公司;荧光素酶检测试剂盒和非变性细胞裂解液购自美国Prom ega公司;其余试剂均为国产分析纯试剂。Corning 430641细胞培养瓶、6孔细胞培养板、24孔细胞培养板和Costar 3603 96孔黑色透底细胞培养板购自美国Corning公司。IN Ce ll Ana lyzer 1000高内涵分析工作站,美国GE公司;TS-100倒置相差显微镜购自日本Nikon公司。
1.3 细胞培养条件
U2OS细胞培养于含2 mmo l·L-1的L-谷氨酰胺,0.5 g·L-1的G418和10%FBS的DMEM高糖培养液中;PC-3和LINCaP细胞培养于含10% FBS和L-谷氨酰胺2 mm ol·L-1的DMEM高糖培养基中;置37℃,5%CO2孵箱培养。
1.4 基于细胞表型分析在U2OS细胞上筛选对AR有激动活性的药物
1.4.1 受试化合物配制
以含4‰DMSO的分析培养液(F12+HEPES 10 mmol·L-1+1%FBS)溶解,DMSO终浓度为1‰。
1.4.2 细胞处理
在96孔黑色底透细胞培养板中,以每孔7.5×103细胞(100μL)种板,37℃,5%CO2培养18~24 h。每孔细胞用200μL分析培养液洗1次,加入150μL分析培养液,于37℃,5%CO2孵育60 m in。每孔加入50μL 4×激动剂或4×药物或4×对照工作液(4‰DMSO),初筛时,根据每个受试药物的细胞毒性选2个浓度(表1),每个浓度设3个复孔。复筛时,根据初筛的活性,每种药物选择7个浓度(表2),每个浓度设3个复孔,37℃,5%CO2孵育6 h。之后,每孔加入室温预温的3×固定液(12%甲醛PBS溶液)100μL混匀,室温孵育20 m in,用PBS洗3次,每孔加入200μL细胞核染色液(含Hoechst33342 1μm o l·L-1的PBS),室温染色1~2 h,换PBS后上机采集图像。
1.4.3 细胞成像与分析
使用IN Ce ll Analyzer 1000 HCA系统进行细胞成像,并进行图像分析。成像条件如下:20倍物镜,第一通道(检测Hoechst33342标记细胞核)激发波长Ex=360 nm,发射波长Em=480 nm,曝光时间300 m s;第二通道(检测EGFP)激发波长Ex=475 nm,发射波长Em=535 nm,曝光时间为800 m s。每孔选择5个视野连续拍照。使用IN Cell Analyzer 1000 Workstation 3.5图像分析软件的细胞核颗粒形成分析模块(nucleus granule analysis module)分析AR-EGFP的细胞核颗粒形成作用,使用蛋白细胞质/核转位分析模块(cytoplasmic/nucleus translocation analysis module)分析AR-EGFP细胞核转位的变化。
初筛实验结果中,AR-EGFP细胞核转位变化用(细胞核绿色荧光强度-背景绿色荧光强度)/(细胞质绿色荧光强度-背景绿色荧光强度)比值表示。复筛实验结果以DHT的最大激动活性为100%,计算受试药物的相对激动活性,计算公式为:①AR-EGFP的细胞核颗粒形成率(%)=(受试药物处理组细胞核颗粒总面积/DHT最大激动活性组细胞核颗粒总面积)×100%;②AR-EGFP的细胞核转位率(%)=(受试药物处理组细胞核转位/DHT最大激动活性组细胞核转位)×100%。
1.5 前列腺癌细胞AR转染与表达鉴定
取对数生长期的PC-3细胞,制成细胞悬液,将密度调整为1×108L-1,接种于6孔细胞培养板中,每孔1000μL,37℃,5%CO2,80%湿度条件下培养。待细胞在孔内密度达到80%~90%后,换无血清无抗生素培养基,培养箱中孵育1 h,加入制备的质粒-脂质体复合物,每孔50μL,轻微振板混匀,置于培养箱中。培养4~6 h后,换成添加10%FBS的培养基每孔100μL,37℃,5%CO2,80%湿度条件下继续培养,获得瞬转AR的细胞。一部分细胞用于AR表达鉴定,一部分用于荧光素酶报告基因实验。质粒-脂质体复合物制备过程:先分别将0.5μL Lipofectamine 2000和200 ng质粒(0.5μL无血清无抗生素培养基溶解)加入到2管(含24.5μL无血清无抗生素培养基)中,混匀,室温静置15 m in,再将上述2管液体按1∶1混合,轻轻混匀,室温静置15~20 m in即可。

Tab.1 Drugs to be tested and their concentrations in primary screening using high content analysis(HCA)technology
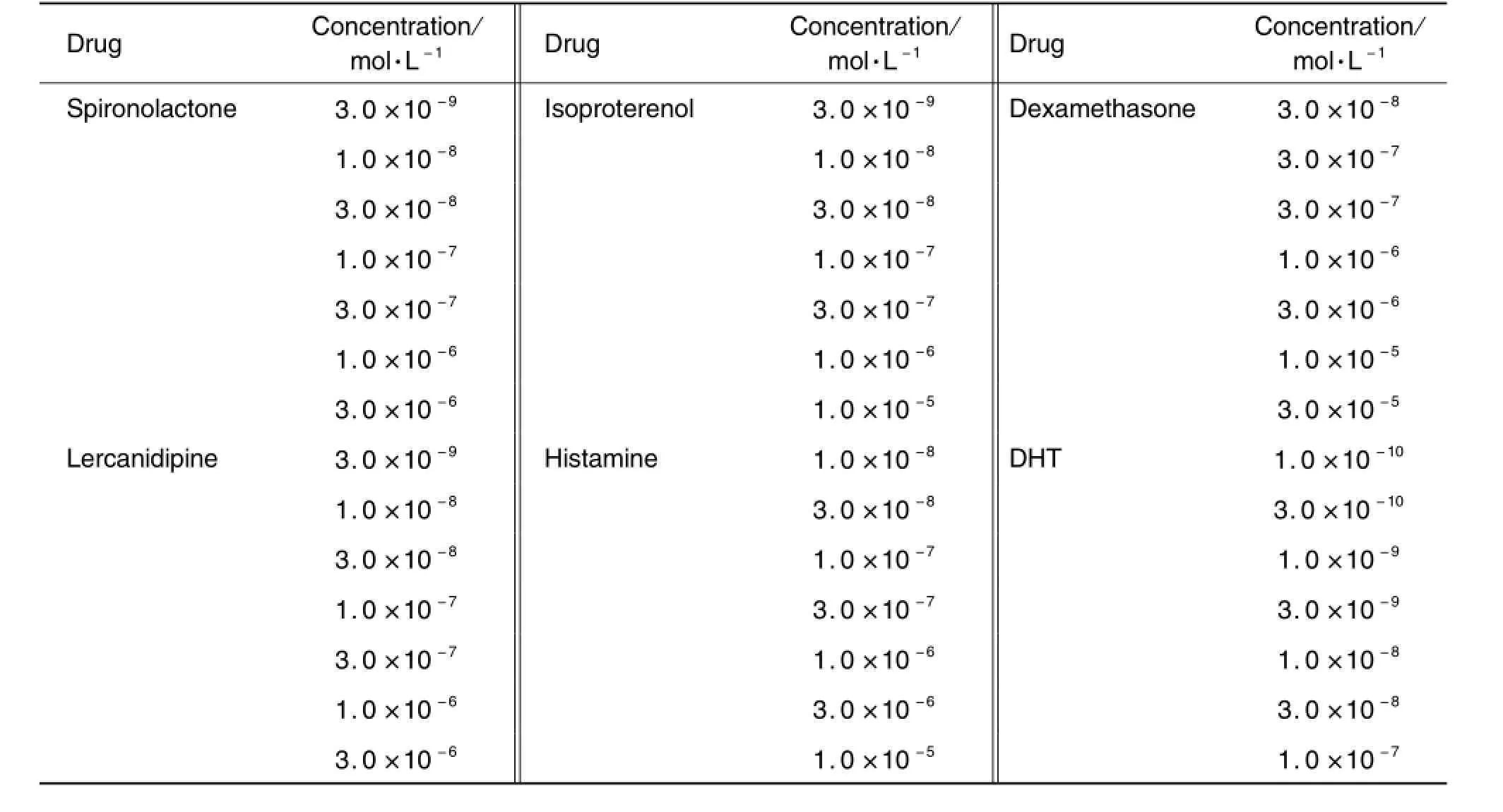
Tab.2 Concentrations of tested d rugs in concentration-response experiments on androgen receptor(AR)activation
收集LINCaP和转染AR的PC-3细胞,采用Western蛋白质印迹法进行表达鉴定。兔抗人AR单抗稀释度为1∶2000,兔抗人GAPDH多抗的稀释度为1∶5000。
1.6 应用荧光素酶报告基因实验验证活性药物对AR转录激活的作用
分别用PC-3和LINCaP细胞进行AR的荧光素酶报告基因实验。①将ARE-荧光素酶报告基因(ARE-luciferase reporter,ARE-Luc)和AR表达载体共转染AR表达阴性的PC-3细胞,按照每孔7.5×104(70%密度)接种细胞于24孔板中。加入不同浓度的受试药物(表2),每个浓度3复孔,37℃,5%CO2,80%湿度条件下继续培养24 h,收集细胞,用非变性裂解液4℃裂解细胞,14 170×g 4℃离心15 m in后,收集上清,使用荧光素酶报告基因试剂盒进行荧光素酶活性检测。②AR表达阳性LINCaP细胞只转染ARE-Luc,其他实验方法步骤与PC-3细胞相同。
以DHT的最大激动活性为100%,计算受试药物的激动活性,计算公式为:〔(受试药物处理组ARE-Luc的荧光素酶活性-溶剂对照组ARE-Luc的荧光素酶活性)/(DHT最大激动活性组细胞ARE-Luc的荧光素酶活性-溶剂对照组ARE-Luc的荧光素酶活性)〕×100%。
1.7 统计学分析
2 结果
2.1 受试药物对AR-EGFP细胞核转位和颗粒形成作用的影响
选择无细胞毒性的2个浓度进行初筛。结果显示,细胞对照和溶剂对照组均未检测到AR-EGFP的细胞核转位和颗粒形成(Foci),98个受试化合物中,阳性药DHT以及乐卡地平(lercanidipine)、螺内酯(spironolactone)、异丙肾上腺素(isoproterenol)、组胺(histamine)和地塞米松(dexamethasone)能够诱导AR-EGFP产生细胞核转位和颗粒形成作用(表3)。表明上述6个药物可能对AR具有激活作用。
2.2 活性药物诱导AR-EGFP细胞核转位和颗粒形成的浓度效应关系
根据初筛受试药物显示出的激动活性,每种药物选择7个浓度进行浓度效应关系研究。结果显示,DHT、乐卡地平、螺内酯、异丙肾上腺素和组胺能够诱导AR-EGFP的细胞核转位和颗粒形成作用(图1),浓度效应分析结果(图2)表明,地塞米松在>3μmol·L-1浓度时也浓度依赖地促进AR-EGFP的细胞核转位和颗粒形成作用,但其最大效应仅为阳性药物DHT最大效应的22.0%和37.1%。上述药物浓度效应关系的R2值分别为0.98和0.95,0.98和0.95,0.99和0.98,0.97和0.99,0.96和0.94,以及0.92和0.96;其P值分别为0.0026和0.0034,0.0026和0.0022,0.0022和0.0019,0.0012和0.0017,<0.0001和0.0017,以及0.0058和0.0014。其EC50值和最大效应见表4。表明上述药物在细胞水平确有浓度依赖性地激活AR的作用。
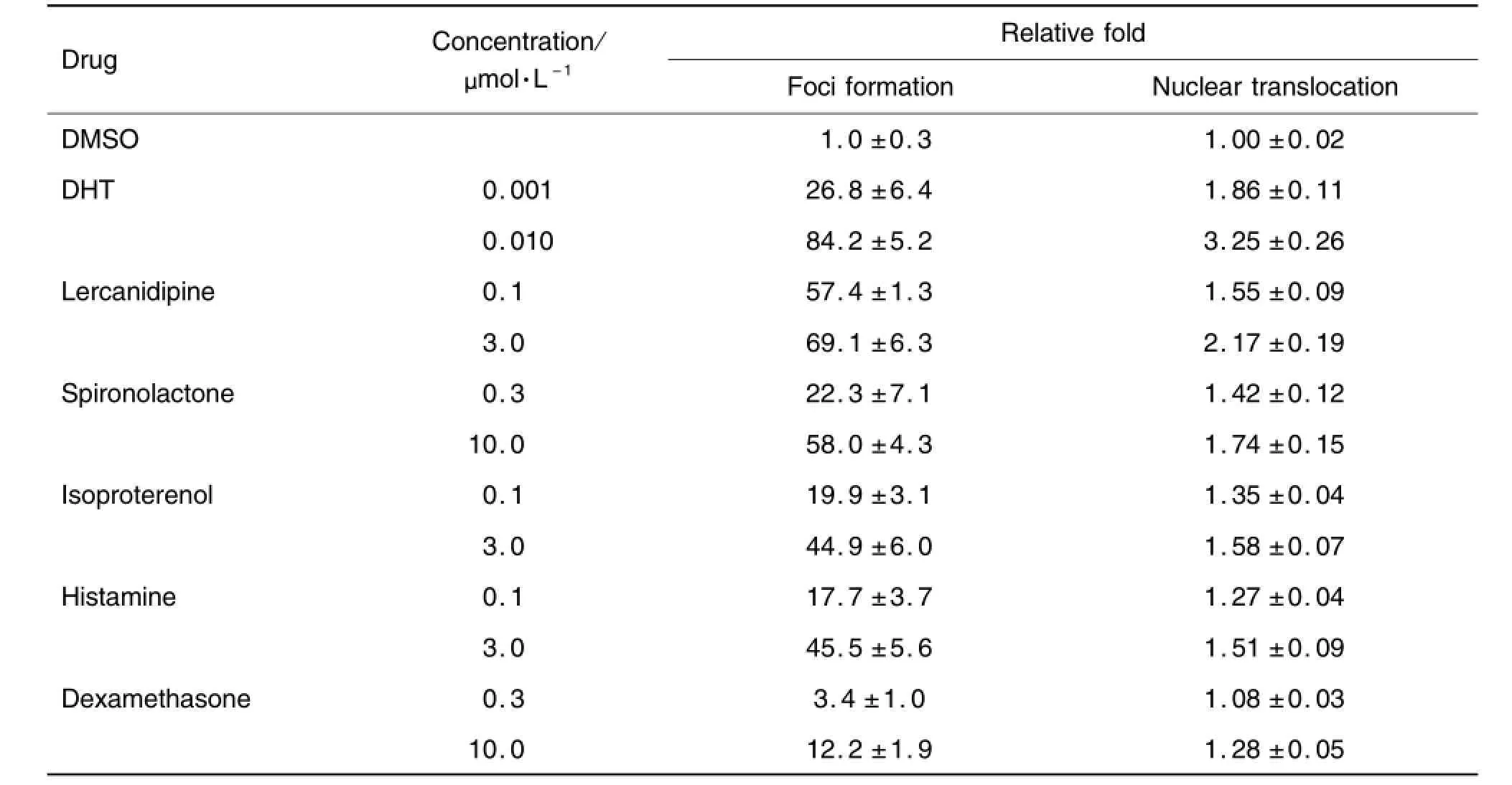
Tab.3 AR activation of activated drugs from primary screening
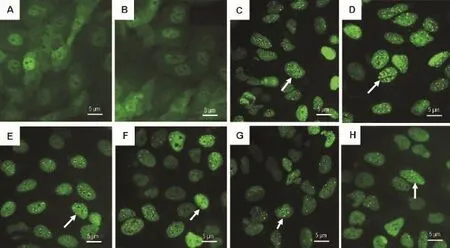
Fig.1 Effect of activated compounds on AR nuclear translocation and granule formation in AR-EGFP U2OS cells.See Fig.1 for the cell treatment.A:normal control;B:solvent control;C:DHT 10 nmol·L-1;D:lercanidipine 30 nmol·L-1;E:spironolactone 300 nmol·L-1;F:isoproterenol100 nmol·L-1;G:histamine 1μmol·L-1;H:dexamethasone 10μmol·L-1.Arrows show AR-EGFP granule formation.

Fig.2 Concentration-effect curves of activated d rugs on AR activation in U2OS,PC-3 and LlNCaP cells.The agonist-like effects of drugs on AR were observed by detecting the AR-EGFP nuclear accumulation and granule formation with HCA technology 6 h after U2OS cells were incubated with corresponding drugs or by detecting luciferase activity with luciferase reporter gene assay 24 h after PC-3 and LINCaP cells were incubated with corresponding drugs.A:DHT;B:lercanidipine;C:spironolactone;D:isoproterenol;E:histamine;F:dexamethasone.ARE-Lue:androgen response element luciferase reporter.,n=3.
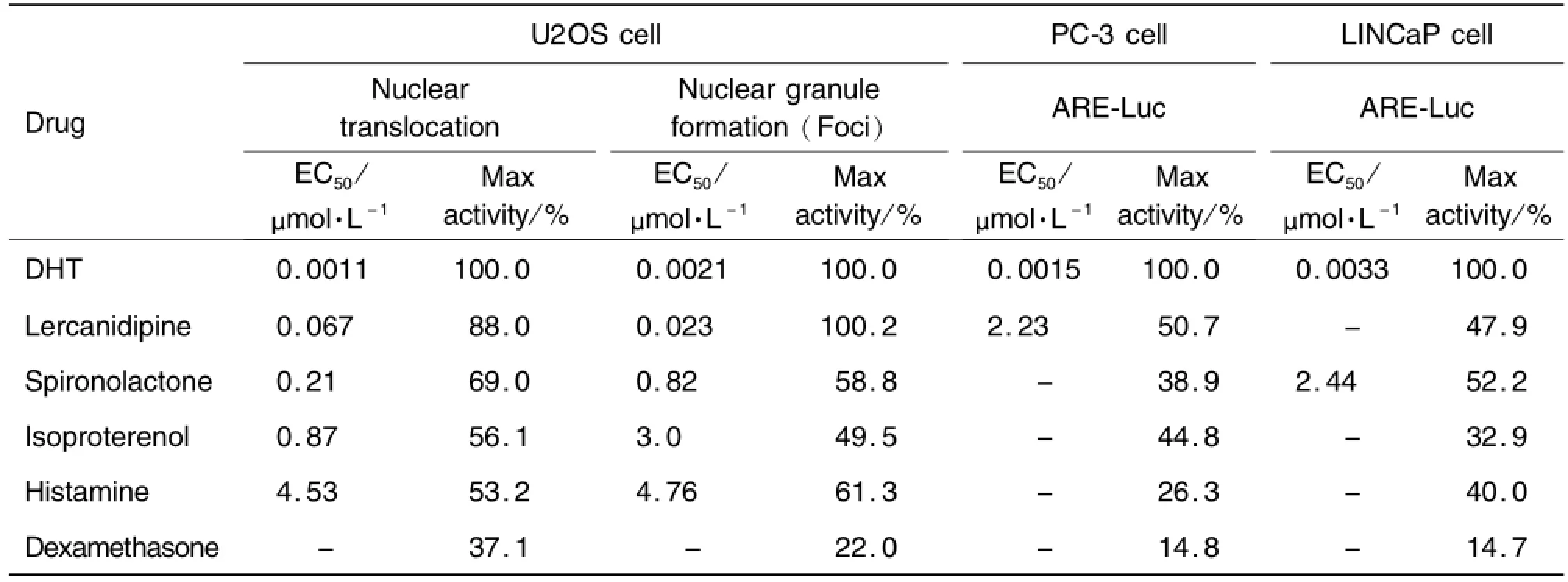
Tab.4 AR activation of active drugs in U2OS,PC-3 and LlNCaP cells
2.3 前列腺癌细胞系PC-3和LlNCaP中AR的表达鉴定
Western蛋白质印迹实验结果表明,仅有转染AR表达载体而不是相应空载体的PC-3细胞中表达AR(图3A);与文献报道一致;LINCaP细胞表达AR,转染ARE-Luc载体和相应空载体不能影响LINCaP细胞的AR表达水平(图3B)。
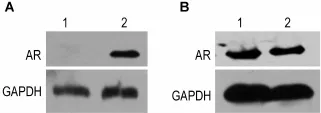
Fig.3 Expression of AR in PC-3(A)and LlNCaP(B)cells detected by Wes tern blotting.1:empty vector;2:ARE-Luc expression vector.
2.4 活性药物对PC-3和LlNCaP细胞AR报告基因的影响
为验证HCA筛选实验结果的可靠性,在转染和内源表达AR的PC-3和LINCaP前列腺癌细胞上,采用荧光素酶报告基因的方法测定了活性药物对AR转录激动活性。结果显示,除阳性对照药物DHT外,乐卡地平、螺内酯、异丙肾上腺素、组胺和地塞米松均能促进外源和内源AR的报告基因ARE-Luc的表达,表现为药物处理组荧光素酶活性浓度依赖性地增加(图2),其R2值分别为0.94和0.97,0.98和0.95,0.99和0.98,0.97和0.99,0.96和0.94,以及0.92和0.96;其P值分别为0.0042和0.0033,0.0022和0.0019,0.0012和0.0017,<0.0001和0.0017,以及0.0058和0.0014,其最大激动活性和EC50见表4,这一结果与HCA分析的趋势基本一致,但HCA分析获得的EC50值更低,最大效应值更高。表明细胞HCA方法较报告基因的分析方法灵敏度更高。也表明HCA的细胞分析方法用于识别AR激活作用的化合物更灵敏和可靠。
3 讨论
药物的脱靶效应(off-targets effect)和隐藏效应(hidden effect)是其临床毒性作用的根源,也是其临床再定位的依据[14-17]。随着新药研究技术的快速发展,多参数高通量的筛查方法为快速筛查药物及候选药物的脱靶及未知效应、有效避免药物在临床应用时产生的不良反应提供了高效的方法。AR在前列腺癌发生和发展过程中具有决定性的作用。对AR有激动活性的药物有诱导前列腺癌发生、并促进前列腺癌细胞增殖的风险。发现具有靶点外激活AR活性的药物,有助于早期预测和防范前列腺癌发生和进展的临床风险。
AR的天然配体是内源性睾酮等雄性激素,包括DHT等,它们能够特异性地与AR的配体结合结构域结合,诱导AR的构象发生变化,促进转录共激活因子SRC等的募集作用,促进共抑制因子SMRT和NCoR1等解离,最终促进AR的细胞核转位以及在ARE上的募集作用并开放下游靶基因[1-5]。因此,AR激活过程可在多环节上被调控。研究发现,AR在其配体或药物的作用下迁移进入细胞核,并募集在ARE上是介导和开启AR下游基因(前列腺癌血清抗原)转录的关键步骤。利用这一现象,通过构建AR标记的细胞,定量测定分析标记AR的核转位的量和形态,即可对AR的激活以及配基的作用进行定量研究。类似的方法曾用于研究高内涵筛选受试药物对转录因子,如叉头转录因子(forkhead transcription factors)FKHR的影响[18]。本研究采用 HCA技术,以稳定表达AR-EGFP融合蛋白的U2OS细胞为筛选模型,发现作用于离子通道的乐卡地平、作用于盐皮质激素受体的螺内酯、作用于G蛋白耦联受体的异丙肾上腺素和组胺等能够浓度依赖性地促进AR在细胞核中的颗粒形成作用,提示这些药物除了自身作用靶点以外,都具有激活AR的作用。为证实上述实验方法和结果的可靠性,本研究又采用经典的荧光素酶报告基因方法在前列腺癌PC-3和LINCaP细胞上进行了验证。结果证实,乐卡地平、螺内酯、异丙肾上腺素、组胺和地塞米松能够激活AR,升高前列腺癌PC-3和LINCaP细胞中ARE-Luc报告基因活性,使荧光素酶表达增加。对比2种AR激动剂的分析方法,可以看出,两方法获得的浓度效应曲线的类型与斜率基本一致,但HCA方法检测出的最大效应更强、EC50值更低、标准差更小。表明HCA方法的灵敏度和重复性均优于荧光素酶报告基因的方法。
乐卡地平、螺内酯、异丙肾上腺素、组胺和地塞米松均为临床治疗中的常用药物。其中螺内酯、异丙肾上腺素、组胺和地塞米松在前列腺癌的临床应用已有部分报道。异丙肾上腺素和组胺能够促进前列腺癌细胞的增殖,促进前列腺癌的进展[19-20]。β-肾上腺素能受体、组胺受体和β-拘留蛋白(arrestin)可能介导了这一过程[20-21]。本研究结果为上述报道提供了进一步的实验依据。
螺内酯的作用机制较为复杂,目前尚无定论。有研究显示,螺内酯能够单独发挥AR激动剂的作用,促进前列腺癌的进展,升高AR下游基因前列腺癌血清抗原的水平[22-23],其最大激动活性可达到DHT的32%~35%[24-25]。本研究中,荧光素酶报告基因实验的结果与之一致,而HCA筛选确定的螺内酯活性高于上述报道。此外,螺内酯作为AR的拮抗剂,能降低DHT对AR的激动活性。因此,螺内酯对AR的作用和调控机制尚需进一步研究。
综上所述,本研究应用HCA技术对AR有激动活性的药物进行筛查,筛选所得药物对AR细胞核转位和颗粒形成的影响与对AR转录激动活性具有平行关系。由此表明,应用HCA技术快速发现AR激动作用的药物是可行的,这对于快速发现具有药物潜在不良反应(如诱发和促进前列腺癌的临床风险)以及评价环境来源污染物质的临床风险等具有重要意义。
参考文献:
[1] Grönberg H.Prostate cancer epidemiology[J].Lancet,2003,361(9360):859-864.
[2] Berry WR.The evolving role of chemotherapy in androgen-independent(hormone-refractory)prostate cancer[J].Urology,2005,65(6 Supp l):2-7.
[3] Gu F.Changing constituents of genitourinary cancer in recent50 years in Beijing[J].Chin Med J(Engl),2003,116(9):1391-1393.
[4] Chmelar R,Buchanan G,Need EF,Tilley W,Greenberg NM.Androgen receptor coregulators and their involvement in the development and progression of prostate cancer[J].Int J Cancer,2007,120(4):719-733.
[5] Taplin ME,Balk SP.Androgen receptor:a key molecule in the progression of prostate cancer to hormone independence[J].J Cell Biochem,2004,91(3):483-490.
[6] Cui J,Germer K,Wu T,Wang J,Luo J,W ang SC,et al.Cross-talk between HER2 and MED1 regulates tamoxifen resistance of human breast cancer cells[J].Cancer Res,2012,72(21):5625-5634.
[7] Licciardi M,Amato G,Cappelli A,Paolino M,GiulianiG,Belmonte B,et al.Evaluation of ther-moresponsive properties and biocompatibility of polybenzofulvene aggregates for leuprolide delivery[J].Int J Pharm,2012,438(1-2):279-286.
[8] Bakin RE,G ioeliD,Sikes RA,Bissonette EA,Weber MJ.Constitutive activation of the Ras/mitogen-ac tivated protein kinase signaling pathway promotes androgen hypersensitivity in LNCaP prostate cancer cells[J].Cancer Res,2003,63(8):1981-1989.
[9] Yu DS,Hsieh DS,Chang SY.Modulation of prostate carcinoma cell growth and apoptosis by chromogranin A[J].J U rol,2003,170(5):2031-2035.
[10] Koivisto P.Aneuploidy and rapid cell proliferation in recurrent prostate cancers with androgen receptor gene amplification[J].Prostate Cancer Prostatic Dis,1997,1(1):21-25.
[11] Chmelar R,Buchanan G,Need EF,Tilley W,Greenberg NM.Androgen receptor coregula tors and their involvement in the development and progression of prostate cancer[J].Int J Cancer,2007,120(4):719-733.
[12] Rege YD,Rangneka r VM.Molecular therapy intervention prospects in prostate cancer[J].Curr Pharm Des,2004,10(5):523-530.
[13] Abraham VC,Taylor DL,Haskins JR.High content screening applied to large-scale cell biology[J].Trends Biotechno l,2004,22(1):15-22.
[14] Mehier-Humbert S,Bettinger T,Yan F,Guy R.Influence of polymer adjuvants on the ultrasoundm ediated transfection of cells in culture[J].Eur J Pharm Biopharm,2009,72(3):567-573.
[15] MacDonald ML,Lamerdin J,Owens S,Keon BH,Bilter GK,Shang Z,et a l.Identifying off-target effects and hidden phenotypes of drugs in human cells[J].Nat Chem Biol,2006,2(6):329-337.
[16] Starkuviene V,Pepperkok R.The potential of high-content high-throughput microscopy in drug discovery[J].Br J Pharmacol,2007,152(1):62-71.
[17] Valet GK,Tárnok A.Cytomics in predictive medicine[J].Cytometry B Clin Cytom,2003,53(1):1-3.
[18] Terstappen GC,Schlüpen C,Raggiaschi R,Gaviraghi G.Target deconvolution strategies in drug discovery[J].Nat Rev Drug Discov,2007,6(11):891-903.
[19] Bouck DC,Shu P,Cui J,Shelat A,Chen T.A high-content screen identifies inhibitors of nuclear export of forkhead transcription factors[J].J Biomol Screen,2011,16(4):394-404.
[20] Zhang P,He X,Tan J,Zhou X,Zou L.β-Arrestin2 mediatesβ-2 adrenergic receptor signaling inducing prostate cancer cell progression[J].Oncol Rep,2011,26(6):1471-1477.
[21] Ramos-Jiménez J,Soria-Jasso LE,López-Colombo A,Reyes-Esparza JA,Camacho J,Arias-Montaño JA.Histamine augments beta2-adrenoceptor-induced cyclic AMP accumulation in human prostate cancer cells DU-145 independently of known histamine receptors[J].Biochem Pharmacol,2007,73(6):814-823.
[22] Kasbohm EA,Guo R,YowellCW,BagchiG,Kelly P,Arora P,et al.Androgen receptor activation by G(s)signaling in prostate cancer cells[J].J Biol Chem,2005,280(12):11583-11589.
[23] Sundar S,Dickinson PD.Spironolactone,a possible selective androgen receptor modulator,should be used with caution in patients with metastatic carcinoma of the prostate[J].BMJ Case Rep,2012,2012.pii:bcr1120115238.doi:10.1136/bcr.11.2011.5238.
[24] RybikowskiS,Maurin C,Deturmeny J,Delaporte V,Lechevallier E,Coulange C.PSA and spirono-lactone[J].Prog Urol,2010,20(2):154-157.
[25] Luthy IA,Begin DJ,Labrie F.Androgenic activity of synthetic progestins and spironolactone in androgen-sensitive mouse mammary carcinoma(Shionogi)cells in culture[J].J Steroid Biochem,1988,31(5):845-852.
ldentification of androgen receptor agonists using high content analysis technology
FENG Fan,LONG Long,LI Wei,WANG Li-li
(Department of Drug Design and Synthesis,Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTlVETo quickly identify androgen receptor(AR)agonists via high content analysis(HCA)technology.METHODSHCA technology was used to screen the AR agonist by quantitatively analyzing the effect of the collected drugs and candidate compounds on AR-enhanced green fluorescent protein(EGFP)granule formation(Foci)and AR-EGFP nuclear translocation in U2OS cells.The results were confirmed by the AR luciferase reporter system assay with PC-3(AR-/-)and LINCaP(AR+/+)prostate carcinoma cells.RESULTSLercanidipine,spironolactone,isoproterenol and histamine concentration-dependently promoted the nuclear accumulation and granule formation of AR-EGFP.The EC50was 0.067±0.008 and 0.023±0.006,0.21±0.04 and 0.82±0.13,0.87±0.26 and 3.00± 1.68,4.53±1.04 and(4.76±1.57)μmo l·L-1,respectively.Dexamethasone more than 3μm o l·L-1showed analogical effects.In AR luciferase reporter experiments with PC-3 and LINCaP cells,the above active molecules increased the transcriptional activity of exogenous and endogenous AR in a concentration-dependent manner,as was proved by the results of HCA,but their EC50was higher than that by HCA.CONCLUSlONHCA technology,which is based on cell phenotypes analysis,can serve as an efficient method for AR agonist identification.Lercanidipine,spironolactone,isoproterenol,histamine and dexamethasone exhibit AR agonist-like effect.
high content analysis;androgen receptor;agonist
WANG Li-li,E-mail:wangll63@126.com
R965.1
A
1000-3002(2014)01-0042-09
Foundation item:The project supported by National Mega-project of Science Research of China(2009ZX09501-031);and National Mega-project of Science Research of China(2012ZX09301003-003)
2013-03-06 接受日期:2013-05-14)
(本文编辑:齐春会)
国家科技重大专项(2009ZX09501-031);国家科技重大专项(2012ZX09301003-003)
冯 帆(1985-),男,博士研究生,主要从事分子药理学和药物筛选与评价研究;王莉莉(1963-),女,博士,研究员,博士生导师,主要从事分子药理学和药物筛选与评价研究。
王莉莉,E-mail:wangll63@126.com
