茯苓和茯苓皮水和乙醇提取物的利尿作用及其活性成分的分离鉴定
2014-03-23陈丹倩冯亚龙赵英永
田 婷,陈 华,殷 璐,陈丹倩,冯亚龙,赵英永
(西北大学生命科学学院西部资源生物与现代生物技术教育部重点实验室,陕西西安 710069)
茯苓和茯苓皮水和乙醇提取物的利尿作用及其活性成分的分离鉴定
田 婷,陈 华,殷 璐,陈丹倩,冯亚龙,赵英永
(西北大学生命科学学院西部资源生物与现代生物技术教育部重点实验室,陕西西安 710069)
目的采用化学成分的提取分离与利尿活性评价相结合方法,寻找茯苓和茯苓皮利尿活性部位并确定活性部位的主要化学成分。方法口服给予生理盐水负荷正常大鼠不同剂量的茯苓和茯苓皮的水或乙醇提取物,记录6 h尿量,测定尿液的pH值及电解质Na+,K+和Cl-的含量,并采用色谱分离法对活性部位进行化学成分分离,用NMR法对分离的化学成分进行结构鉴定。结果与对照组相比,口服茯苓皮乙醇提取物150,300和600 mg·kg-1大鼠尿量分别增加29%,21%和42%(P<0.01),K+排泄量分别减少18%,22%和27%(P<0.01),各组Na+/K+比值均升高;600 m g·kg-1组大鼠尿液Na+排泄量显著增加14%(P<0.05);茯苓水提取物50,100和200 m g·kg-1,茯苓乙醇提取物62.5,125和250 m g·kg-1及茯苓皮水提取物75,150和300 mg·kg-1无利尿作用。化学成分提取与分离结果显示,茯苓皮乙醇提取物主要包含四环三萜类化合物茯苓酸、猪苓酸C、去氢土莫酸、3-表去氢土莫酸、去氢齿孔酸、齿孔酸和去氢齿孔酮酸等。结论茯苓皮乙醇提取物具有显著的利尿作用,其主要化学成分为四环三萜类化合物。
茯苓;茯苓皮;四环三萜;利尿;电解质
DO l:10.3867/j.issn.1000-3002.2014.01.009
茯苓〔Poria cocos(Schw.)Wolf.〕是多孔菌科(polyporaceae)卧孔属(Poria)的干燥真菌菌核,主产于云南、安徽和湖北省等地,其性平,味甘、淡,具有利水渗湿、健脾和胃及宁心安神的作用,主要用于治疗小便不利、水肿、脾胃气虚、食少便溏、体倦乏力以及心神不宁、惊悸和失眠等症[1],为多种方剂和中成药的原料,有“十药九茯苓”一说。而它的外皮即茯苓皮(Cortex Poriae),性平,味甘、淡,归心、肺、脾、肾经,功专利水消肿[2]。从茯苓中分离得到的化学成分主要为三萜类、多糖类和甾体类等[3-7],而茯苓皮中则主要为三萜类和多糖类等[2,8]。有文献报道,茯苓皮在我国是一味常用的利水消肿药,但在日本被当做下脚料弃掉,造成资源的巨大损失[8]。随着西药利尿药不良反应报道的逐渐增多[9-11],寻找具有良好作用的中药利尿药变得越来越重要。长期以来,人们对茯苓皮的研究主要集中于抗肿瘤、抗炎和抗菌等活性,却忽略了它传统的利尿活性。本研究对茯苓和茯苓皮的利尿活性进行了初步研究,为进一步阐明其利尿活性部位和化学成分提供实验基础。
1 材料与方法
1.1 实验动物
雄性SD大鼠,体质量180~200 g,购自第四军医大学实验动物中心,动物许可证号:SYXK 2010-004。实验前1周在实验室饲养。
1.2 实验仪器和层析材料
衡新ACS系列电子天平,中山市衡新电子有限公司;旋转蒸发仪(DE52CS),上海亚荣生化仪器厂;恒温水浴锅(B-220),海亚荣生化仪器厂;循环水式多用真空泵SHB-Ⅲ,郑州长城科工贸有限公司;低温冷却液循环泵DLSB-5/10,郑州长城科工贸有限公司;大小鼠代谢笼ZH-B6,淮北正华生物仪器有限公司;IR100 Spectrometer红外光谱仪,Thermo公司;DRX-500超导核磁共振仪,瑞士Bruker公司。
柱层析材料为青岛海洋化工厂生产的100~200,200~300,300~400目硅胶;薄层层析材料为青岛海洋化工厂生产的硅胶G和GF254型硅胶;Sephadex LH-20为Pharmacia公司产品。呋塞米(furosemide,规格:每片20 mg,批号:010730)购自江苏林海药业有限公司。
1.3 茯苓和茯苓皮提取物的制备
茯苓和茯苓皮药材均购自陕西药材采购供应站,产地安徽,经西北大学王亚洲教授鉴定为多孔菌科卧孔属真菌P.cocos的菌核及其菌核外皮,茯苓(编号:F120301)和茯苓皮(编号:F120302)药材标本存放在西北大学生命科学学院。
茯苓皮1.5 kg,加3倍体积95%乙醇超声波提取30 m in,取滤液,药渣加95%乙醇重复提取2次,合并3次滤液,于60℃恒温水浴蒸干,得茯苓皮乙醇提取物279 g,提取率为18.6%,冰箱保存备用。茯苓皮2.5 kg,加3倍体积水煎煮3次,第一次1 h,后两次各30 m in,合并滤液,旋转蒸发浓缩至干,得茯苓皮水提取物75.7 g,提取率为3.03%,冷藏备用。茯苓乙醇提取物和水提取物制备方法同茯苓皮。茯苓乙醇提取物得率为2.5%,茯苓水提取物得率为1.8%。
1.4 动物分组和给药
取SD大鼠112只,随机分为14组,每组8只。一组为正常对照组,一组为阳性呋塞米对照组。实验前禁食不禁水12 h。每组按50 m L·kg-1生理盐水灌胃,造成大鼠体内水钠潴留。30 m in后,正常对照组按10 m g·kg-1的自来水灌胃,阳性对照组给予20 m g·kg-1的呋塞米溶液,其他12组,分别给予茯苓水提取物50,100和200 mg·kg-1(分别相当于生药量2.5,5和10 g·kg-1),茯苓乙醇提取物62.5,125和250 mg·kg-1(分别相当于生药量2.5,5和10 g·kg-1),茯苓皮水提取物75,150和300 mg·kg-1(分别相当于生药量2.5,5和10 g·kg-1)以及茯苓皮乙醇提取物150,300和600 mg·kg-1(分别相当于生药量0.85,1.7和3.4 g·kg-1)。给药后,立即将大鼠放入代谢笼中,每笼1只,在代谢笼下面放置带刻度的试管,每小时记录尿液1次,连续收集6 h。测定尿液的pH值以及Na+,K+和Cl-的含量。
1.5 茯苓皮乙醇提取物化学成分的分离和鉴定
应用色谱分离法分离茯苓皮的化学成分、波谱分析技术鉴定化学成分的结构。取茯苓皮乙醇提取物150 g,将其悬浮于水中依次用石油醚、乙酸乙酯和正丁醇萃取,得石油醚萃取物12.24 g,乙酸乙酯萃取物105.98 g,正丁醇萃取物11.48 g。取乙酸乙酯萃取物50 g,将其溶于甲醇,按样品∶硅胶=1∶2的比列伴样,挥干甲醇后上至硅胶柱(3 kg),以氯仿∶丙酮(9∶1)展开,按其色带分为Fr.1~Fr.7组分。组分Fr.1经反复硅胶常压柱层析、减压柱层析和、中压柱层析、RP-18反相柱层析和Sephadex LH-20凝胶层析等,得到化合物1(28.5 mg)和化合物2(31.4 mg);用同样的方法从Fr.2分离得到化合物3(50.5 mg)和化合物4(13.5 g);从Fr.3分离得到化合物5(20.9 m g);Fr.4分离得到6(26.5 m g);Fr.6分离得到化合物7(35.9 mg)。随后用NMR等技术对分离的化合物进行结构鉴定。
1.6 统计学分析
2 结果
2.1 茯苓和茯苓皮提取物对大鼠尿量的影响
在给药后6 h内,茯苓水提取物各组大鼠尿量与水对照组相比无明显变化(图1A)。茯苓乙醇提取物250 mg·kg-1组在给药后第5和第6小时才开始出现利尿作用,尿量比正常对照明显增加(P<0.05,P<0.01),50和100 mg·kg-1组无明显变化(图1B)。
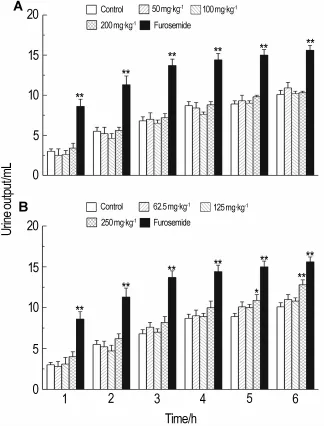
Fig.1 Diuretic activities of aqueous extract(A)and ethanol extract(B)o f P.cocos in rats.The aqueous extract,ethanol extract and furosemide(20 mg·kg-1)were ig administered to rats.The volume of excreted urine was measured at 1,2,3,4,5 and 6 h after drug administration.,n=8.*P<0.05,**P<0.01,compared with control group at the same time.
茯苓皮水提取物75和300 m g·kg-1组利尿作用出现在给药后第5和第6小时(P<0.05),尿量与对照组相比分别增加21%和14%(图2A)。乙醇提取物150,300和600 mg·kg-1组尿量增加非常显著(P<0.01),分别增加29%,21%和42%,其利尿作用分布均匀,在1~6 h内均有较好的作用(图2B)。呋塞米的利尿作用非常明显(P<0.01)。
2.2 茯苓和茯苓皮提取物对尿液电解质和pH值的影响
由表1可见,茯苓能够增加尿液Na+和Cl-排出,减少K+排泄,使尿液Na+/K+比值升高。水提物50 mg·kg-1组K+排泄减少显著(P<0.01),Na+/K+比值明显升高(P<0.05);100 m g·kg-1组Na+排出明显增加(P<0.05)。乙醇提取物125 m g·kg-1组Na+排泄显著增加(P<0.05);其他各组无明显变化。茯苓水提取物和乙醇提取物对尿液pH值无明显影响。
茯苓皮水提物和乙醇提取物对尿液电解质的影响差异较大。水提物对Na+,C l-和K+排出无影响;而乙醇提取物600 m g·kg-1增加Na+排泄(14%)(P<0.05),各组均能显著减少K+和Cl-排出(P<0.01),量效关系明显。水提取物150 m g·kg-1和乙醇提取物各组尿液Na+/K+比值显著升高(P<0.05,P<0.01)。茯苓皮可以升高尿液的 pH值,乙醇提取物各组及水提取物300 mg·kg-1组增加明显。呋塞米增加Na+和Cl-排出(P<0.01),升高Na+/K+值(P<0.01),对尿液pH值无明显影响。
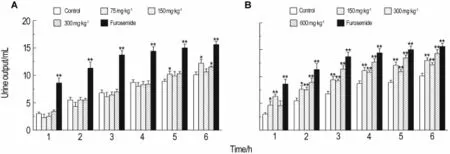
Fig.2 Diuretic activities of aqueous extract(A)and ethanol extract(B)of Cortex Poriae in rats.See Fig.1 for the rat treatment.,n=8.*P<0.05,**P<0.01,compared with control group at the same time.
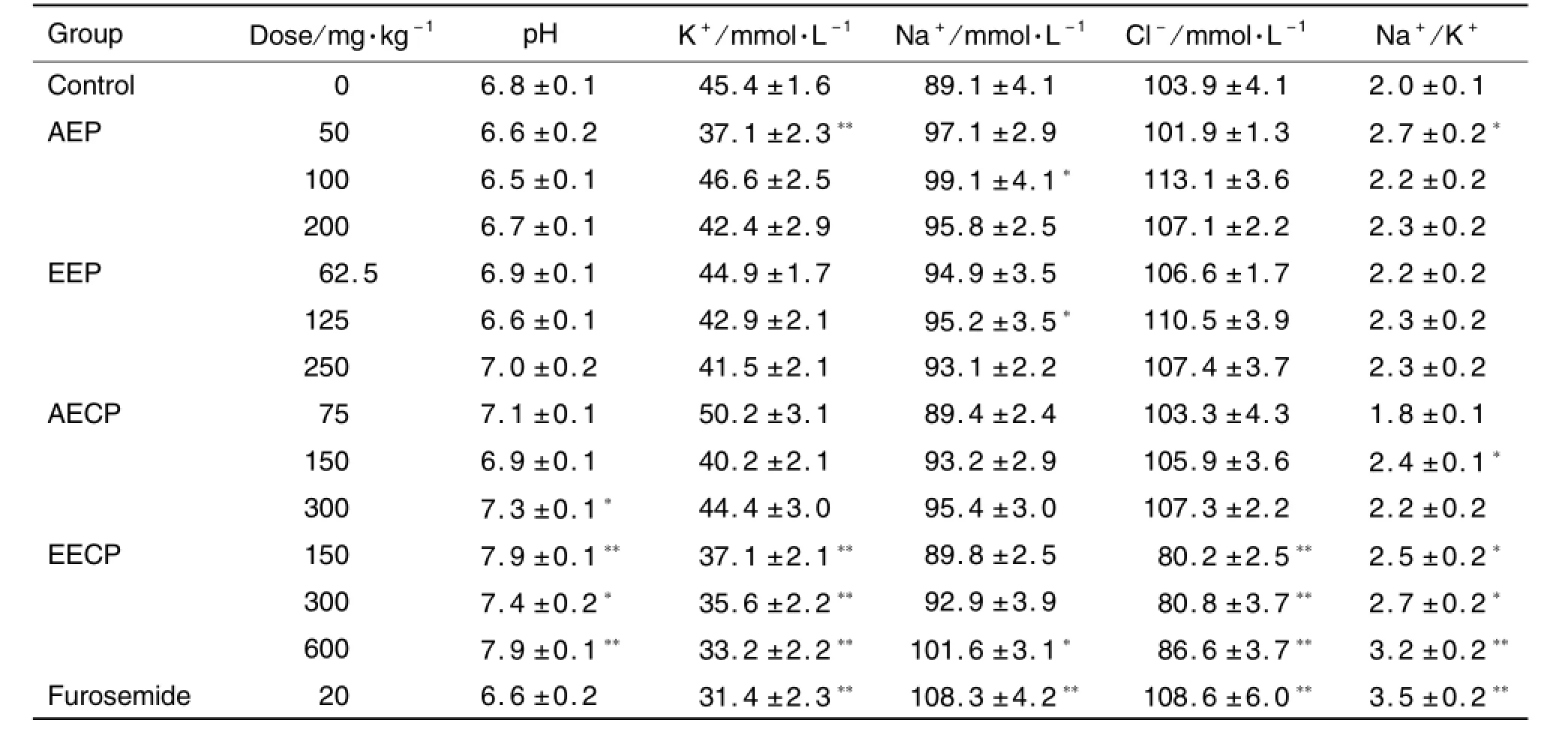
Tab.1 Effect of extracts of P.cocos and Cortex Poriae on urinary electrolyte excretion
2.3 茯苓皮乙醇提取物化学成分的结构鉴定
利用NMR等对分离的化合物进行结构表征,化合物1~7分别为:茯苓酸、猪苓酸C、去氢土莫酸、3-表去氢土莫酸、去氢齿孔酸、齿孔酸和去氢齿孔酮酸。
化合物1:白色针晶。1H-NMR:δ0.71(3H,s,H-18),0.83(3H,s,H-28),0.85(3H,s,H-29),0.92(3H,s,H-19),0.94,0.95(ea.3H,d,J=6.4 Hz,H-26 and H-27),1.06(3H,s,H-30),1.97(3H,s,CH3CO),2.20(1H,m,H-25),1.77(1H,dd,J=11.0,5.5 Hz,H-17),2.35(1H,m,H-20),3.99(1H,t,J=6.4 Hz,H-16),4.40(1H,m,H-3),4.68(1H,s,H-31),4.72(1H,s,H-31)。以上数据与文献[12]对照,确定为茯苓酸。
化合物2:白色针状结晶。1H-NMR:δ5.62(1H,d,J=7.0 Hz,H-7),5.45(1H,d,J=6.0 Hz,H-11),5.07(1H,s,H-31a),4.88(1H,s,H-31b),4.61(1H,t,J=6.5 Hz,H-16),1.38(3H,s,H-30),1.27(3H,s,H-29),1.17(3H,s,H-19),1.11(6H,s,H-18,H-28),1.07(3H,d,J=6.5 Hz,H-26),1.01(3H,d,J=6.5 Hz,H-27)。以上数据与文献[13]对照,确定为猪苓酸C。
化合物3:白色针状结晶。1H-NMR:δ1.05(3H,s,H-28),1.12(3H,s,H-29),1.15(3H,s,H-19),1.01,1.02(ea.3H,d,J=6.4 Hz,H-26,H-27),1.23(3H,s,H-18),1.52(3H,s,H-30),2.29(1H,m,H-25),2.74(1H,m,H-17),2.93(1H,m,H-20),4.62(1H,t,J=7.2 Hz,H-16),3.52(1H,m,H-3),4.86(1H,s,H-31),4.99(1H,s,H-31),5.42(1H,br.s,J=5.7 Hz,H-11),5.67(1H,br.s,H-7)。以上数据与文献[12]对照,确定为去氢土莫酸。
化合物4:白色针状结晶。1H-NMR:δ1.21(3H,s,H-28),1.01(3H,s,H-29),1.11(3H,s,H-19),1.01,1.03(ea.3H,d,J=6.5 Hz,H-26,H-27),1.09(3H,s,H-18),1.44(3H,s,H-30),2.32(1H,m,H-25),2.91(1H,m,H-17),2.97(1H,m,H-20),4.50(1H,t,J=6.8 Hz,H-16),3.65(1H,br.s,H-3),4.85(1H,s,H-31),5.01(1H,s,H-31),5.49(1H,d,J=6.0 Hz,H-11),5.66(1H,br.s,H-7)。以上数据与文献[12]对照,确定为3-表去氢土莫酸。
化合物5:白色针状结晶。1H-NMR:δ1.05(3H,s,H-18),1.06,1.07(ea.3H,d,J=7 Hz,H-26,H-27),1.08,1.09(ea.3H,s,H-19, H-30),1.16(3H,s,H-29),1.25(3H,s,H-28),2.33(1H,m,H-25),2.69(1H,m,H-20),3.47(1H,t,J=8 Hz,H-3),4.94(2H,s,H-31),5.40(1H,d,J=6 Hz,H-11),5.63(1H,d,J=5 Hz,H-7)。以上数据与文献[14]对照,确定为去氢齿孔酸。
化合物6:白色粉末。1H-NMR:δ3.48(1H,t,H-3),1.66(1H,m,H-5),2.35,2.70(2H,m,H-12),1.95,2.38(2H,m,H-15),1.09(3H,s,H-18),1.12(3H,s,H-19),1.06(3H,dd,J=5.5 Hz,H-26),1.03(3H,dd,J=5.5 Hz,H-27),1.23(3H,s,H-28),1.25(3H,s,H-29),1.27(3H,s,H-30),4.97,4.84(2H,s,H-31)。以上数据与文献[14]对照,确定为齿孔酸。
化合物7:白色针状结晶。1H-NMR:δ0.92(3H,s,H-28),1.02(3H,s,H-29),1.04(3H,s,H-19),1.01,1.03(ea.3H,d,H-26,H-27),1.08(3H,s,H-30),2.07(3H,s,H-COCH3),2.32(1H,m,H-25),2.93(1H,dd,H-17),2.96(1H,m,H-20),4.58(1H,t,H-16),4.68(1H,dd,H-3),4.89,5.02(ea.2H,H-31),5.36(1H,d,H-11),5.63(1H,d,H-7)。以上数据与文献[13]对照,确定为去氢齿孔酮酸。
3 讨论
茯苓和茯苓皮是我国传统中药,可以与多种药物配伍(如五苓散、猪苓汤、真武汤和五皮饮等),被广泛用于治疗各种水肿症。
本研究采用称重法和代谢笼法[15]观察茯苓和茯苓皮口服一次给药后对生理盐水负荷大鼠6 h内尿量的影响。研究结果表明,茯苓皮乙醇提取物的利尿作用显著,茯苓水提取物无利尿作用,茯苓乙醇提取物和茯苓皮水提取物的作用微弱,给药后第5小时才开始有作用。呋塞米为髓袢利尿药,通过抑制髓袢升支粗段Na+-K+-2Cl-共同转运体,从而影响尿液的稀释和浓缩,产生快速强大的利尿作用,并且利尿的同时扩张全身小动脉,降低外周阻力,增加肾血流量而不降低肾小球滤过率,是目前作用最强的利尿药。而茯苓皮乙醇提取物的利尿作用缓和持久,分布在1~6 h。
茯苓皮乙醇提取物在利尿的同时能够增加电解质Na+的排出,减少K+的排出,使尿液中Na+/K+比值升高,表明茯苓皮乙醇提取物是排Na+利尿,其机制可能是抑制了肾远曲小管和集合管Na+-K+交换,产生了类似于低效利尿药螺内酯的保钾排钠作用。本研究对茯苓皮乙醇提取物的化学成分进行分离和结构鉴定,结果表明,茯苓皮乙醇提取物主要含有茯苓酸、猪苓酸C、去氢土莫酸、3-表去氢土莫酸、去氢齿孔酸、齿孔酸和去氢齿孔酮酸等四环三萜类化合物。这些化合物的结构与醛固酮的化学结构相似。醛固酮是由肾上腺皮质球状带细胞合成和分泌的一种盐皮质素。主要作用于肾远曲小管和肾皮质集合管,增加对Na+的重吸收和促进K+的排泄,也作用于髓质集合管,促进H+的排泄,酸化尿液。茯苓皮乙醇提取物可能通过拮抗醛固酮而发挥利尿作用。此外,茯苓素(poriatin,一组多组分的四环三萜类化合物)具有和醛固酮相似的化学结构,其不仅体外能够结合到肾细胞膜醛固酮受体上,而且在大鼠体内也具有拮抗醛固酮活性,茯苓素不但可以提高尿中Na+/K+比值,并且具有量效关系,因此茯苓素是一组潜在性醛固酮受体拮抗剂[16]。所以推测,茯苓皮的利尿作用可能是由于其所含的四环三萜类化学成分抑制了肾小管对Na+的重吸收和K+的排泄。
至于茯苓乙醇提取物的利尿作用弱于茯苓皮的原因尚不清楚。文献报道,四环三萜类化合物是茯苓的主要化学成分[5-7,17-18]。《中华人民共和国药典》规定茯苓和茯苓皮的醇提取率分别为不低于2.5%和6.0%,茯苓皮醇提物的含量是茯苓醇提取物的2.4倍。文献也报道,茯苓皮中四环三萜去氢土莫酸、猪苓酸C、3-表去氢土莫酸、去氢齿孔酮酸和茯苓酸的含量分别是茯苓中含量的6.48,11.43,3.19,3.00和2.95倍[19]。从这个结果可知,茯苓皮中四环三萜类化合物的含量远高于茯苓。这与茯苓皮的利尿作用强于茯苓的结果一致。并且从另一个角度提示,茯苓皮利尿作用的活性成分可能为其中所含有的四环三萜类化合物。
本研究初步观察了茯苓和茯苓皮的利尿活性。本课题组将进一步采用不同极性的有机溶剂对茯苓和茯苓皮乙醇提取物萃取,比较不同部位的利尿活性,确定茯苓和茯苓皮活性部位。期望在活性的导向下明确茯苓和茯苓皮利尿和治疗慢性肾病的活性部位及其活性成分,阐明茯苓和茯苓皮利尿和治疗慢性肾病的药效物质基础及其作用机制,并为茯苓和茯苓皮的含量测定等相关质量标准的制定提供参考依据。
[1] Hu B,Yang YP,Ye Y.Chem ical constituents from Poria cocos[J].Chin Tradit Herb Drugs(中草药),2006,37(5):655-658.
[2] Feng YL,Zhao YY,Ding F,Xi ZH,Tian T,Zhou F,etal.Chemical constituents of surface layer of Poria cocos and their pharmacological properties(Ⅰ).China J Chin Mater Med(中国中药杂志),2013,38(7):1098-1102.
[3] Ke RD,Lin SF,Chen Y,Ji CR,Shu QG.Analysis of chemical composition of polysaccharides from Poria cocos Wolf and its anti-tumor activity by NMR spectroscopy[J].Carbohyd Polym,2010,80(25):31-34.
[4] Wang Y,Zhang M,Ruan D,Shashkov AS,Kilcoyne M,Savage AV,et al.Chemical components and molecular mass of six polysaccharides isolated from the sclerotium of Poria cocos[J].Carbohydr Res,2004,339(2):327-334.
[5] Tai T,Akahori A,Shingu T.Triterpenes of Poria cocos[J].Phytochemistry,1993,32(5):1239-1244.
[6] Akihisa T,Nakamura Y,Tokuda H,Uchiyama E,Suzuki T,Kimura Y,et al.Triterpene acids from Poria cocos and their anti-tumor-promoting effects[J].JNat Prod,2007,70(6):948-953.
[7] Zheng Y,Yang XW.Two new lanostane triterpenoids from Poria cocos[J].J Asian Nat Prod Res,2008,10(3-4):323-328.
[8] Tai T,Shingu T,Kikuchi T,Tezuka Y,Akahoria A.Triterpenes from the surface layer of Poria cocos[J].Phytochemistry,1995,39(5):1165-1169.
[9] Sam path S,Moran JL,Graham PL,Rockliff S,Bersten AD,Abrams KR.The efficacy of loop diuretics in acute renal failure:assessment using Bayesian evidence synthesis techniques[J].Crit Ca re Med,2007,35(11):2516-2524.
[10] Eshaghian S,Horw ich TB,Fonarow GC.Relation of loop diuretic dose to mortality in advanced hea rt failure[J].Am J Cardiol,2006,97(12):1759-1764.
[11] DomanskiM,Tian X,Haigney M,Pitt B.Diuretic use,progressive heart failure,and death in patients in the DIG study[J].J Card Fail,2006,12(5):327-332.
[12] Wang S,Jiang YY,Zhu NL,Liu Y,ShiRB,Yang XW,et al.Determination and isolation of the chemical constituents of Poria Cocos[J].J Beijing Univ Tradit Chin Med(北京中医药大学学报),2010,33(12):841-844.
[13] Yang PF,Wang ZZ,W ang HQ,Li JC,Chen RY.Studies on chemical constituents of Guizhi FulingCapsule(Ⅲ)[J].Chin Tradit Herb Drugs(中草药),2012,43(3):463-466.
[14] W u X,Yang JS,Dong YS.Chemical constituents of Fomes officinalis(Ⅰ)[J].Chin Tradit Herb Drugs(中草药),2005,36(6):811-814.
[15] Chen Q.Purgatives,damp-clearing drug[M]∥Wang JH,Yang SN,Li LD.Methodology in Pharmacological Study on Chinese Materia Medica(中药药理研究方法学).2nd ed.Beijing:People′s Medical Publishing House,2006:324-331,379-383.
[16] Deng GM,Xu J.Poriatin:a potential aldosterone antagonist[J].Chin J Antibiot(中国抗生素杂志),1992,17(1):34-37.
[17] Wang YZ,Zhang J,Zhao YL,Li T,Shen T,Li JQ,et al.Mycology,cultivation,traditional uses,phytochemistry and pharmacology of Wolfiporia cocos(Schwein.)Ryvarden et Gilb.:a review[J].J Ethnopharmacol,2013,147(2):265-276.
[18] Ríos JL.Chemical constituents and pharmacological properties of Poria cocos[J].Planta Med,2011,77(7):681-691.
[19] Che S,LiQ,Huo YS,Chen XH,BiKS.RP-HPLC simultaneous determination of five triterpenoid acids in different parts of Poria cocos by UV wavelengths switch[J].Acta Pharm Sin(药学学报),2010,45(4):494-497.
Diuretic activity of aqueous and ethanol extracts from Poria cocos and Cortex Poriae and active component identification
TIAN Ting,CHEN Hua,YIN Lu,CHEN Dan-qian,FENG Ya-long,ZHAO Ying-yong
(Ministry of Education Key Laboratory of Resource Biology and Biotechnology in Western China,College of Life Sciences,Northwest University,Xi′an 710069,China)
OBJECTlVE:To evaluate the main chemical components in active fractions and diuretic activities of Poria cocos and Cortex Poriae in saline-loaded rats through chemical component extraction and separation.METHODSThe extracts were orally administered to rats at different doses.Urinary volume,pH and electrolyte excretion were measured in the urine of saline-loaded rats in 6 h.The chemical components were isolated from the active fractions and their structures were identified using different chromatographic and spectroscopic techniques.RESULTSThe urine output of the ethanol extract of Cortex Poriae 150,300 and 600 m g·kg-1groups was increased by 29%,21%and 42%respective ly(P<0.01),which had a remarkable effect on K+retention(18%,22%and 27%respectively,P<0.01),but induced notable excretion of Na+.Each Na+/K+ratio was also enhanced by the ethanol extract of Cortex Poriae.The aqueous extracts of P.cocos(50,100 and 200 mg·kg-1)and Cortex Poriae(75,150 and 300 mg·kg-1)as well as the ethanol extract of P.cocos(62.5,125 and 250 mg·kg-1)showed no diuretic activity.The separation experiment results showed that tetracyclic triterpenoid components,such as pachymic acid,polyporenic acid C,dehydroeburicoic acid,3-epidehydrotumulosic acid,dehydrotumulosic acid,eburicoic acid and dehydroeburiconic acid were the main components of the ethanol extract of Cortex Poriae.CONCLUSlONThe ethanol extract of Cortex Poriae displays remarkable diuretic activity and its main components are the tetracyclic triterpenoid compounds.
Poria cocos;Cortex Poriae;tetracyclic triterpenoid diuresis;electrolyte
ZHAO Ying-yong,E-mail:zyy@nwu.edu.cn,Tel:(029)88304569
R983,R284.1
A
1000-3002(2014)01-0057-06
Foundation item:The project supported by National Natural Science Foundation of China(81001622);Changjiang Scholars and Innovative Research Team in Universities(IRT1174);Program for New Century Excellent Talents in Universities(NCET-13-0954);and National Innovation Training Plan Program(201310697004)
2013-07-18 接受日期:2013-12-20)
(本文编辑:齐春会)
国家自然科学基金项目(81001622);长江学者和创新团队发展计划资助(IRT1174);教育部“新世纪优秀人才支持计划”项目(NCET-13-0954);国家创新训练计划项目(20130697004)
田 婷(1990-),女,硕士研究生,主要从事中药药理学和代谢组学研究。
通迅作者:赵英永,E-mail:zyy@nwu.edu.cn,Tel:(029)88304569
