基于质谱技术的蛋白质组学方法应用于2000年前食物残留的分析
2014-03-22王芳,杨帆
王 芳,杨 帆
(1. 中国科学技术大学 科技考古实验室, 合肥 230026; 2. 云南省文物考古研究所, 昆明 650000)
2008年Caroline Solazzo等人在Anal. Chem.杂志发表论文,报告了一项有关考古出土的蛋白质残留样品分析工作。他们从阿拉斯加最北端,临近北冰洋著名的巴罗角(Point Barrow)出土约700到900年前的陶器碎片上的粘土状附着物中成功提取古蛋白,并对其进行质谱分析测定,得到该蛋白来源于灰海狮的明确结果。这是第一次成功地运用生物质谱技术和蛋白组学方法在较古老的考古样品中提取到残留蛋白,并通过序列分析明确鉴定出其蛋白质来源的一项出色研究[1]。该项成果对于了解古代巴罗角居民的食物结构和来源提供了重要科学依据。
考古样品中蛋白质成分能否完好保存到今天,取决于环境和时间两个因素,环境越潮湿温热,微生物的活跃程度就越高,对蛋白质肽段的修饰越大;而样品的年代越久远,蛋白质的降解程度也越强。巴罗角地区的极寒天气对于微生物环境条件的抑制作用使得对该样品研究的成功可能性大为增加;同时,年代愈是久远的考古样品,发生降解或者修饰等变化的可能性越大。
对于中国考古学实际而言,中国的地理位置大部分处于温带大陆性气候,这使得与前面所介绍的研究相比,微生物的活动更为频繁,对蛋白质分子的修饰和降解作用也更加剧烈,又由于中国出土的考古样品很多都有更长的历史时间背景,时间上远远久于上述文章中的样品。所以,针对中国的情况,在环境和时间上对蛋白质分子的保存状态更为不利。
在本研究中,我们以2010年3月云南个旧黑马井遗址出土青铜容器内两份不同保存状态的样品为研究对象,拟应用生物质谱技术并结合蛋白质组学分析方法,对古代食物残留物样品进行研究。
个旧黑玛井遗址是一处十分重要的考古遗址[2],通过对其出土材料研究显示该遗址的年代约为西汉末期。我们想通过本次研究来探索更早的加工过的食物残留样品有没有保存留有蛋白信息,蛋白组学的研究方法能否对更古老的样品发挥作用。并且该样品的形态也与Caroline Solazzo等人研究的样品形态不尽相同,他们的样品是陶器碎片上附着的粘土状食物残留,本研究的样品是青铜器内完整的块状膏状物以及颗粒状物,我们也期待探讨考古残留物样品的形态对蛋白组学方法的适用性。除了样品的年代和状态的不同, 样品的保存条件也不同, Caroline等人的样品来自极寒的阿拉斯加地区, 这无疑更有利于样品中蛋白质的保存, 而本次实验的样品只是来源于普通环境条件下的地下埋藏。所以, 本实验拟通过此次研究获得蛋白质组学方法对考古样品研究的进一步探索和完善。我们使用的方法是首先从古代残留物中用生物化学方法将蛋白质提取出来,并利用胰蛋白酶进行限制性降解,再通过质谱的方法获得一系列蛋白质肽段,最后通过和已有的各种不同物种的蛋白质数据库进行序列对比,推断出这些蛋白质是来自哪个物种。该方法具有灵敏度极高,以及重复性好的特点,但同时也对样品的要求较高,即样品中所含的蛋白质不能被完全降解[3]。
1 样品分析
1.1 样品描述
本次实验的材料来自于由云南省考古研究所2010年3月15日对个旧黑马井墓地进行第3次正式发掘所获得的2个样品。样品一为一个青铜三羊盒(M29)中的膏状疑似食物残渣(图1),以下简称膏状样品;样品二为铜簋(M43:4)内采集的颗粒状疑似食物残渣(图2),以下简称颗粒状样品。本次所检测的两个样品根据其所存放的位置及其形态来判断极有可能是食物残渣,结合国际上已研究成功的案例,我们同样采取提取蛋白质并利用质谱分析的方法来鉴定是何种材料制作成的食物残留。运用相同的蛋白质组学方法对两种保存状态不同的样品进行研究的主要目的是为了获得对比数据,以期更好地证明运用蛋白质组学方法进行考古残留物分析的可行性。

图1 样品一的正面照(左)和背面照(右)

图2 样品二的照片
1.2 实验试剂、仪器和实验方法
1.2.1 实验试剂、仪器
实验仪器:液相色谱-质谱联用仪(厂家:Thermo Fisher, 美国,型号:LTQ), 微量天平(厂家:梅特勒-托利多,中国,型号:XP21),细胞超声破碎仪(厂家:宁波新芝,中国,型号:JY99-IIDN),电泳装置(厂家:Bio-Rad,美国, 型号:mini-protean system),冷冻高速离心机 (厂家:Epeendorf,美国,型号:5430R),以及pH计(厂家:梅特勒-托利多,中国,型号:FE20)。实验试剂见表1。

表1 实验试剂
1.2.2 实验方法
1.2.2.1 预处理样品、提取蛋白并优化
称取250 mg残留物样品, 并用液氮快速将样品研磨成粉末状,然后将粉末状样品放置入1.5 mL的Eppendorf管中。在样品中加入500 μL细胞裂解液,并放置于冰上30 min,然后对样品进行超声处理,以促进样品中蛋白质的溶解。最后,以13200 r/min,4 ℃离心20 min,以去除样品溶液中的不溶物。上步离心后发现仍有很多不溶物悬浮在溶液中,用200目的滤网过滤样品中的不溶物;再次以13200 r/min, 4 ℃离心20 min。并保留上清液;将提取获得的上清液中加入5倍于上清液体积的蛋白质沉淀溶液, 并将其置于-20 ℃,冷冻过夜;将处理后的样品13200 r/min, 4 ℃离心20 min,并取沉淀(如果样品中含有蛋白质,将处于此沉淀中);用蛋白质沉淀溶液洗涤蛋白质沉淀2次;将处理过的样品于室温下敞口放置,直至其中所含的有机溶剂完全挥发;加入20 μL PBS缓冲液溶解蛋白沉淀;最后,加入5 μL 5×蛋白加样液,并在95 ℃下处理5 min。
1.2.2.2 蛋白质分离及染色
用12% SDS-PAGE分离上述样品中的蛋白质;在室温下用考马斯亮蓝染色液对蛋白胶进行染色2 h;最后在室温下用考马斯亮蓝脱色液对染色的蛋白胶脱色,直至获得凝胶上蓝色的条带及干净的背景[4]。
1.2.2.3 质谱分析前样品的预处理
将上述染色后的蛋白质条带进行切割至1 mm3大小,用50 mM NH4HCO3溶液洗2次;用100 μL新鲜配制的10 mM DTT/50 mM NH4HCO3溶液处理胶块(50 ℃,15 min);用100 μL新鲜配制的30 mM碘代乙酰胺/50 mM NH4HCO3溶液处理胶块(室温,避光15 min);用50 mM NH4HCO3溶液洗涤胶块2次;用200 μL30%已腈/50 mM NH4HCO3溶液处理胶块(室温,10 min),并重复这一步骤直至染色的胶块得以全部脱色;分别用200 μL 50%已腈/50 mM NH4HCO3溶液和100%已腈溶液洗涤胶块,并移除液体;用真空干燥仪对胶块进行干燥,并加入50 μL的胰蛋白酶溶液进行消化(37℃,过夜消化),保留此步的上清液;对上一步胰酶处理后的胶块进一步用200 μL 60%已腈/5%三氟乙酸溶液处理,并进行水浴超声1 min,吸取此步的上清液,并和前一步得到的上清液合并;用真空干燥仪对合并后的溶液进行干燥;最后用25 μL 0.1% 甲酸溶液溶解干燥后的沉淀,以进行液相色谱-质谱分析。

表2 液相色谱分离条件
1.2.2.4 液相色谱分离条件
我们所使用的液相色谱的型号为SURVEYOR;色谱柱种类为C18反相柱;梯度时间为175 min;梯度条件如下(A为0.1%甲酸水溶液,B为100%已腈)。分流后NSI流速为800~1000nL/min。
1.2.2.5 质谱分析条件
质谱分析的检测模式为正离子模式;扫描范围为300~2000 m/z;碰撞能量为35.0。
1.2.2.6 数据处理方法
质谱分析得到的数据通过Bioworks软件(SEQUEST 3.2)进行分析,搜索的NCBI数据库包括不同的种属来源,如人源(Homo Sampiens)、鸡源(Gallus gallus)、野猪源(Sus scrofa)以及绵羊源(Ovis aries)。
2 结果及分析
2.1 膏状样品的实验结果及分析
蛋白提取结果:通过上述提取的蛋白质样品,经过SDS凝胶电泳分离,以及考马斯亮蓝染色后,获得的图片如下(图3)。

图3 样品一提取的蛋白质电泳后的图片
左边的一竖排泳道内是标准分子量蛋白,分子条带从下往上依次分子量为:15kD、25kD、35kD、45kD、66kD、116kD,而参照标准分子量蛋白可以看到:一条带在约47kD左右的位置,一条带在约116kD的位置。
质谱检测结果:将所检测到的蛋白条带从蛋白胶上切割下来并进行质谱分析之后,发现蛋白质被胰蛋白酶限制性降解形成比较好的蛋白质肽段峰图(图4),横坐标显示的是蛋白质肽段在色谱柱中上样后的洗脱时间,纵坐标显示的是质谱检测器检测的相对离子信号强度,此数值越大,表明含有的蛋白质肽段的丰度越高。通常认为洗脱时间为0~40 min内得到的样品峰图中包含了非特异性峰,另外,洗脱时间为140 min之后所得到的样品峰图也存在一些非特异性峰,因此,为了排除非特异性峰的影响,通常通过洗脱时间在40~140 min之间得到的样品峰作为样品质量好坏的重要指标[5]。从得到的蛋白质肽段峰图来看, 不论是从纵坐标的离子信号强度,还是横坐标的蛋白质肽段分布的连续性,都进一步验证了考马斯亮蓝染色结果:即此膏状食物残渣中确实含有大量的蛋白质。另外,我们需要指出的是,从此图也可以看出残留物中含有的蛋白质并没有被完全酶解,这有可能是因为古代残留物的保存时间很长,蛋白形成了聚集或发生了修饰,最终导致样品没有办法被完全胰蛋白酶降解。
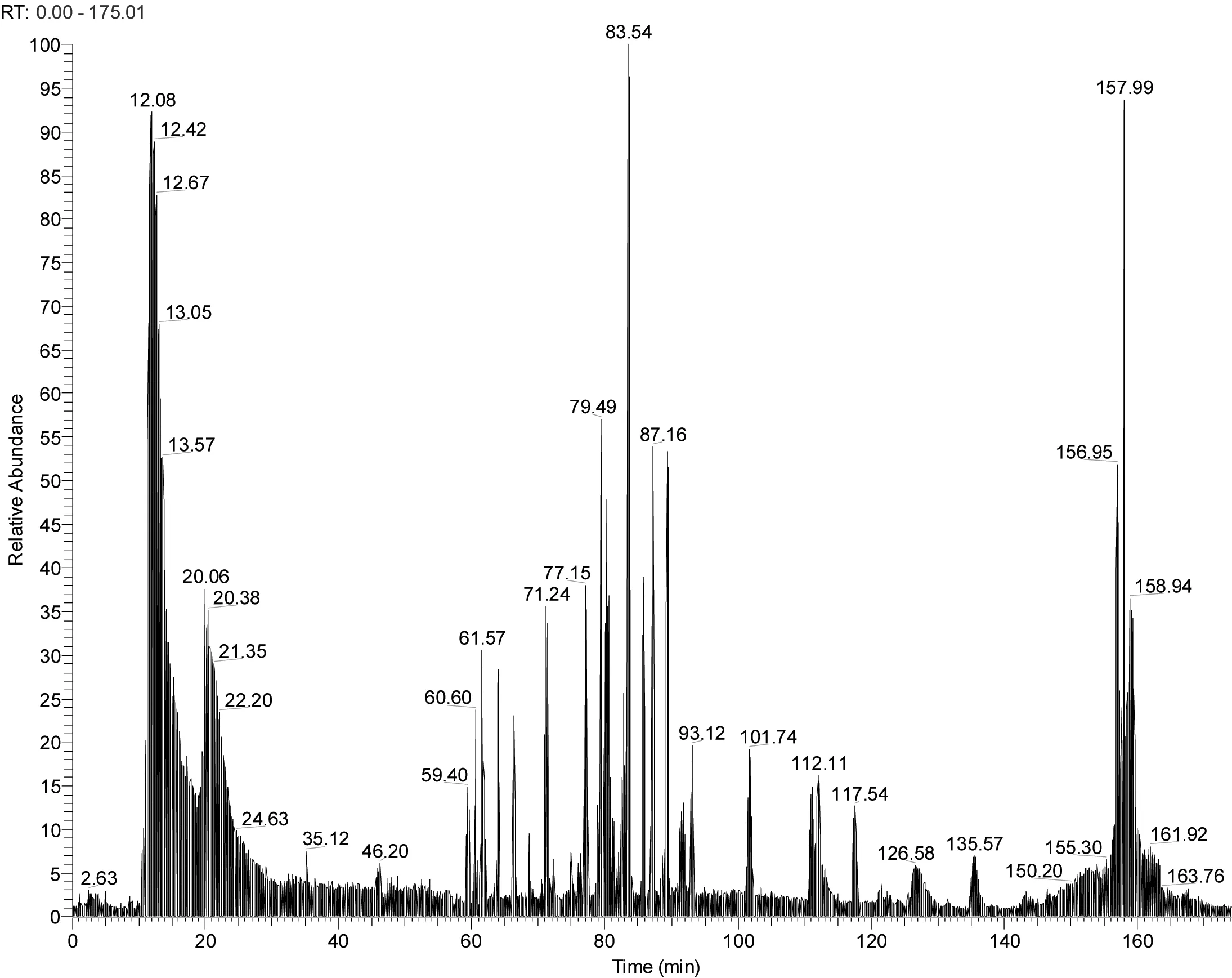
图4 提取的蛋白质经过胰蛋白酶降解后经过质谱分析的

蛋白名称质谱检测出的蛋白质肽段Z值XcorrDeltaCNkeratin 1keratin 10keratin 2akeratin 6CH2A histone family proteinK.SKAEAESLYQSK.YR.TLLEGEESR.MR.NKYEDEINKR.TR.FLEQQNQVLQTK.WK.YEELQITAGR.HK.IEISELNR.VR.TNAENEFVTIK.KK.SLNNQFASFIDK.VR.SLDLDSIIAEVK.AR.THNLEPYFESFINNLR.RR.SLLEGEGSSGGGGR.GR.ALEESNYELEGK.IR.SQYEQLAEQNRK.DR.LKYENEVALR.QR.LASYLDKVR.AR.VLDELTLTK.AK.IRLENEIQTYR.SK.GSLGGGFSSGGFSGGSFSR.GR.NVQALEIELQSQLALK.QK.TIDDLKNQILNLTTDNANILLQIDNAR.LR.FLEQQNQVLQTK.WK.IEISELNR.VR.TAAENDFVTLKK.DK.VDLLNQEIEFLK.VR.NLDLDSIIAEVK.AR.NKYEDEINKR.TR.FLEQQNKVLETK.WR.NLDLDSIIAEVK.AR.AGLQFPVGR.VR.VTIAQGGVLPNIQAVLLPK.K2222222222222222222322222222224.012.782.744.133.652.622.893.884.272.843.334.193.923.242.512.943.525.053.684.794.132.622.783.624.362.743.674.362.793.490.520.200.370.110.270.200.340.40.410.440.470.580.510.280.120.460.410.650.550.500.110.200.310.530.470.370.110.470.390.4
以上经过质谱分析所检测到的蛋白质肽段进一步和美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)所拥有的所有已有的不同种属蛋白质库进行比对(Blast),仅在人、鸡、野猪、以及绵羊的蛋白数据库中搜索到少量蛋白质,所得到的结果列表如下(表3~表6)。

表4 通过质谱检测得到的疑似鸡源蛋白的肽段以及对应的蛋白名称

表5 通过质谱检测得到的野猪源蛋白的肽段以及对应的蛋白名称

表6 通过质谱检测得到的疑似绵羊源蛋白的肽段以及对应的蛋白名称
对于所得到的这一结果,我们进行了进一步的分析,具体如下:
得到的可能的人源蛋白质共有5种,分别为角蛋白家族蛋白Keratin 1、Keratin 10、Keratin 2a、Keratin 6C以及组蛋白家族蛋白H2A。通过质谱获得的对应每种蛋白质的肽段都至少超过两个,这说明了我们提取的蛋白质中确实含有这5种蛋白。我们也列出了人源蛋白Keratin 1一种多肽的二级质谱图和对应的氨基酸序列(图5),这也进一步确定了上述结果的准确性。角蛋白和组蛋白虽然在功能上没有任何相关性,但它们具有一个共同点,即它们在细胞内具有极高的丰度,也就是说,在质谱分析的过程中,这些蛋白是最大的潜在污染源。我们这里检测到的Keratin和H2A很大的可能是在考古发掘的过程中引入的污染(如皮肤碎屑),当然也有可能是在蛋白质提取以及质谱检测的过程中引入的污染,但这一过程中的污染的可能性是极小的, 重要的是,我们除了Keratin和H2A之外,并没有检测到其它正常组织中丰度较高的胶原蛋白降解物或任何特异性的人源蛋白质,这表明我们检测的该考古样品并不来源于人源。从这里我们也可以看出,因为污染问题是考古样品分析中的常见问题,而蛋白组学方法的应用可以很明确的排除一些污染干扰的问题。

图5 人源Keratin 1蛋白多肽的二级质谱图和对应的氨基酸序列
通过质谱分析后得到的可能的鸡源蛋白质有两种:DJ1和NT-3 growth factor receptor。其中DJ1在细胞中发挥了多方面的功能,研究表明,它在雄激素受体依赖的转录过程中发挥了重要的作用,另外,它也作为一个伴侣蛋白在氧化应激过程中发挥着功能[6]。NT-3 growth factor receptor,顾名思义,它是神经生长因子NT-3的特异性受体,介导了NT-3在细胞中的信号转导过程。虽然这两种蛋白不属于像Keratin和Histone这一类常见的污染源,但是在我们的质谱检测中,这两种蛋白分别只检测到各自一个独立的肽段,这使得我们不能完全判断该古代残留物是否一定含有鸡源的蛋白质。
另外,通过质谱检测获得的可能的野猪源蛋白质有8种,分别为Kelch domain containing 6、Zinc finger protein 140、Neolin-3 precursor、TATA element modulatory factor 1、SIII p15 subunit、Tyrosine 3-monooxygenase、General transcription factor IIIC 以及Isocitrate dehydrogenase 3。然而,通过质谱分析也只检测到各种不同蛋白质的一个独立肽段,因此没有显著的生物学意义,换而言之,我们仍然无法判断该检测样品中所含的蛋白质是否一定来自于野猪。
通过质谱检测得到的可能的绵羊源蛋白质有6种,这包括:Toll-like receptor 5、RNA directed RNA polymerase L、Diacylglycerol acyltransferase 1、14-3-3 protein zeta、POMP90B precursor以及TNF superfamily member 5-induced protein。和上述两种种属蛋白质一样,质谱分析仅能检测到以上6种不同蛋白质分别对应的一个独立肽段,因此,也无法完全判断我们检测的残留物中的蛋白质是否一定来源于绵羊。
综上所述,从样品一中获得的蛋白质提取物,通过蛋白质染色以及质谱分析,可以看出确实含有大量的多肽峰,也就是说,我们检测的样品中确实含有大量的蛋白质。这表明,当古代残留物存在于合适的外部条件下,它其中的蛋白质完全有可能得以保存;而且,只要古代残留物样品的保存状态好,运用蛋白质组学方法对其进行分析就具有高度可行性。然而,当我们将质谱分析得到的多肽与包含全部已有种属的蛋白质数据库比对时,我们仅得到了少量的蛋白质信息。目前,我们仅仅可以肯定其中含有人源蛋白质,但正如前面分析的,这些人源蛋白质是因为在考古发掘或者后期的样品处理时引入的污染。而其它种属来源的蛋白质虽然也检测到一些,但是只检测到了每一种蛋白相对应的一个独立肽段,这在生物学上无法判断是否来源于这些物种[7]。为了排除样品中的蛋白质来源于细菌,我们也将质谱分析结果与蛋白质数据库进行比对,并没有发现有细菌蛋白的信息。并且,通过聚丙烯酰胺凝胶电泳对所提蛋白进行的检测,蛋白主要集中在两个分子量的条带上(见图3),而如果是细菌蛋白,会呈现出非常杂多的分子量条带,所以基本排除该蛋白来源于细菌的可能。因此,根据所得到的此样品中确实存在大量蛋白质的结果,并综合考虑样品的盛放位置,我们认为该样品极有可能是一份食物残留物。
至于为什么蛋白质染色和质谱分析证明了样品一中确实含有大量的蛋白质,但是通过已有的数据库却无法找出它们相对应的种属,我们推断有以下两种可能性:1)该残留物中的蛋白质源自的种属在目前我们的蛋白质数据库并没有包括进来。2)因为该残留物存在于三羊盒中,有可能该残留物曾经经过长时间的高温烧煮并发生了美拉德反应,也就是糖的羟基和氨基酸的氨基之间发生反应,从而使得蛋白质被修饰[8],而被修饰之后的蛋白质肽段与原始的未修饰的实际肽段相比,其分子量被加大,这种情况下,这个修饰的肽段就无法通过已有的蛋白质数据库比对出来,因此,如果这一类的修饰发生的比例很高的话,就会使得整个蛋白质无法被鉴定。
除了高温处理,外界的特殊环境也有可能导致蛋白质发生特异性的修饰或者聚集,这些蛋白的修饰或聚集虽然一方面使得它们免受外界微生物或蛋白酶的降解,从而得以较为完整的保存下来,但另一方面也使得通过质谱的方法无法鉴定这些蛋白质的种属来源。我们的蛋白质纯化结果暗示此种可能性比较大,因为我们提取的蛋白质经过分离和染色后主要表现为两种分子量大小(116kD和47kD),而其它的分子量的蛋白质都没有被保存下来,这暗示这两种分子量的蛋白质发生了大量的修饰而没有被降解掉。
2.2 颗粒状样品的实验结果及分析
样品二经过蛋白质提取、分离及染色后并没有检测到任何蛋白条带。表明铜簋内采集的颗粒状疑似食物残渣中现在并不存在残留的蛋白质,这有两种可能性:1)这种疑似食物残渣并不是真正的食物残渣,其中根本不含有蛋白质;2)如果它们是真正的食物残渣,那么有可能它们出土时的存在状态使得其含有的蛋白质被彻底地降解了,这也进一步暗示古代蛋白质的保存状态对于其稳定性具有很大的影响(图略)。
3 讨论
近年来,基于质谱技术的蛋白质组学方法已开始运用于考古学的研究,并有一些成功的例子[9-15]。本研究在国内的考古学研究中首次采用从残留物中直接提取蛋白质的方法,对古代残留可见疑似食物残渣成分进行成分分析,并加以鉴定蛋白质种属, 从而判定食物残渣的属性, 结果显示,样品一中存在大量的残留蛋白质,而样品二中没有任何残留蛋白质。这进一步表明,考古样品的形态会对其中的蛋白质的保存产生极为重要的影响。我们的假设是,样品一的蛋白质得以保存是因为残留物的膏状物的存在形式,这可能很大程度上使得膏状物内的蛋白质组分和外界环境相分离,从而形成了一种天然屏障,因此环境中的微生物无法和膏状物内部蛋白接触并对其进行充分降解,这最终使得其含有的蛋白质被较为完好的保存下来。膏状样品中古蛋白的检出,表明在中国的温带环境地区, 年代久远的样品中的蛋白质是完全能够保存下来的。
4 结语
食物残留物出土时的状态,有的样品保存完好,甚至与原来的形态无异,有的则已完全分解尘化,而介于这两种状态之间的出土的样品,就需要我们采取有效的手段来对其进行鉴定。蛋白质质谱方法对这些中间状态样品的检测是极为有效的,它可以通过样品中的蛋白信息来反映原来样品的结构成分。本实验采用蛋白质组学分析结合质谱方法,先从古代残留物中将含有的蛋白质提取出来;再用胰蛋白酶或其它的蛋白酶对提取的蛋白质进行限制性降解,从而形成不同大小的蛋白质肽段;然后通过液/气质联用分离并检测蛋白质肽段;最后通过和已有的不同物种的蛋白质数据库比对,从而推断残留物蛋白质的物种来源。蛋白质组学和质谱技术的联用可以帮助我们判断形态不明的古样品的成分及来源。
本论文在国内的科技考古学研究中首次采用从残留物中直接提取蛋白质的方法,对古代食物残渣成分进行分析,并鉴定蛋白质种属, 从而判定食物残渣的属性,是国内这一领域首开先河的初步探讨。本研究中的膏状样品通过蛋白组学的分析,发现其中含有大量的古蛋白信息,虽然我们送检的质谱仪不能分析出该蛋白的明确信息,但根据严格的分子生物学实验,其中的大量蛋白的存在是毋庸置疑的,结合Caroline Solazzo等人发现的约800年前的陶器碎片中的蛋白,这表明2000年前到800年前的考古样品中,甚至保存条件更好情况下早于2000年前的样品,用蛋白组学方法对其中合适的样品进行实验分析是极有应用前景的。
参考文献:
[1]Solazzo C, Fitzhugh W W, Rolando C. Identification of protein remains in archaeological postsherds by poteomics [J]. Anal Chem, 2008, 80: 4590-4597.
[2]杨 帆, 万 扬, 胡长城. 云南考古[M].昆明:云南人民出版社,2010.
[3]Domon B, Aebersold R. Mass spectrometry and protein analysis [J]. Science, 2006, 312: 212-21714.
[4]王镜岩,柱圣庚,徐长法. 生物化学教程[M].北京:高等教育出版社,2008.
[5]奥斯伯,布伦特. 精编分子生物学实验指南[M].北京:科学出版社,2011.
[6]Hiller L W, Miller W, Birney E, et al. Sequence and comparative analysis of the chicken genome provide unique perspectives on vertebrate evolution [J]. Science, 2004, 432: 695-716.
[7]杨芃原,钱小红,盛龙生. 生物质谱技术与方法[M].北京:科学出版社,2005.
[8]Grandhee S K, Monnier V M. Mechanism of formation of the Maillard protein cross-link pentosidine. glucose, fructose, and ascorbate as pentosidine precursors [J]. J Biol Chem, 1991, 266: 11649-11653.
[9]Evershed R P, Tuross N. Proteinaceous material from potsherd and associated soils[J]. J Archeol Sci, 1996, 23: 429-436.
[10]Kuckova S, Nemec I, Hynek R, et al. Analysis of organic colouring and binding components in colour layer of art works [J]. Anal Bioanal Chem, 2005, 382: 275-282.
[11]Ostrom P H, Gandhi H, Strahler J R, et al. Unraveling the sequence and structure of the protein osteocalcin from a 42 ka fossil horse [J]. J Geochim Cosmochim Acta, 2006, 70: 2034-2044.
[12]Schweitzer M H, Suo Z, Avci R, et al. Analyses of soft tissue fromTyrannosaurusrexsuggest the presence of protein [J]. Science, 2007, 316: 277-280.
[13]Solazzo C, Fitzhugh W M, Rolando C, et al. Identification of protein remains in archaeological potsherds by proteomics [J]. Anal Chem, 2008, 80: 4590-4597.
[14]Cappellini E, Gilbert M T, Geuna F. A multidisciplinary study of archaeological grape seeds [J]. Naturwissenschaften, 2010, 97: 205-217.
[15]Evershed R P. Organic residue analysis in archaeology: the archaeological biomarker revolution [J]. Archaeometry, 2008, 50: 895-924.
