果汁中柑橘属成分实时荧光PCR检测方法
2014-03-21梁宇斌牟靖芳李晓明梁德沛
梁宇斌,牟靖芳,李晓明,梁德沛
(广东产品质量监督检验研究院,国家食品质量监督检验中心(广东),广东顺德528300)
果汁中柑橘属成分实时荧光PCR检测方法
梁宇斌,牟靖芳,李晓明,梁德沛*
(广东产品质量监督检验研究院,国家食品质量监督检验中心(广东),广东顺德528300)
通过分析20条不同柑橘属植物的trn L基因序列,设计柑桔属植物特异性扩增引物。通过对苹果、梨、葡萄等多种水果成分的特异性筛选,建立检测柑桔属植物成分的SYB Green实时荧光PCR检测方法,该方法对柑桔DNA的检测低限为0.1 pg/μL。用该方法检测10种橙汁及其饮料商品,结果表明,该方法能够检测到橙汁中的柑桔属植物成分。该方法可用于果汁或食品中柑桔属植物成分的鉴别。
果汁;柑橘属植物成分;trn L基因;实时荧光PCR;SYB Green
近年来,随着人民生活水平的不断提高,消费者对具有较高营养价值的果汁及果汁饮料的消费量也越来越大[1]。巨大的市场需求导致掺伪行为涉入果汁行业,严重损害消费者的利益。果汁鉴伪检测技术的研究具有非常重要的实际意义。目前,人们鉴别掺伪果汁的方法多基于各种水果特有的标志性化合物[2-5]。但是,果汁掺假手段越来越高明,从最初的简单勾兑水发展到现在的根据原果汁的特征图谱进行调配,导致开展鉴伪工作的难度也越来越高[6]。
分子生物技术以其简便、准确、快速、灵敏度高等特点,可从基因水平分析食品原料及其产品的特性与来源,在食品生物成分的鉴别方面展现广阔的应用前景[7]。近年来,国内外科研工作者开始利用分子生物学技术开发果汁鉴伪检测技术。Ng与Chang等[8]利用PCR技术检测鲜榨橙汁与再生橙汁之间的区别。刘伟红等[9]利用PCR技术根据橙UDP-葡糖基转移酶蛋白基因设计特异性扩增引物,研究出一种可用于果汁中的柑橘属成分的检测及鉴伪方法。韩建勋等[10]利用实时荧光PCR技术开发出一种检测果汁中梨成分的方法。Palmieri L.等[11]根据5S rRNA基因序列和ANS(anthocyanidin synthase)序列设计特异性引物,用实时荧光PCR方法检测食品中的桔子、菠萝、蓝莓、草莓成分。但未见利用实时荧光PCR技术开展对果汁中柑橘属植物成分进行检测及鉴伪的研究。
本研究通过分析多种柑橘属植物trn L基因,设计柑橘属植物特异性引物,拟建立一种可检测果汁中柑橘属植物成分的SYB Green实时荧光PCR检测方法,以其为果汁分子生物学鉴伪体系的建立奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品材料
14种果实样品,包括柑桔、脐橙、蜜桔、贡柑、葡萄柚、柚子、柠檬、梨、苹果、山楂、香蕉、草莓、葡萄、猕猴桃,购自超市;橙汁及橙汁饮料10种,其中100%橙汁4种(A、B、C、D),橙汁饮料6种(E、F、G、H、I、J),所有样品均购自超市。
1.1.2 PCR扩增引物
从NCBI数据库选取20条不同柑橘属植物的trn L基因序列(详细见表1),通过Clustal X软件对序列进行比对分析,找到同源性序列区间,再利用Beacon Designer7.9软件设计出一对特异性扩增柑橘属植物成分的引物:citrus-trnl-F:5′-GAAAGCGAAAAA GGGGGATA-3′,citrus-trnl-R:5′-GGGCAGTCAACTCCATTTGT-3′,扩增片段长度为69 bp,Tm值为79.7℃。以上引物序列由上海生工有限公司合成。
1.1.3 主要试剂
果汁DNA提取液:CTAB缓冲液[2%CTAB,100mmol/LTris-HCl,20mmol/LEDTA,1.4mmol/LNaCl,pH 8.0];蛋白酶K溶液(20mg/mL);1×TE缓冲液;其它试剂或溶剂均为分析纯级或生化纯级。
植物基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;实时荧光PCR反应采用的2×SYBR Premix Ex TaqTM购于大连宝生物工程有限公司。
1.1.4 主要仪器与设备
微量移液器:德国Eppendorf;三孔电热恒温水槽:上海一恒科学仪器有限公司;小型离心机:德国Eppendorf;高速冷冻离心机:德国Sigma;Nanodrop2000微量紫外分光光度计:美国Thermo;LightCycler 1.5荧光定量PCR扩增仪:瑞士Roche。
1.2 方法
1.2.1 DNA提取
1.2.1.1 果汁DNA提取
取10mL果汁,加入0.6倍体积的异丙醇,混匀,4℃下12 000 r/min离心10min,去上清,留沉淀,重复上述步骤3次,将沉淀放于新离心管中,加入5mLCTAB缓冲液与40μL蛋白酶K溶液,振荡混匀,将离心管放于60℃水浴中温浴30min,期间不断摇匀。随后取1mL悬浊液到新离心管中,冷却至室温后,13000 r/min室温离心10min;将上清转移至新离心管中,加入等体积的氯仿,剧烈震荡后,13 000 r/min离心15min,取水相至新的离心管中;加入等体积异丙醇,混匀,室温放置30min后,13000 r/min离心15min,去上清,留沉淀;加入600μL 70%乙醇进行上下颠倒后,12 000 r/min离心5min,去上清,将离心管倒置,室温放置10min~ 20min;加入100μL 1×TE缓冲液溶解沉淀;-20℃保存。
1.2.1.2 果实DNA提取
将不同的水果用解剖刀切碎后,取部分样品于-20℃条件下进行冷冻,随后样品放置于冷冻干燥仪中进行干燥。将干燥后的样品至于预冷的研钵中磨碎,随后按照天根生化科技有限公司的植物基因组DNA提取试剂盒的步骤对样品进行DNA提取。
1.2.2 DNA提取质量的测定
取样品DNA溶液2μL,用Nano Drop 2000型微量紫外分光光度计测定样品DNA在波长为260 nm和280 nm处的紫外吸收值,通过OD260/OD280比值和浓度值判断DNA的纯度和浓度。
同时,根据中华人民共和国出入境检验检疫行业标准SN/T 1204-2003《植物及其加工产品中转基因成分实时荧光PCR定性检验方法》[12],通过检测DNA样品中植物内参照基因tRNA Leu基因,确定所提取DNA样品的可扩增性。其中空白对照以无菌超纯水代替DNA样品,阴性对照为牛肉DNA样品,阳性对照为经本实验室验证DNA质量的大豆DNA样品。每个样品各做2个平行管。
1.2.3 实时荧光PCR反应体系
DNA模板2μL(≤100 ng);2×SYBR Premix Ex TaqTM试剂10μL;引物citrus-trnl-F和citrus-trnl-R各0.4μL(10μmol/L);用无菌水补至总体积为20μL。扩增反应程序为95℃预变性30 sec;95℃变性10 sec,55℃退火30 sec,40个循环,反应于Roche LightCycler1.5荧光定量PCR扩增仪上进行,阈值设置采用默认值,同时保证阈值不小于阴性对照的最高荧光值,使阴性对照的Ct值大于40。随后做溶解曲线分析,分析PCR产物的Tm值。每个样品各做2个平行管。
1.2.4 引物通用性与特异性验证
以柑桔、脐橙、柚子、柠檬、葡萄柚、贡柑和蜜桔7种柑橘属植物作为验证样品,无菌超纯水作为空白对照,验证citrus-trnl-F/R引物对扩增柑橘属植物的通用性;以梨、苹果、山楂、香蕉、草莓、葡萄和猕猴桃7种常见用于生产果汁的果实作为参照样品,柑桔作为阳性对照,无菌超纯水作为空白对照,以确定该引物的特异性。
1.2.5 果汁中柑橘属植物成分实时荧光PCR灵敏度试验
以浓度为100 ng/μL的柑桔DNA溶液作为验证样品,进行10倍梯度稀释,验证特异性引物对citrustrnl-F/R的检测灵敏度。在实时荧光PCR反应中加入该模板2μL,使其终浓度分别为10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、0.1 pg/μL、0.01 pg/μL。通过分析结果确定引物对柑桔DNA的最低检出限。以无菌超纯水作为空白对照。
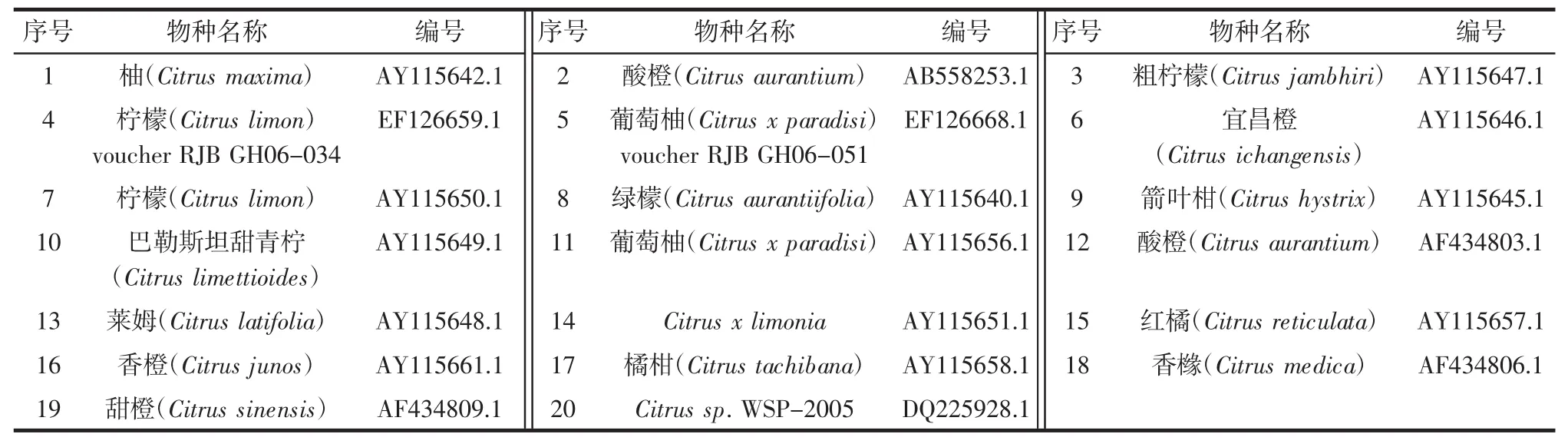
表1 引物设计所参考的不同trn L基因片段信息Table1 Information of different trnL gene fragments used for the primer design
1.2.6 商品化柑橘类果汁饮料的检测
按照上述方法对10种橙汁及橙汁饮料进行DNA提取并进行实时荧光PCR扩增,分析引物的可用性。以无菌超纯水作为空白对照,以牛肉DNA为阴性对照;以柑桔DNA为阳性对照。
2 结果与分析
2.1 DNA提取质量
对柑桔、脐橙、柚子、柠檬、葡萄柚、贡柑、蜜桔、梨、苹果、山楂、香蕉、草莓、葡萄和猕猴桃14种果实提取的DNA样品进行微量紫外分光光度计检测,其OD260/OD280均在1.7~2.0范围之间。(详细数据未显示)。同时,根据SN/T 1204-2003利用植物通用引物(tRNA Leu基因)及探针对所有DNA样品进行扩增,扩增结果见图1。
扩增结果显示,阳性对照、阴性对照和空白对照均正常,所有样品均扩增出典型的S型荧光信号曲线,结果表明所有样品中均含有适合PCR扩增的DNA。
2.2 引物通用性
为确定所设计的引物citrus-trnl F/R的通用性,用引物citrus-trnl F/R对柑桔、脐橙、柚子、柠檬、葡萄柚、贡柑和蜜桔7种柑橘属植物进行实时荧光PCR扩增。结果见图2。
从图2可见,引物citrus-trnl F/R均可对7种柑橘属植物的基因组扩增出荧光信号,扩增曲线的Ct值分别为14.90±0.09、12.93±0.17、13.05±0.02、16.28±0.03、15.62±0.04、16.76±0.07和14.60±0.01;溶解曲线分析结果显示各扩增产物均在温度(79.8±0.4)℃出现特征峰,且各种扩增产物的解链温度与软件预测的产物解链温度无显著差异。试验结果表明,所设计的引物citrus-trnl F/R对柑桔属植物表现出较好的通用性。
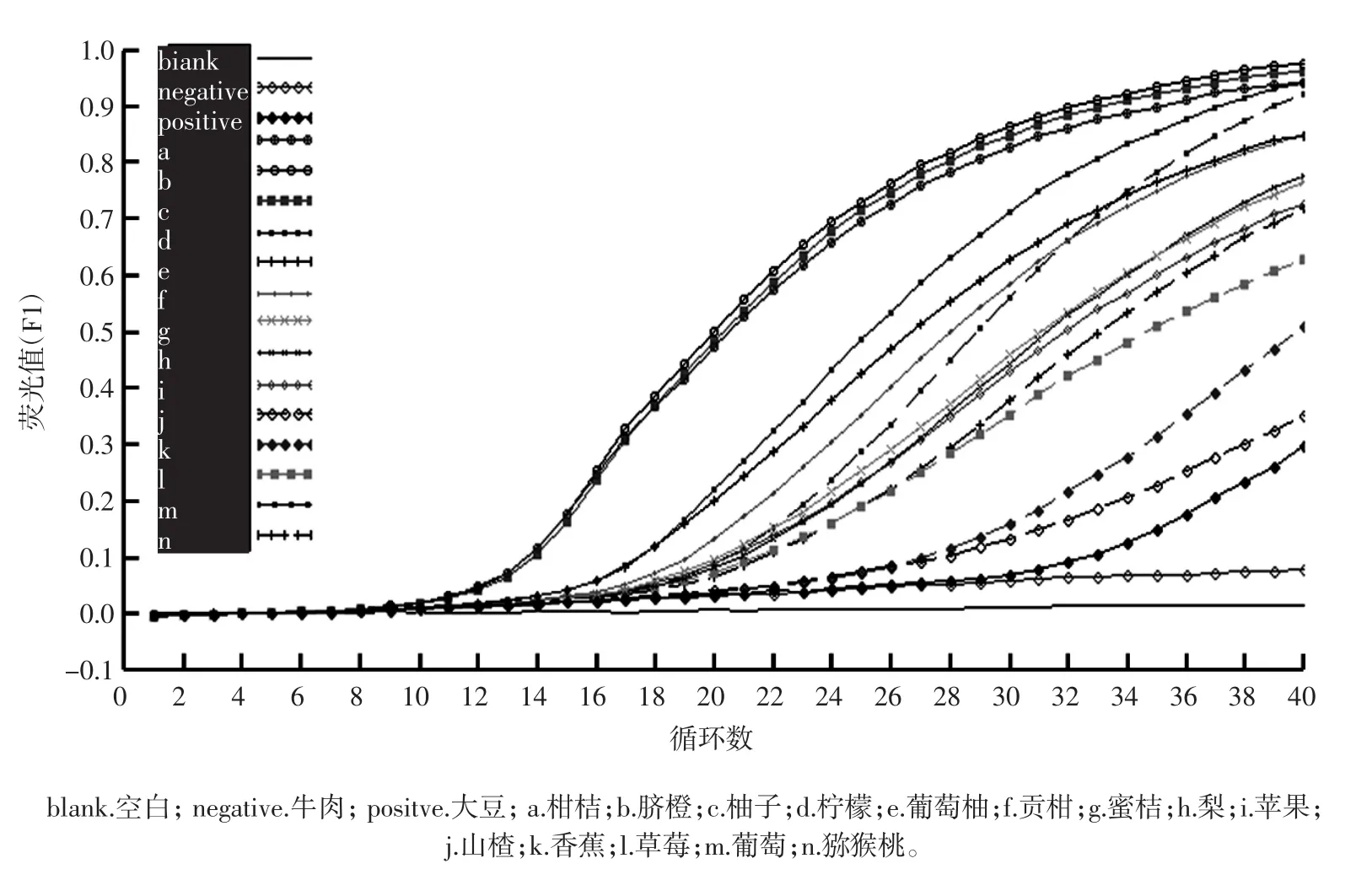
图1 植物内参照基因tRNA Leu基因引物对及探针对样品DNA的Taqman实时荧光PCR扩增结果Fig.1 Amplification results of 14 plants with plant universal primer and probe by Taqman real-time PCR method
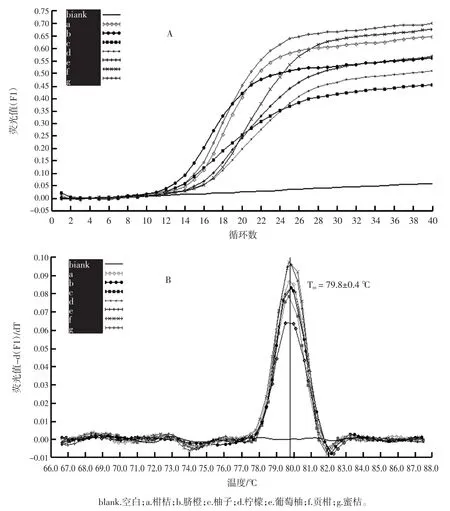
图2 引物对citrus-trnl F/R对7种柑桔属果实的SYBR Green实时荧光PCR扩增结果Fig.2 Amplification results of 7 citrus plants with citrus-trnl F/R primers by SYBR Green real-time PCR method
2.3 引物特异性
为确定所设计的引物citrus-trnl F/R的特异性,用引物citrus-trnl F/R对梨、苹果、山楂、香蕉、草莓、葡萄和猕猴桃7种非柑橘属植物进行实时荧光PCR扩增。结果见图3。
从图3可知,引物对citrus-trnl F/R对7种非柑橘属植物的实时荧光PCR结果均为阴性,说明引物对citrus-trnl F/R的特异性良好。
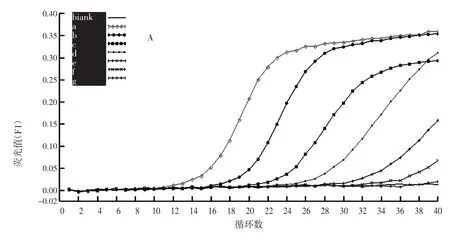
2.4 检测灵敏度
从图4可见,随着DNA浓度的降低,扩增曲线的Ct值不断增大。DNA浓度为10ng/μL、1ng/μL、100pg/μL、10 pg/μL和1 pg/μL 0.1 pg/μL时,样品的扩增结果为阳性,扩增曲线的Ct值分别为15.77±0.01、19.90±0.03、24.10±0.05、28.57±0.12和31.75±0.73;DNA浓度为0.1 pg/μL时,两个平行的结果均为Ct值>36,扩增曲线呈明显上升趋势,参考SN/T1204-2003的结果判断方法认为该扩增结果为阳性;DNA浓度为0.01 pg/μL时,样品无形成典型扩增曲线,其扩增结果为阴性。试验结果表明,本研究所设计的引物对citrus-trnl F/R的实时荧光PCR方法的灵敏度达到0.1 pg/μL柑橘属植物DNA。
2.5 市售橙汁样品检测
对市售的橙汁及橙汁饮料按上述条件提取DNA,并进行实时荧光PCR扩增,结果见图5。
扩增结果显示,空白对照、阴性对照和阳性对照均正常;4种100%橙汁(A、B、C、D)和6种橙汁饮料(E、F、G、H、I、J)样品的扩增结果均为阳性;溶解曲线分析显示在(79.8±0.4)℃附近出现特征峰。扩增结果表明,所建立的实时荧光PCR方法能有效检测到果汁中的柑桔属成分。
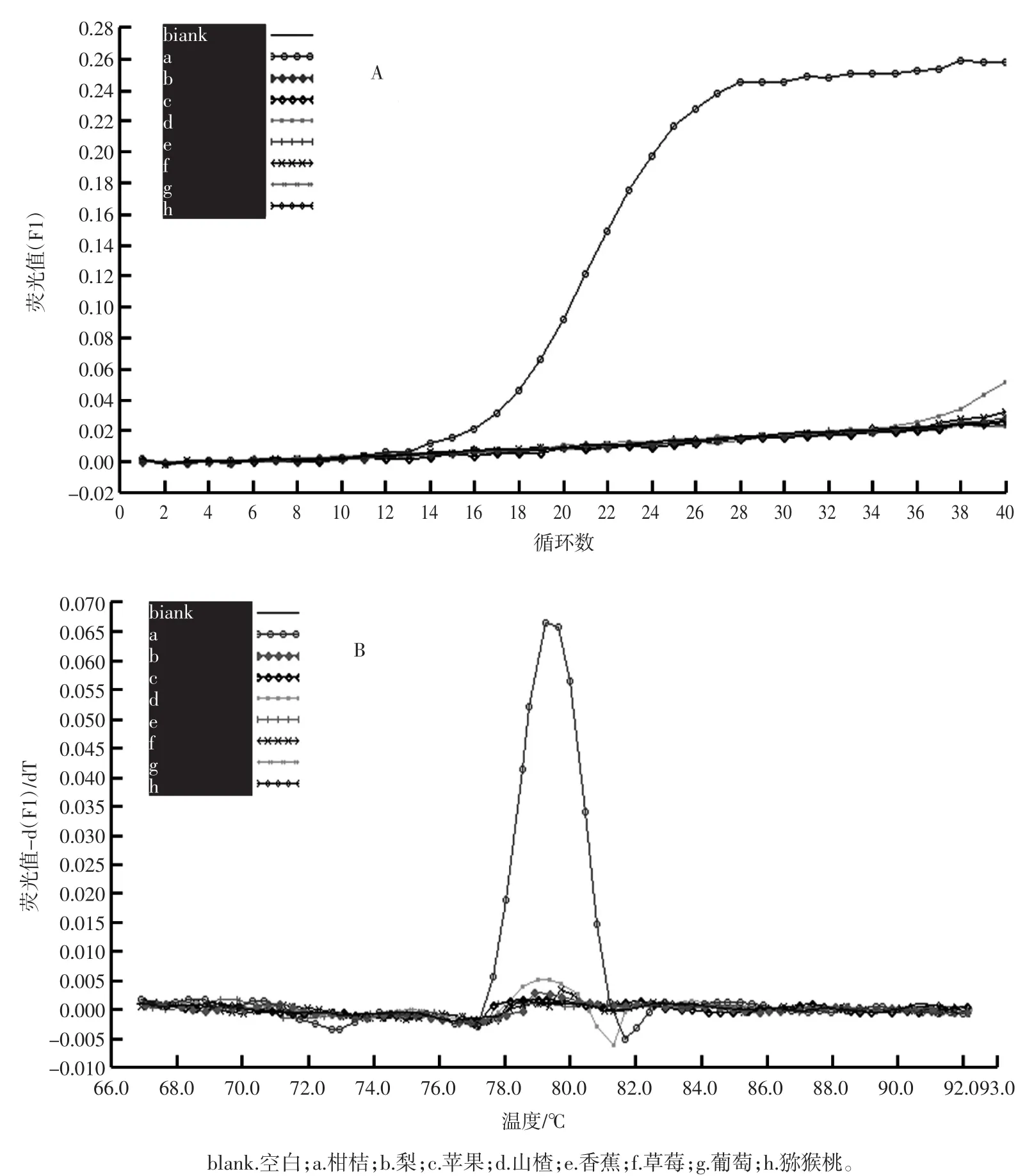
图3 引物对citrus-trnl F/R对7种非柑桔属果实的SYBR Green实时荧光PCR扩增结果Fig.3 Amplification results of 7 non-citrus plants with citrus-trnl F/R primers by SYBR Green real-time PCR method
注:A.扩增曲线;B.溶解曲线。
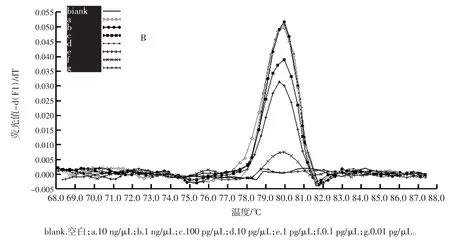
图4 果汁中柑橘属植物成分实时荧光PCR方法灵敏度的确定Fig.4 Sensitivity of real-time PCR method for citrus component in fruit juice
图5 果汁中柑桔属成分检测结果Fig.5 Detection result of citrus component in fruit juice samples
3 结论
编码转运RNA(Transfer RNA)的trn L基因位于植物叶绿体DNA的大单拷贝区。该基因内有一个长约390 bp~615 bp的内含子。该序列的进化情况经深入研究积累了深厚的研究背景[13-14]。同时,该内含子是植物叶绿体DNA中唯一的I型内含子,其保守区与可变区交替所形成了保守的二级结构[15]。由于该序列拥有较高保守性,因此其常与相邻的trn F基因一起用于系统发育分析以及植物品种鉴定的研究[16-19]。本实验根据柑桔属植物trn L基因设计citrus-trnl F/R特异性引物,试验结果表明该引物具有良好的柑桔属植物通用性,对柑桔、脐橙、柚子、柠檬、葡萄柚、贡柑和蜜桔7种柑橘属植物均可扩增出扩增曲线;同时,该引物具有良好的物种特异性,对梨、苹果、山楂、香蕉、草莓、葡萄、猕猴桃等7种水果均无交叉反应。
所谓的实时荧光PCR就是通过对PCR扩增反应中每一个循环产物荧光信号的实时检测,实现对起始模板定性和定量的分析。实时荧光PCR技术以其高特异性、灵敏性、可定量、无污染等优点,得到了广泛的关注,越来越多地被用于食品成分的检测中[20-22]。本实验所建立的SYB Green实时荧光PCR方法的灵敏度达到0.1 pg/μL柑橘属植物DNA,与刘伟红等[9]所建立的PCR方法的灵敏度10 pg/μL相比高出两个数量级,表明该方法的灵敏度较高。
本试验利用citrus-trnl F/R对10种市售橙汁和橙汁饮料样品中的柑橘属植物成分进行检测,所有样品均能检测出果汁中的柑桔属成分。该方法具有特异性强、敏度高等优点,可用于果汁和果汁饮料中柑橘属植物成分鉴别,为果汁鉴伪研究提供技术参考。
[1]高彦祥,李江.2005年中国将成为亚洲最大的果汁市场吗?[J].饮料工业,2002(4):5-11
[2]Ehling S,Cole S.Analysis of Organic Acids in Fruit Juices by Liquid Chromatography-Mass Spectrometry:An Enhanced Tool for Authenticity Testing[J].J Agric Food Chem,2011,59(6):2229-2234
[3]Ježek J,Suhaj M.Application of capillary isotachophoresis for fruit juice authentication[J].Journal of Chromatography A,2001,916(1):185-189
[4]高海燕.苹果汁特征品质分析及鉴伪方法的研究[D].北京:中国农业大学,2004
[5]牛丽影,胡小松,赵镭,等.稳定同位素比率质谱法在NFC与FC果汁鉴别上的应用初探[J].中国食品学报,2009,9(4):192-197
[6]苏光明,胡小松,廖小军,等.果汁鉴伪技术研究新进展[J].食品与发酵工业,2009,35(6):151-156
[7]陈颖,董文,吴亚君,等.食品鉴伪技术体系的研究与应用[J].食品工业科技,2008,29(7):216-218
[8]Ng Chang-Chai,Chang Chen-Chin,Wu I-Chieh,et al.Rapid molecular identification of freshly squeezed and reconstituted orange juice[J].International journal of food science&technology, 2006,41(6):646-651
[9]刘伟红,许文涛,商颖,等.果汁DNA提取方法比较及柑橘属植物分子生物学检测技术的研究[J].中国食品学报,2012,12(4):195-201
[10]韩建勋,黄文胜,吴亚君,等.果汁中梨成分分子生物学鉴伪-实时荧光PCR方法研究[J].中国食品学报,2010,10(1):207-213
[11]Palmieri L,Bozza E,Giongo L.Soft Fruit Traceability in Food Matrices using Real-Time PCR[J].Nutrients,2009,1(2):316-328
[12]中华人民共和国国家质量监督检验检疫总局.SN/T 1204-2003植物及其加工产品中转基因成分实时荧光PCR定性检验方法[S].北京:中国标准出版社,2003:1-5
[13]Quandt D,Stech M.Molecular evolution of the trn L(UAA)intron in bryophytes[J].Molecular phylogenetics and evolution,2005,36(3):429-443
[14]Quandt D,Müller K,Stech M,et al.Molecular evolution of the chloroplast trnL-F region in land plants[J].Monogr SystBotMo Bot Gard,2004,98:13-37
[15]François M,Alain J,Bernard D.Comparison of fungal mitochondrial introns reveals extensive homologies in RNA secondary structure[J]. Biochimie,1982,64(10):867-881
[16]Scharaschkin T,Doyle JA.Phylogeny and historical biogeography of Anaxagorea(Annonaceae)using morphology and non-coding chloroplast sequence data[J].Systematic Botany,2005:712-735
[17]Mc Dade A,Daniel F,Kiel A,et al.Phylogenetic relationships among Acantheae(Acanthaceae):major lineages present contrasting patterns of molecular evolution and morphological differentiation[J]. Systematic Botany,2005,30(4):834-862
[18]Rønning B,Rudi K,Berdal G,et al.Differentiation of important and closely related cereal plant species(Poaceae)in food by hybridization to an oligonucleotide array[J].Journal of Agricultural and Food Chemistry,2005,53(23):8874-8880
[19]Taberlet P,Coissac E,Pompanon F,et al.Power and limitations of the chloroplast trnL(UAA)intron for plant DNA barcoding[J].Nucleic Acids Research,2007,35(3):e14
[20]李富威,高琴,张舒亚,等.实时荧光PCR方法在食品真伪辨别中的应用[J].食品工业科技,2012,33(14):367-370
[21]Giménez J,Fernando P,Antonio M,et al.Application of real-time PCR on the development of molecular markers and to evaluate critical aspects for olive oil authentication[J].Food Chemistry,2010,118 (2):482-487
[22]Herrero B,Madrinán M,Vieites M,et al.Authentication of Atlantic cod(Gadus morhua)using real time PCR[J].Journal of Agricultural and Food Chemistry,2010,58(8):4794-4799
Real-time Fluorescence PCR Method for the Detection of Citrus Component in Fruit Juice
LIANG Yu-bin,MU Jing-fang,LI Xiao-ming,LIANG De-pei*
(China National Quality Supervision and Testing Center for Food,Guangdong Testing Institute of Product Quality Supervision(Guangdong),Shunde 528300,Guangdong,China)
A real-time fluorescence polymerase chain reaction method using the fluorescence dye SYBR Green and aimed at citrus trn L gene sequence was established for detection of citrus DNA in fruit juice.The citrusspecific primers were designed according to the sequence alignment result between 20 different citrus trn L gene sequences.The citrus component could be detected by the citrus-specific primers with a limit of detection of 0.1 pg/μL DNA.The following detection of 10 fruit juice and beverage samples showed that this method was suitable to identify the citrus component in fruit juice beverage and other relative food and can provide a technique base for research of fruit juice adulteration detection.
fruit juice;citrus component;trnL gene;Real-time PCR;SYB Green
10.3969/j.issn.1005-6521.2014.16.022
2013-12-05
梁宇斌(1984—),男(汉),硕士,研究方向:食品生物技术。
*通信作者
