GsPPCK1和GsPPCK3基因转化苜蓿及其耐碱性分析
2014-03-21*
*
(1 塔里木大学生命科学学院, 新疆 阿拉尔 843300 ) (2 东北农业大学生命科学学院, 黑龙江 哈尔滨 150030)
紫花苜蓿(MedicagosativaL.)是豆科牧草,因营养价值极其丰富且产量高被誉为“牧草之王”,是营养价值极佳的优质牧草,可提高牛羊的产奶量和肉的品质。同时也是改善土壤条件、保持水土和开发利用盐碱地资源的重要作物[1]。苜蓿具有一定的耐盐碱特性,可在轻度盐碱地栽培,但在中度盐碱地或重度盐碱地不能正常生长导致生物量大大降低[2]。磷酸烯醇式丙酮酸羧化酶激酶(phosphoenolpyruvatecarboxylasekinase,PPCK) 是一种典型的蛋白激酶,参与植物对胁迫的反应[3],受转录水平和蛋白质合成的调控,在碱胁迫诱导后上调表达,并且能够维持细胞内pH的稳定。磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvatecarboxylase,PEPC)能够被其特异性磷酸化,在植物中PEPC参与光合作用的固氮、生物合成前体的供应、氮同化过程中对pH的调控及信号级联反应[2]。在C4植物叶片中PPCK水平与本森-卡尔文循环的活性及光合作用电子传递链的流量紧密联系[3-7]。
为培育、筛选出耐碱转基因苜蓿,本研究采用农杆菌介导法将实验室前期构建的野大豆碱胁迫转录谱中筛选获得的碱胁迫应答关键的2个基因(GsPPCK1,GsPPCK3),转化苜蓿新品种龙牧806(M.sativa cv.LongmuNO.806),来培育耐盐碱苜蓿新品种。龙牧806是黑龙江农科院草业所以肇东苜蓿与扁蓿豆远缘杂交种 F3代群体为原始材料,采用系统选育方法,通过多次单株选择选育出的优良品种[8],是适合东北地区种植的优质、抗寒、抗病、生物产量高的优良品种。对获得的转GsPPCK1和GsPPCK3基因株系进行了较系统的分子生物学检测和耐碱性分析,最终获得了耐碱能力较强的转基因株系。
1 材料与方法
1.1 试验材料
大肠杆菌DH5α和根癌农杆菌 (Agrobacteriumtumefaciems)EHA105由东北农业大学植物生物工程研究室保存。转化受体为紫花苜蓿龙牧806种子,由黑龙江农业科学院草业所提供。
1.2 植物表达载体的构建
1.2.1 质粒的限制性内切酶消化反应:
1.2.1.1 加入2 μL (10×)相应的限制酶消化缓冲液,再加入0. 2~1. 0 ug的质粒DNA。
1.2.1.2 加入1~2单位的限制性内切酶,加去离子水至总体积为20 μL 。
1.2.1.3 轻弹外壁以混匀,并短暂快速离心,使液体沉下。
1.2.1.4 将混和反应置于37 ℃水浴中,反应3小时左右。
1.2.1.5 电泳观察酶切结果。
1.2.2 目的片段的电泳回收:
采用北京鼎国回收试剂盒,方法如下:
1.2.2.1 样品经琼脂凝胶电泳后,将含目的DNA片段的凝胶切出,放入1. 5 mL Ep管中。
1.2.2.2 加入3倍体积的溶液A和150 μL 溶液B,60 ℃,5~10 min,使胶完全溶解。
1.2.2.3 将上述溶液转到离心过滤柱中,室温放置20 min。
1.2.2.4 10 000 r/min,离心1 min,除掉上清。
1.2.2.5 加入500 μL 溶液C,混匀后10 000 r/min,离心1 min。(重复一次)
1.2.2.6 除净上清,加入TE混匀,55 ℃水浴放置5 min。
1.2.2.7 10 000 r/min,离心1 min,回收上清液,为DNA溶液。
1.2.2.8 电泳观察回收结果。
1.2.3 连接反应
1.2.3.1 将T4DNA连接酶缓冲液1 μL 加入一灭菌的Ep管中。
1.2.3.2 加入适量载体DNA和外源DNA片段,使摩尔比为1:1,70 ℃水浴10 min。
1.2.3.3 室温下加入T4DNA连接酶1 μL ,轻弹外壁以摇匀,并短暂快速离心,使液体沉下。
1.2.3.4 22 ℃反应3小时以上。
1.3 转基因苜蓿的获得
1.3.1 筛选压力的确定
以非转基因的无菌苗子叶节为材料,固沙草Glufosinate为筛选剂[9],初次浓度梯度为设置为0、0 . 5、1、1 . 5、2 mg/L 5个梯度,基本培养基为MS+1mg/L 6-BA,确定出龙牧806苜蓿的筛选压力。再次浓度梯度设置为0、0 . 3、0 . 4、0 . 5、0 . 6、0 . 7、0 . 8 mg/L 7个梯度确定出龙牧806苜蓿最终筛选压力。
1.3.2 农杆菌介导的遗传转化及抗性植株再生
将鉴定好的植物表达载体采用冻融法[11-13]转入农杆菌中。
无菌苗培养:苜蓿种子灭菌后播种在萌发培养基(1/2MS+ 15g/L 蔗糖+0. 8%琼脂,pH5. 8)上,生物培养箱中25 ℃培养7 d。
子叶节预培养:剪下子叶节转入预培养培养基(1.0mg/L 6-BA+MS+30g/L蔗糖+0. 85%琼脂,pH5. 8)中培养2 d。
农杆菌浸染:将子叶浸泡在OD600为0. 4~0. 6的农杆菌转化菌液中浸染15 min,期间轻轻晃动三角瓶2~3次,取出后用无菌滤纸适度吸去过量菌液,接种在共培养培养基(100 uM/L乙酰丁香酮+1. 0 mg/L 6-BA+MS+30 g/L蔗糖+0. 85%琼脂,pH5. 2)上,进行黑暗培养72 h ,转入除菌筛选培养基(1. 0 mg/L 6-BA+MS+30 g/L蔗糖+0. 8 mg/L固沙草+100 mg/L阿莫西林+0. 85%琼脂,pH5. 8)筛选10天。
不定芽诱导与伸长:将分化出的抗性芽转入含有相同筛选压力的不定芽诱导与伸长除菌培养基(0. 5mg/L 6-BA+MS+30 g/L蔗糖+0. 8 mg/L固沙草+100 mg/L阿莫西林+0. 85%琼脂,pH5. 8)中培养10 d。
不定根诱导:待不定芽长至2~3 cm高时,尽量选择分支多的不定芽,将根部的愈伤组织剪掉,置于1 mg/ml的IBA中浸泡2-3分钟,插入生根培养基(1/2MS+15g/L蔗糖+50 mg/L阿莫西林0. 85%琼脂,pH5. 8)中,两周左右长出不定根。
驯化移栽:待不定根长到2~3 cm长时,进行驯化移栽。将小苗用镊子小心取出,用自来水缓慢冲洗干净根部培养基,放于1/2MS的营养液中,驯化适应1~3天,移栽于土:草炭:蛭石=1:1:1的营养钵中,扣塑料杯保湿。培养条件为26 ℃、散射光、湿度80%,16 h/d弱光培养。培养至有新叶长出后,可逐渐去除保湿塑料杯,移栽至大花盆中,保证充足的光照和适度水分。
1.4 分子生物学检测
1.4.1 PCR检测
引物设计:以35s-bar序列设计引物,上游35S-bar-S为5’-CCTGTGCCTCCAGGGAC-3’) ,下游引物35S-bar-AS为5’-GCGGTCTGCACCATCGTC-3’。对EHA105(pCEPPCK1, pCEPPCK3)侵染后获得的抗性植株PCR检测:取驯化移栽的转基因苜蓿幼嫩叶片,采用EasyPureTM Plant Genomic DNA Kit提取DNA,以非转基因幼嫩叶片为阴性对照,进行PCR检测。反应体系为10 μL :2×Easytaq 5 μL , ddH2O 3. 4 μL , P1(10 umol/L)0. 3 μL , P2(10 umol/L)0. 3 μL , 模板DNA1 μL 。PCR反应条件:94 ℃预变性10 min,94 ℃变性30 s,63 ℃退火30 s,72 ℃延伸30 s,30个循环延伸10 min, 4 ℃终止反应。对PCR产物进行2%琼脂糖凝胶电泳和紫外凝胶成像系统观察。
1.4.2 PCR阳性株系的Real-time PCR检测
转基因苜蓿总RNA的提取,取PCR呈阳性的转基因植株幼嫩叶片采用RNA prep pure Plant Kit提取RNA,以非转基因幼嫩叶片为阴性对照,cDNA第一链的合成采用SMART cDNA synthesis kit,反转录后的cDNA为模板,对两个基因分别设置了特异引物:
GsPPCK1-RS (5’-CCACCGCACTTCAAACAA-3’)
GsPPCK1-RAS(5’-ACCGCTCATGCTACTCCC-3’)
GsPPCK3-RS(5’-CCCTCCTTTCACCTCACC-3’)
GsPPCK3-RAS(5’-GAACCGAAGTCCGCCAGT-3’)
进行Real-time PCR检测,确定转基因植株与野生型苜蓿中基因的表达量差异。
1.5 转基因苜蓿株系的扩繁与NaHCO3胁迫处理
转基因苜蓿株系的扩繁:实验于2013年7月中旬至9月在东北农业大学香坊农场28号温室内进行。选取生长状态良好的转基因和非转基因野生型苜蓿的枝条,剪成带2~3个腋芽的茎段浸泡于生根粉溶液中,2 h后插入底部打孔的盛有普通土:草炭土:蛭石=1:1:1的塑料大盆内定期喷灌,10 d左右长出不定根,3周后挑选根系发达长势健壮的扦插苗移出,移栽于装有混合基质珍珠岩:蛭石=1:1的营养钵中,每钵1株苗,每30株单株置于一大托盘,每盘浇3L 1/2Hoagland营养液,每2 d补加0. 5 L营养液。
转基因苜蓿株系的NaHCO3胁迫处理:待其在营养钵中生长1个月后,挑选长势健壮一致的植株进行胁迫处理,将转基因材料和野生型材料各分成3组,每组10株,设3次重复。NaHCO3处理设置4个浓度,分别为0 mmol/L,100 mmol/L,200 mmol/L,250 mmol/L,1/2Hoagland营养液持续胁迫培养,每一托盘加入3 L,每2 d补加0. 5 L。待表型明显时进行生理指标的测定。
1.6 转基因苜蓿株系的生理生化指标的测定
NaHCO3胁迫处理9 d后,测定与耐碱相关的7项指标,包括质膜透性、叶绿素含量、丙二醛含量、脯氨酸含量、柠檬酸含量、超氧化物歧化酶(SOD)活性及磷酸烯醇式丙酮酸羧化酶(PEPC)活性。每项指标随机测定3个单株,3次重复,计算其平均值。各指标的测定方法分别为,电导仪法测定质膜透性,硫代巴比妥酸法测定丙二醛含量,80%丙酮研磨提取比色法测定叶绿素(Chl)含量,氮蓝四唑NBT光化还原法测定超氧化物歧化酶(SOD)活性,磺基水杨酸提取法测定脯氨酸含量[14-15],分光光度计法测定柠檬酸含量[16]和磷酸烯醇式丙酮酸羧化酶[17](PEPC)活性。
2 结果与分析
2.1 植物表达载体构建
植物表达载体pCEPPCK1的构建过程见图1。用SnaB I和EcoR I分步进行不完全酶切中间表达载体pAEOM-PPCK1,回收后与经同样的酶消化的载体卡盒pBEOM连接,转化大肠杆菌DH5α。对转化子进行SnaB I和EcoR I双酶切鉴定,结果得到的大小为806 bp的特异性条带如图2,酶切结果正确。
植物表达载体pCEPPCK3的构建过程见图3。用Hind III和Sac I双酶切中间表达载体pAEOM-PPCK3回收后与经同样的酶消化的载体卡盒pBEOM连接,转化大肠杆菌DH5α;对转化子进行Hind III和Sac I双酶切鉴定结果得到的大小为901 bp 的特异性条带如图4所示,酶切结果正确。
2.2 农杆菌介导的遗传转化及抗性植株再生
对鉴定正确GsPPCK1,GsPPCK3通过农杆菌介导的遗传转化龙牧806所得的抗性植株统计结果见表1。
2.2.1 固沙草Glufosinate筛选压力的确定
在初次实验中,对非转基因材料利用所设置的5个浓度梯度,3次重复实验,结果表明:Glufosinate浓度为1 mg/L以上时,不定芽分化率为零,说明已完全抑制不定芽的分化,结果见表2。
为确定出更加准确的筛选压力,进一步缩小了浓度梯度,设置了7个浓度梯度(见表3),对非转基因材料进行3次重复处理Glufosinate浓度为0.8 mg/L时,不定芽分化率为零,以此浓度作为不定芽的分化筛选浓度。

图1 植物表达载体pCEPPCK1的构建

图3 植物表达载体pCEPPCK3的构建

图4 植物表达载体pCEPPCK3酶切鉴定

表1 抗性植株转化效率

表2 Glufosinate筛选压力确定

表3 Glufosinate筛选压力确定
2.3 抗性植株PCR检测和Real-time-PCR检测
对上述转GsPPCK1和GsPPCK3各获得抗性植株45、53株进行了PCR检测和Real-time-PCR检测。
2.3.1 抗性植株的PCR检测
用bar基因序列设计引物, 以质粒DNA为阳性对照,以水和非转化植株为阴性对照对GsPPCK1和GsPPCK3各获得抗性植株45、53株进行PCR检测,扩增出约450bp的目的条带(结果如图5、6)。GsPPCK1和GsPPCK3基因PCR阳性率分别为37. 8%、35. 8%,表明基因GsPPCK1和GsPPCK3已经整合到龙牧806苜蓿中。
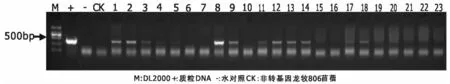
图5 转GsPPCK1抗性植株的PCR鉴定

图6 转GsPPCK3抗性植株的PCR鉴定
2.3.2 PCR阳性植株的Real-time-PCR检测
对PCR阳性植株进行Real-time-PCR分析,以野生型龙牧806紫花苜蓿为对照,检测基因GsPPCK1和GsPPCK3的表达情况,在PCR阳性植株中GsPPCK1,GsPPCK3基因中各有两株超量表达 (图7所示)。

图7 转GsPPCK1、GsPPCK3基因抗性植株的Real-time PCR检测

图8 碱胁迫9d转基因苜蓿与野生型苜蓿生长表型
2.4 转基因株系的耐碱性分析
2.4.1 碱胁迫下转基因苜蓿的生长情况
以上述NaHCO34个浓度处理9d后,未处理时转基因苜蓿与野生型苜蓿的长势基本一致(图8A);100 mmol/L NaHCO3胁迫处理的转基因苜蓿仍能正常生长,表型明显好于野生型,而野生型生长发育轻微受抑制,叶片逐渐变黄(见图8B)。在200 mmol/L NaHCO3处理下,大部分野生型苜蓿叶片变黄、委焉,生长严重受阻。而转基因苜蓿生长受到轻微抑制,但基本不影响其的正常生长,耐碱性明显好于野生型(图8C)。在250 mmol/L NaHCO3处理下,大部分野生型苜蓿已经死亡,存活率仅为12. 7%,转基因苜蓿生长也受到抑制,转GsPPCK1基因苜蓿和GsPPCK3基因苜蓿的存活率分别是63. 5%和 67. 2%,明显好于野生型(图8D)。
2.4.2 碱胁迫下苜蓿叶绿素(Chl)含量的测定
经100 mmol/L NaHCO3胁迫处理后,野生型和转基因各株系的叶绿素含量随胁迫浓度的增大均呈逐渐下降趋势,但转GsPPCK1和GsPPCK3苜蓿4个株系的叶绿素含量显著高于野生型(图9A、图9B)且差异达到了极显著水平(P<0. 01),表明转基因苜蓿耐碱能力高于非转基因苜蓿。

图9 不同NaHCO3浓度处理下转基因苜蓿叶绿素含量的变化
2.4.3 碱胁迫下苜蓿的电导率及丙二醛含量的测定
转基因苜蓿的电导率:在非盐分胁迫条件下各株系细胞内电解质相对渗出率较低,在100 mmol/L NaHCO3处理下质膜透性增大,野生型和转GsPPCK1苜蓿(图10A)、GsPPCK3苜蓿(图10B)的相对电导率均呈现出增加的动态变化趋势。4个转基因株系的相对电导率低于野生型,差异极显著(P<0. 01)。在200和250 mmol/L NaHCO3胁迫处理下,相对电导率均增加,但4个转基因株系显著低于野生型,差异极显著。表明4个转基因苜蓿株系具有较强的耐碱性。
转基因苜蓿的丙二醛含量:在NaHCO3的碱胁迫下,随着浓度增高,野生型与转基因各株系的MDA含量均升高,但转GsPPCK1苜蓿(图11A)和GsPPCK3苜蓿(图11B)的4个株系的MDA含量低于野生型,差异极显著(P<0. 01)。说明4个转基因株系与非转基因苜蓿的膜脂过氧化程度较低遭受的伤害较轻。

图10 不同NaHCO3浓度处理下转基因苜蓿相对电导率的变化

图11 不同NaHCO3浓度处理下转基因苜蓿丙二醛含量的变化
2.4.3 碱胁迫下苜蓿的柠檬酸及脯氨酸(Pro)含量的测定
转基因苜蓿的柠檬酸含量测定:在100 mmol/L NaHCO3的碱胁迫下,野生型和转基因各株系的柠檬酸含量均升高,但转GsPPCK1和GsPPCK3基因苜蓿和转基因苜蓿中柠檬酸含量显著高于野生型。随着NaHCO3浓度增高,转基因株系柠檬酸含量显著高于野生型,达到极显著水平(P<0. 01)(图12A、B)。说明转基因苜蓿在碱胁迫下积累有机酸能力强于非转基因株系。
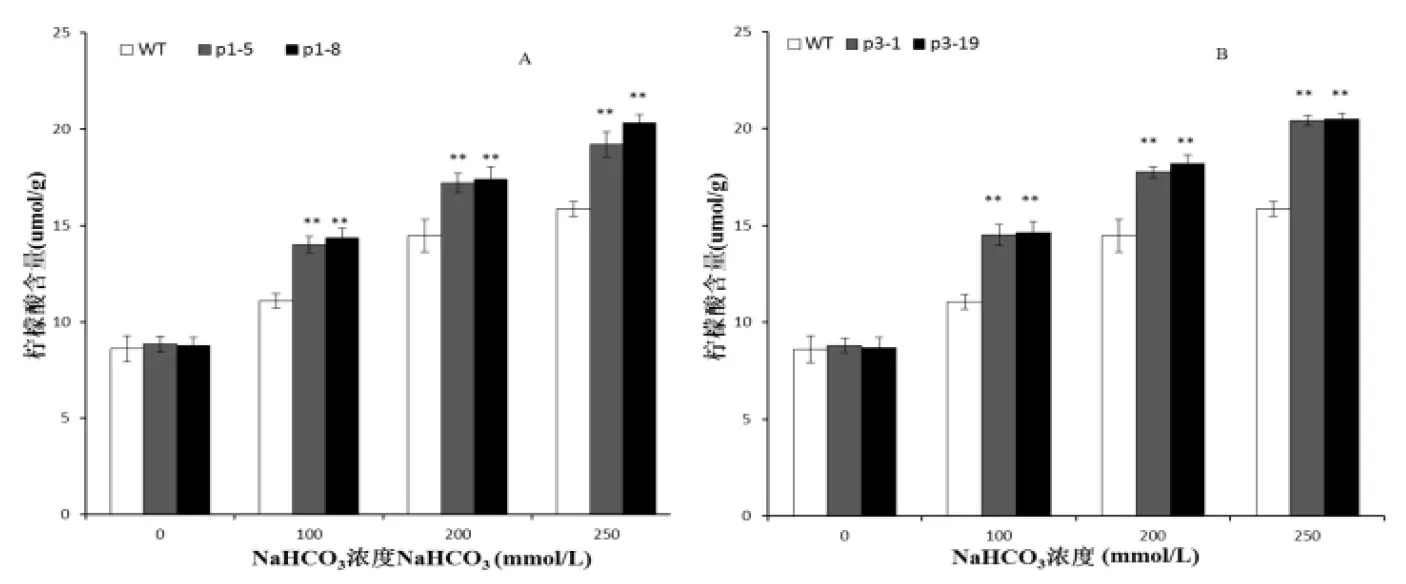
图12 不同NaHCO3浓度处理下转基因苜蓿柠檬酸含量的变化

图13 不同NaHCO3浓度处理下转基因苜蓿脯氨酸含量的变化
转基因苜蓿脯氨酸(Pro)含量测定:在100 mmol/L NaHCO3处理下野生型WT和转基因苜蓿间的脯氨酸含量均明显增加,随着胁迫处理浓度的增加,野生型苜蓿脯氨酸含量上升缓慢,而转基因GsPPCK1苜蓿(图13A)和转GsPPCK3苜蓿(图13B)中脯氨酸含量显著高于野生型(P<0. 01),说明转基因苜蓿在碱处理下,脯氨酸积累能力强于非转基因苜蓿。
2.4.4 碱胁迫下苜蓿的过氧化物歧化酶(SOD)及磷酸烯醇式丙酮酸羧化酶(PEP羧化酶)活性的测定
SOD活性变化:在未处理条件下,野生型与转基因苜蓿中的SOD活性差异不显著 (P>0. 05)。随着胁迫处理浓度的增加,转基因GsPPCK1苜蓿(图14A)和转GsPPCK3苜蓿(图14B)中SOD活性显著高于野生型(P<0. 01)说明GsPPCK1,GsPPCK3基因的表达能够在碱胁迫下提高转基因苜蓿的SOD活性,进一步降低了碱胁迫对植株造成的氧化伤害。

图14 不同NaHCO3浓度处理下转基因苜蓿SOD酶活性的变化

图15 不同NaHCO3浓度处理下转基因苜蓿PEP羧化酶活性的变化
PEP羧化酶活性的变化:在未处理时PEP羧化酶活性差异不显著(P>0. 05)。随着胁迫处理浓度的增加,野生型苜蓿PEP羧化酶活性上升缓慢,而转基因GsPPCK1苜蓿(图15A)和转GsPPCK3苜蓿(图15B)中PEP羧化酶活性显著高于野生型(P<0. 01),说明碱胁迫能够激活GsPPCK1、GsPPCK3基因的表达,在碱胁迫下提高转基因苜蓿的PEP羧化酶活性从而增强了转基因苜蓿的耐碱性。
3 讨论
3.1 抗逆基因供体材料的选择
非生物胁迫是影响农作物产量的重要因素,对于培育出耐性强的作物已成为现代农业的研究热点之一,通过传统育种的方法提高作物耐胁迫能力的效果非常有限。近十年来,对于植物逆境应答的分子基础研究已经取得了一定的进展,但是大量研究都着重于拟南芥,小麦,水稻等模式植物,非模式植物并未广泛涉及。野大豆是栽培大豆的野生种,在长期的自然选择过程中,野大豆受到低温、盐碱及干旱等恶劣环境的威胁,野大豆具备了极强的耐盐碱和耐寒能力,还有丰富的耐逆基因资源。目前对研究其抗逆分子机理,克隆出耐逆相关基因[18],对于作物的抗逆分子育种研究具有十分重要的现实意义。
3.2 目的基因的选择
磷酸烯醇式丙酮酸羧化酶激酶(PPCK)的作用:PPCK是一种典型的蛋白激酶,它不但在在光合作用中起重要作用,而且在非生物胁迫下发挥重要作用,胞质pH过高时,能够结合CO2产生草酰乙酸,从而降低胞质pH。本研究选用碱胁迫应答相关的磷酸烯醇式丙酮酸羧化酶激酶(phosphoenolpyruvate carboxylase kinase,PPCK)类的2个关键基因——GsPPCK1和GsPPCK3转化苜蓿,均获得了显著耐盐碱的转基因苜蓿,也证明了该类基因在转基因苜蓿中发挥了重要作用。
3.3 转基因植株耐碱性相关生理指标检测的选择
碱胁迫对植物的危害主要体现在以下几个方面:膜系统损伤、高pH值伤害、离子毒害等,因此针对以上几个方面,选择与其相关的生理指标来评价,更能说明转基因材料的耐碱能力。本实验选取的生理指标如下:叶绿素与光合作用相关,PPCK是光合作用中的关键酶,叶绿素含量间接体现出植物的光合能力;相对电导率反映碱胁迫对细胞膜损害情况;丙二醛是膜脂氧化的主要产物之一,反映了胁迫下植物质膜破坏程度的大小;超氧化物歧化酶能够催化超氧阴离子自由基转变为O2-和H2O2,能有效保护生物免受活性氧的伤害,从而稳定生物膜的结构;脯氨酸在胁迫下的积累保证液泡、细胞质及胞外环境中的渗透平衡:柠檬酸含量的多少反映了植物对pH调节的程度;PEPC是一种广泛存在的代谢相关酶,在胞质pH过高时,能够调节胞质pH,使植物在逆境中正常生长,其活性直接反映出植物的耐逆能力;因此本研究对转基因株系和非转基因株系进行了这些指标的检测。
本研究结果表明:在NaHCO3胁迫下,转基因苜蓿的7项耐碱性指标,均优于野生型,表明GsPPCK1,GsPPCK3基因在紫花苜蓿龙牧806中超量表达,明显提高了转基因苜蓿的耐碱性。本研究对于苜蓿耐盐碱转基因分子育种技术体系的建立及其产业化应用,开发利用盐碱地资源、增加耕地面积,将起到积极作用。
[1] 柳维扬,杨赵平,高艳红,等.塔里木盆地特有种硬枝碱蓬适盐性与土壤养分初步研究[J].塔里木大学学报,2009,21(4): 18-21.
[2] 胡清泉,玉永雄.转基因苜蓿研究进展[J].中国草地,2005,27(5):58-62.
[3] Wenxin Xu, Shirley J. Sato,Thomas E, et al. The PEP-carboxylase kinase gene family in Glycine max(GmPpcK1-4): an in-depth molecμL ar analysis with nodμL ated, non-transgenic and transgenic plants[J]. The Plant Journal, 2007,(49):910-923.
[4] Li B, Pacquit V, Jiao J, et al. Structural requirements for phosphorylation of C4-leaf phosphoenolpyruvate carboxylase by its highly regμL ated protein-serine kinase. A comparative study with synthetic-peptide substrates and mutant target proteins[J]. Functional Plant Biology, 1997, 24(4): 443-449.
[5] García-Maurino S, Monreal J, Alvarez R, et al. Characterization of salt stress-enhanced phosphoenolpyruvate carboxylase kinase activity in leaves of Sorghum vμL gare: independence from osmotic stress, involvement of ion toxicity and significance of dark phosphorylation[J]. Planta, 2003, 216(4): 648-655.
[6] 陈硕,陈珈.植物中钙依赖蛋白激酶(CDPKs)的结构与功能[J].植物学通报,18(2):143-148.
[7] 魏正巍,朱延明,华烨.转GsPPCK1基因苜蓿植株的获得及其耐碱性分析[J].作物学报,2013,39(1):67-75.
[8] 李红.高产、高蛋白、高抗性龙牧806号苜蓿[J].牧草与饲料,2007,1(3):64-64.
[9] Zhang Z, Xing A, Staswick P, et al.The use of glufosinate as a selective agent in Agrobacterium-mediated transformation of soybean[J].Plant Cell, Tissue and Organ CμL ture, 1999, 56(1): 37-46.
[10] 李望丰,吕德扬,刘艳芝.诱导苜蓿胚性愈伤组织分化和再生[J].植物生理与分子生物学, 2002,29(2):15-16.
[11] 梁慧敏,黄剑,夏阳.苜蓿组织培养高频再生体系的建立[J].农业生物技术学报,2003,11(03):321-322.
[12] 刘晶.GsbZIP33和GsCBRLK基因转化肇东苜蓿及其耐盐性的分析[D].黑龙江:东北农业大学,2013.
[13] 邹丽娜,周志宇,颜淑云,等.盐分胁迫对紫穗槐幼苗生理生化特性的影响[J].草业学报,2011,20(3):84-90.
[14] 张永峰,殷波.混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].草业学报,2009,18(1):46-50.
[15] 郝再彬,仓晶,徐仲,等.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:101-110.
[16] 朱军利.分光光度计法定量测定柠檬酸及其盐的含量[J].分析实验室,2012,31(2):115-117.
[17] 杨靓.野生大豆渗透胁迫相关蛋白激酶基因的克隆及功能分析[D].哈尔滨:东北农业大学,2010.
[18] 张永锋,梁正伟,隋丽.等.盐碱胁迫对苗期紫花苜蓿生理特性的影响[J].草业学报.2009.18(4):230-245.
[19] Zeng P, Vadnais D A, Zhang Z, et al. Refined glufosinate selection in Agrobacterium-mediated transformation of soybean [Glycine max (L.) Merrill][J]. Plant cell reports, 2004, 22(7): 478-482.
[20] Hoshida H,Tanaka Y,Hibino T,et al. Enhanced tolerance to salt stress in transgenic rice that over express chloroplast glutmine systhetase [J]. Plant Mol.,2000,43(1):103-111.
