氯化钴模拟法构建骨骼肌细胞缺氧模型
2014-03-21李晰辛世杰王磊宋泽荆玉辰曹辉段志泉张健
李晰,辛世杰,王磊,宋泽,荆玉辰,曹辉,段志泉,张健
(中国医科大学附属第一医院普外教研室血管甲状腺外科,沈阳110001)
·技术方法·
氯化钴模拟法构建骨骼肌细胞缺氧模型
李晰,辛世杰,王磊,宋泽,荆玉辰,曹辉,段志泉,张健
(中国医科大学附属第一医院普外教研室血管甲状腺外科,沈阳110001)
目的观察CoCl2对体外培养的原代骨骼肌细胞的影响,探讨合理的体外化学模拟低氧模式。方法利用组织贴块法培养并鉴定原代骨骼肌细胞,给予CoCl2处理,观察不同时间和浓度细胞凋亡情况,以及通过免疫印迹及实时定量聚合酶链反应检测低氧诱导因子1α(HIF-1α)、BAX的表达变化情况。结果与对照组比较,CoCl2处理组的细胞存活率明显下降(P<0.05),凋亡率明显增加(P<0.05),且骨骼肌细胞存活率下降程度及细胞凋亡率增加程度均随着氯化钴浓度增加时间延长而升高。HIF-1α、BAX蛋白水平亦随CoCl2浓度升高和时间延长而增加。结论CoCl2对原代骨骼肌细胞的增殖凋亡及相关基因的表达成呈时间和浓度依赖性,成功建立起一种体外培养原代骨骼肌细胞缺氧诱导模型,可以作为体外研究骨骼肌缺血缺氧的良好模型。
氯化钴;骨骼肌细胞;凋亡;低氧诱导因子1α
下肢动脉闭塞症是常见的下肢动脉闭塞性疾病,由于下肢缺血时动脉血流减少、组织因缺血等发生不可逆性损伤。细胞坏死、萎缩和间质纤维化等导致骨骼肌损伤。目前对这种肌肉缺血性变化尚无良好的治疗方法。缺血与缺氧常常是相互伴随的,各种研究表明显示,在哺乳系统中,二氯化钴是已经被广泛应用的模拟缺氧环境的化学试剂,能够产生与缺氧缺血相似的反应[1]。因此,为了进一步探讨骨骼肌在缺血缺氧过程中变化机制,我们利用原代骨骼肌细胞在二氯化钴不同浓度和处理时间情况下研究细胞的增殖、活力、凋亡及缺氧相关反应基因的变化,以便建立一个可靠、重复性高、检测方便的骨骼肌缺氧诱导模型,为探索及防治下肢动脉硬化闭塞症奠定基础。
1 材料与方法
1.1 材料
2~3 d新生SD大鼠,雌雄不限(中国医科大学实验动物中心提供);DMEM培养基、胎牛血清、胰蛋白酶(HyClone,美国);α横纹肌肌动蛋白、TRITC标记的山羊抗兔IgG(博奥森,中国);低氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)抗体、BAX抗体、GAPDH抗体(Santa Cruz公司,美国);Real-time PCR试剂盒(TaKaRa公司,日本);CoCl2、MTT、二甲基亚砜(Sigma,美国)。
1.2 方法
1.2.1 原代骨骼肌细胞培养:应用原代细胞培养方法,2~3 d新生SD大鼠通过机械剥离骨骼肌。骨骼肌剪碎成许多小片,放置于含10%胎牛血清的DMEM,使其贴在培养瓶表面。肌细胞从肌组织爬出,几天后相互融合。原代细胞应用含EDTA的胰酶消化传代。以5×104密度将细胞接种于培养皿,给予氯化钴不同浓度(0、50、100、200、400 μmol/L)和不同时间(0、4、8、12、24 h)处理。
1.2.2 细胞免疫荧光鉴定:免疫荧光染色在以每孔104个细胞密度接种于24孔板。细胞经PBS清洗甲醇固定,5%BSA封闭,兔抗横纹肌肌动蛋白(1∶200)和TRITC标记的山羊抗兔IgG(1∶100)。细胞核用Hoechst 33258染色,成像使用激光共聚焦显微镜(FV1000S-SIM/IX81,Olympus)。
1.2.3 实时定量聚合酶链反应:按照日本TaKaRa公司说明书,采用Trizol处理剪碎的组织并提取总RNA,根据日本TaKaRa公司逆转录试剂盒说明书进行逆转录。应用日本TaKaRa RR420A试剂盒来研究HIF-1α的表达,反应条件为:95℃预变性30 s;95℃5 s,60℃30 s,40个循环,HIF-1α上游引物为5′-TTGAAGATGTCCCGTTGTA-3′;下游引物为5′-GTGACTCTGGGCTTGACTCTA-3′。内参GAPDH上游引物为5′-GGCACAGTCAAGGCTGAGAATG-3′;下游引物为5′-ATGGTGGTGAAGACGCCA-3′。超纯水代替cDNA作为对照。PCR产物的质量监控PCR扩增后的熔融曲线分析。目的基因的表达量通过2-ΔCt方法进行统计。
1.2.4 免疫印迹:细胞在裂解液中充分裂解,于冰上静止15 min后12 000g离心30 min。蛋白含量通过紫外分光光度计检测(UV3103 PYE UNICAM),每个样本上样量40 μg,配置10%聚丙烯酰胺凝胶,煮样后电泳、PVDF膜转膜、5%脱脂牛奶封闭1 h,HIF-1α一抗(1∶100)、BAX一抗(1∶200)、GAPDH为内参(1∶1000),4℃孵育过夜。洗膜后,以二抗(1∶5 000)室温孵育,清洗后ECL发光,应用Quantity One软件计算光密度值。
1.2.5 MTT检测:MTT 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,Sigma,美国)来检测二氯化钴(Sigma,美国)处理的肌细胞。细胞经过0.05%的胰蛋白酶消化并计数,以每孔100 μL 5 000个细胞铺至96孔板中过夜。细胞给予氯化钴不同浓度(0、50、100、200、400 μmol/L)和不同时间(0 h、4 h、8 h、12 h、24 h),加入20 μL MTT(每毫升5 mg溶于PBS)于37℃培养4 h。随后除去培养基,每孔加入100 μL二甲基亚砜10 min,使结晶物溶解。酶标仪检测各孔OD值(检测波长570 nm)。
1.3 数据统计学分析
2 结果
2.1 原代骨骼肌细胞的培养及鉴定
倒置显微镜下观察原代骨骼肌细胞,培养3~4 d后开始有细胞逐渐爬出,随后开始增生,细胞逐渐延展成梭形(图1A)。细胞逐渐增多并相互融合,按一定方向呈有序排列(图1B)。我们利用横纹肌肌动蛋白进行免疫荧光染色,胞质染成红色,表明培养的为骨骼肌细胞(图1C)。

图1 原代骨骼肌细胞的培养Fig.1 Primary culture of primary skeletal muscle cell
2.2 氯化钴对原代骨骼肌细胞存活及凋亡的影响
MTT结果显示,终浓度为200 μmol/L CoCl2培养不同时间后,骨骼肌细胞存活率随着时间延长而降低;在不同浓度处理后,骨骼肌细胞的凋亡率也随着浓度的增加而增加。同样,免疫印迹发现促凋亡蛋白BAX也具有相同的趋势(图2,P<0.05)。

图2 经氯化钴处理的骨骼肌细胞活力Fig.2Cell viability of skeletal muscle cell subjected to CoCl2treatment
2.3 氯化钴对原代骨骼肌细胞HIF-1α的影响
经200 μmol/L CoCl2处理0、4、8、12和24 h,发现HIF-1α基因和蛋白水平上逐渐升高;同样地,HIF-1 α基因和蛋白表达增高与CoCl2浓度正相关(图3、4,P<0.05)。
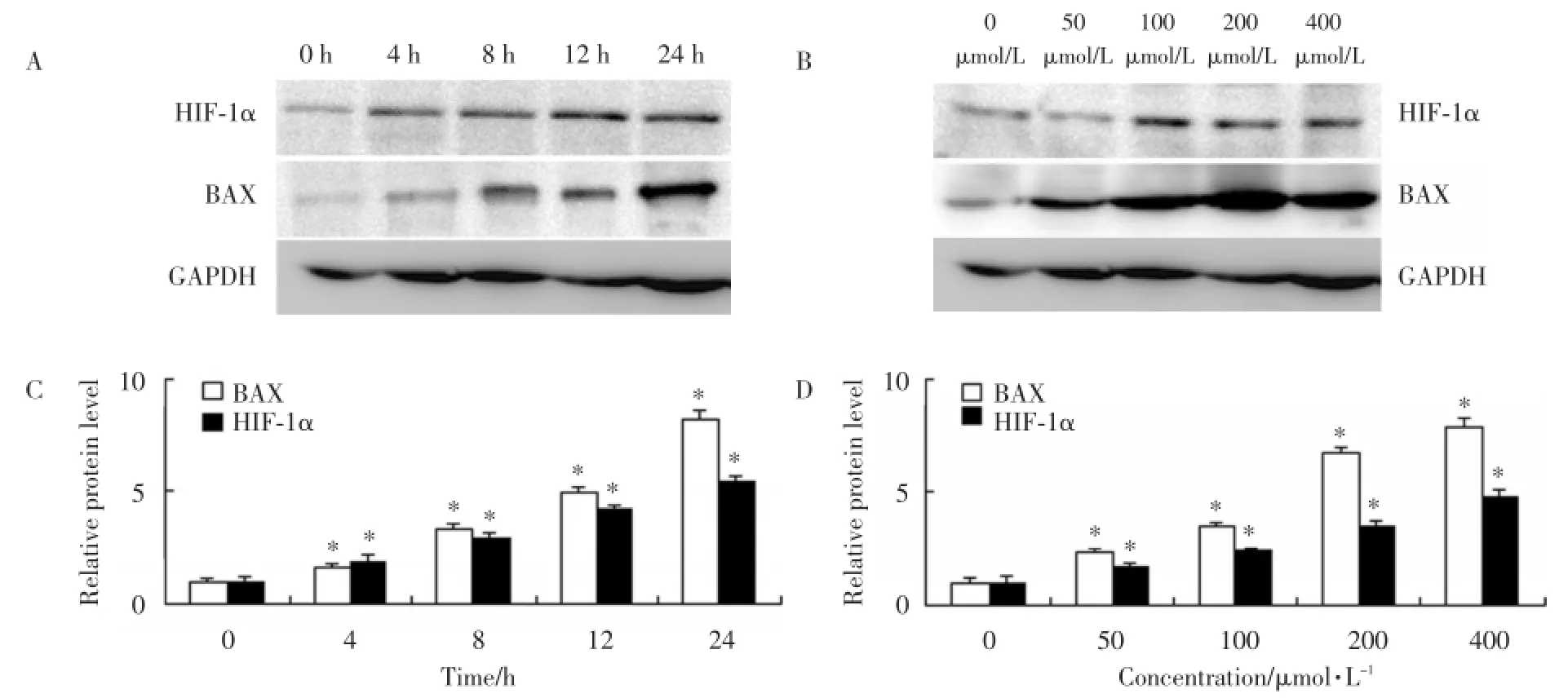
图3 氯化钴对HIF⁃1a和BAX蛋白表达的影响Fig.3Effect of CoCl2on HIF⁃1a and BAX protein expression

图4 氯化钴对HIF⁃1αmRNA表达的影响Fig.4Effect of CoCl2onHIF⁃1αmRNA expression
3 讨论
目前国内各实验室广泛使用简易密封舱模拟缺氧模型,不足之处是不能控制缺氧程度,不便于观察氧分压,而且不便于控制温度,通入的气体未经过滤,有污染的危险性。氯化钻模拟缺氧是国际上比较常用的模拟缺氧的方法,钴离子能竞争氧感受器—血红蛋白卟啉环中的铁离子,抑制氧合血红蛋白的形成而丧失与O2结合的能力,诱发一系列类似缺氧反应,从而模拟缺氧状态[2]。有研究表明经过氯化钴处理后而引起的一系列基因变化与缺氧微环境的影响是相似的,可能是经过相同的信号转导途径来调控,包括一些基因转录水平的变化,如HIF-1α、p53、p21和PCNA。而目前已经证实在维持氧平衡的调节中,HIF-1α是一个主要的调节因子,能在基因转录水平调节细胞对缺氧的适应性[3]。
本研究观察氯化钴对原代培养骨骼肌细胞凋亡的影响及HIF-1α的表达变化,结果显示与对照组比较,经CoCl2处理的细胞存活率明显下降(P<0.05),凋亡率明显增加(P<0.05),且肌细胞存活率下降程度及细胞凋亡率增加程度均随CoCl2浓度增加和时间延长而逐渐升高,免疫印迹显示促凋亡蛋白BAX具有逐渐升高的趋势反映CoCl2对骨骼肌细胞凋亡作用。有趣的是,HIF-1α基因和蛋白水平亦随CoCl2浓度升高和时间延长而增加。尽管CoCl2介导HIF-1α蛋白稳定的机制还没有完全阐明,但普遍认为氯化钴是HIF-1α的非缺氧激活的一种方式,其一机制是金属钴离子取代脯氨酸羟化酶催化中心的亚铁离子,抑制脯氨酸残基的羟化作用,同时氯化钴影响抑癌基因产物pVHL而抑制pVHL与HIF-1 α之间的相互作用[4],二种机制均是使HIF-lα不被泛素化及其在蛋白酶体中的降解而变得稳定,表达因而增加。
而凋亡的发生主要是由内在(线粒体)通路引起线粒体膜高通透性,不仅是线粒体呼吸链活性的丧失,导致细胞色素C释放而诱导凋亡[5]。本实验同样证实以往研究,氯化钴诱导缺氧与多种细胞增殖和凋亡密切相关,以及凋亡相关因子表达的显著变化。HIF-1α为缺氧应答的全局性调控因子,在缺氧诱导的哺乳动物细胞中广泛表达,对缺氧具有特异感受性,参与体内许多缺氧反应性基因的转录调节,在低氧性介导的细胞凋亡中有着重要的作用。然而,HIF-1α是否刺激细胞凋亡或抗凋亡,这一结论还不清楚。不同的研究得出不同结论[6~8]。一些数据显示过表达HIF-1α能够显著抑制Mdm2阻止泛素化稳定p53进而促进凋亡[8]。相反的,关于HIF-1α抗凋亡的作用,还有学者发现过表达HIF-1α能够降低缺氧所引起的细胞凋亡,在低氧应激中发挥抗凋亡蛋白的作用[10]。因此HIF-1α与凋亡之间相互作用仍需要进一步研究,但我们可以肯定的是,HIF-1α在缺氧组织发生凋亡失调中发挥重要作用,
总之,CoCl2化学模拟低氧过程中伴随着对细胞增殖和凋亡的复杂影响,也影响缺氧主要调节因子HIF-1α蛋白水平,因此以氯化钴用于构建模拟原代骨骼肌细胞缺氧诱导模型是可行的。
[1]Grasselli F,Basini G,Bussolati S,et al.Cobalt chloride,a hypoxiamimicking agent,modulates redox status and functional parameters of cultured swine granulosa cells[J].Reprod Fertil,2005,17(7):715-720.
[2]Vengellur A,Woods BG,Ryan HE,et al.Gene expression profiling of the hypoxia signaling pathway in hypoxia-inducible factor 1alpha null mouse embryonic fibroblasts[J].Gene Expr,2003,11(3-4):181-197.
[3]Semenza GL.HIF-1 and human disease:one highly involved factor[J].Genes Dev,2000,14(16):1983-1991.
[4]Yuan Y,Hilliard G,Ferguson T,et al.Cobalt inhibits the interaction between hypoxia-inducible factor-alpha and von Hippel-Lindau protein by direct binding to hypoxia-inducible factor-alpha[J].J Biol Chem,2003,278(18):15911-15916.
[5]Brenner D,Mak TW.Mitochondrial cell death effectors[J].Curr Opin Cell Biol,2009,21(6):871-877.
[6]Liu XH,Kirschenbaum A,Yao S,et al.Up-regulation of vascular endothelial factor by cobalt chloride-simulated hypoxia is mediated by persistent induction of cyclooxygenase-2 in metastatic human prostate cancer cell line[J].Clin Exp Metastasis,1999,17(8):687-694.
[7]Gwak GY,Yoon JH,Kim KM,et al.Hypoxia stimulates proliferation of human hepatoma cells through the induction of hexokinaseⅡexpression[J].J Hepatol,2005,42(3):358-364.
[8]Zhang B,Guo W,Yu L,et al.Cobalt chloride inhibits tumor formation in osteosarcoma cells through upregulation of HIF-1α[J].Oncol Lett,2013,5(3):911-916.
[9]Chen DL,Li MY,Luo JY,et al.Direct interactions between HIF-1 alpha and Mdm2 modulate p53 function[J].J Biol Chem,2003,278(16):13595-13598.
[10]Yu EZ,Li YY,Liu XH,et al.Antiapoptotic action of hypoxia-inducible factor-1 alpha in human endothelial cells[J].Lab Invest,2004,84(5):553-561.
(编辑裘孝琦)
Construction ofa New Modelfor SkeletalMuscle CellHypoxia Using Cobalt Chloride
LIXi,XINShi-jie,WANGLei,SONGZe,JINGYu-chen,CAO Hui,DUANZhi-quan,ZHANGJian
(DepartmentofVascularand Thyroid Surgery,GeneralSurgery Department,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo investigate the effect of cobalt chloride on primary cultured skeletal muscle cells and explore the reasonable strategy of simulation chemical hypoxia by using CoCl2.MethodsPrimary skeletal muscle cells were isolated and cultured via tissue explants adhesion method,and identified by immunofluorescence assay.Cells were then incubated with different concentration of cobalt chloride for different time length,and the cellapoptosiswas detected respectively.Immunoblotting and qRT-PCR were used to determine the mRNA and protein levels ofHIF-1α and BAX.ResultsCompared with control group,cell survival rate was significantly decreased(P<0.05),and apoptotic rate was markedly increased in cells treated with CoCl2(P<0.05).Moreover,the effects were positively correlated with the increasing concentration and exposure time of CoCl2.ConclusionEffect of CoCl2on the primary skeletal muscle cells proliferation and apoptosis is dose and time-dependent.An in vitro hypoxia model ofskeletalmuscle cellwassuccessfully established,which could be a good modelforinvestigating ischemia/hypoxia on skeletalmuscle cells.
cobalt chloride;skeletal muscle cell;apoptosis;hypoxia inducible factor 1α
R654.3
A
0258-4646(2014)03-0265-04
国家自然科学基金(81170295)
李晰(1986-),男,博士研究生.
辛世杰,E-mail:sjxin@mail.cmu.edu.cn
2013-12-12
网络出版时间:
