抑郁模型大鼠海马齿状回神经干细胞增殖的研究
2014-03-21吴翊馨苏胜林张海平单德红
吴翊馨,苏胜林,张海平,单德红
(1.沈阳体育学院运动人体科学学院生理教研室,沈阳110032;2.辽宁中医药大学中西结合基础专业,沈阳110847)
抑郁模型大鼠海马齿状回神经干细胞增殖的研究
吴翊馨1,苏胜林1,张海平1,单德红2
(1.沈阳体育学院运动人体科学学院生理教研室,沈阳110032;2.辽宁中医药大学中西结合基础专业,沈阳110847)
目的评价抑郁状态下海马神经再生能力。方法20只Wistar大鼠随机分为对照组和抑郁症模型组(模型组),复制慢性不可预见性应激模型。观察大鼠体质量和行为学变化,放免法检测血浆促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH)和皮质酮(CORT)水平,光镜及电镜技术观察海马CA3神经元形态学变化,免疫组化和原位杂交技术检测海马齿状回巢蛋白(Nestin)及其mRNA表达。结果与对照组相比,模型组大鼠的体质量及其增长率下降,行为学得分减少,血浆CRH、ACTH和CORT显著升高,海马CA3神经元出现结构损伤,海马Nestin及其mRNA表达增加。结论抑郁状态下海马神经再生能力上升。
抑郁症;海马;神经再生;慢性应激;巢蛋白
目前认为,抑郁症主要是由于长期负性情绪和不良生活处境等慢性应激刺激引起,近70%患者存在由于下丘脑-腺垂体-肾上腺皮质(hypothalamicpituitary-adrenal axis,HPA)轴功能亢进所引起的海马损伤现象[1],因此对抗慢性应激、保护或修复海马受损神经元就成为抗抑郁的一个重要策略。在海马齿状回的颗粒细胞层下区存在相当数量的神经干细胞,在适宜环境中能够发育成神经元,这就使修复海马受损功能成为可能[2],但抑郁状态下这种现象呈现何种变化,目前尚不完全清楚。本实验主要通过复制大鼠慢性不可预见性应激模型,观察抑郁状态下海马的神经再生状态,为从神经再生方面开展抗抑郁工作奠定基础。
1 材料与方法
1.1 实验动物分组
20只雌性Wistar大鼠,随机分为对照组和抑郁症模型组(模型组),室温20~24℃,湿度40%~40%,光照时间12 h。适应性饲养1周后开始实验。
1.2 抑郁症模型的建立
模型组大鼠参考文献[3]的方法,复制慢性不可预见性应激模型,即大鼠单笼饲养,在21 d内接受各种未预知刺激,包括束缚1 h,禁食24 h,禁水24 h,4℃冷水游泳4 min,44℃烘箱热烘4 min,夹尾1 min,电击足底2 min(电压为30 V,4 s,间歇4 s),共7种刺激,21 d内每日随机给予1种,每种刺激在实验全程中施加3次。
1.3 大鼠体质量、行为学检测
于建模前、后检测。行为学检测采用旷场实验法,利用泰盟TM-Vision行为学实验系统,观察其运动轨迹及3 min内水平运动和垂直活动得分。
1.4 血浆促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、皮质酮(corticosterone,CORT)水平的检测
采用放免法检测。在第21天,大鼠腹腔注射20%乌拉坦(0.4 mL/100 g)麻醉后,腹主动脉取血,注入含肝素钠的试管中,离心后取血浆,低温冷藏,按试剂盒说明书操作检测。
1.5 海马神经元形态学观察
[4]的方法取海马,其中部分用于光镜,部分用于电镜,观察海马神经元的形态学变化。
1.6 Nestin及其mRNA表达
参考文献[4]的方法,利用免疫组化方法检测Nestin表达,染色对照用正常山羊血清和PBS代替Nestin一抗孵育,原位杂交技术检测NestinmRNA表达,阴性对照用0.4 mol/L的PBS代替一抗。利用BI-2000医学图像分析系统计算平均光密度值。
1.7 统计学方法
2 结果
2.1 大鼠体质量变化
建模前2组大鼠的体质量无明显差异,建模后模型组大鼠的体质量及其增长率均显著低于对照组(P<0.01)。见表1。

表1 大鼠体质量和行为学得分变化Tab.1 Changes of body mass and behavior scores of rats
2.2 大鼠行为学变化
对照组大鼠进入检测箱后,均迅速离开中心区域,在箱体四周进行搜索,其水平和垂直活动得分较高(图1A,表1)。模型组大鼠进入检测箱后,虽然也是沿四周进行搜索,经常通过中心区域,其水平和垂直活动得分均显著低于对照组(图1B,表1)。

图1 典型大鼠活动轨迹Fig.1 Typical motion tracks of rats
2.3 大鼠血浆CRH、ACTH和CORT水平
模型组大鼠的CRH、ACTH和CORT水平均显著高于对照组(P<0.01)。见表2。
2.4 大鼠海马CA3神经元形态学变化
光镜下,对照组大鼠CA3区神经元排列整齐,层次丰富(图2A),而模型组则层次减少,大量细胞坏死(图2B)。电镜下,对照组神经元的细胞器正常,细胞核呈圆形,核膜清晰完整,染色质分布均匀(图2C);模型组大鼠神经元的细胞器减少,线粒体空泡化,细胞核变小,不规则,核膜增厚(图2D)。
2.5 大鼠海马Nestin及其mRNA表达
Nestin免疫反应阳性产物呈棕黄色,模型组镜下阳性反应物较多,边缘清楚(图3)。模型组和对照组Nestin平均光密度值分别为74.36±28.43和44.28±17.04,NestinmRNA表达水平分别为41.84± 21.46和32.61±14.90,模型组Nestin及其mRNA表达均高于对照组(均P<0.01)。
3 讨论
海马神经元损伤是抑郁症的常见病理变化,主要与慢性应激有关,如工作学习压力大、生活节奏过快等,相似的结果也在动物实验中得到证实[6,7]。海马神经再生现象的发现为修复海马功能提供了研究方向,但慢性应激对海马神经再生的影响目前还不甚清楚。

表2 大鼠CRH、ACTH和CORT水平Tab.2 CRH,ACTH and CORT levels of rats
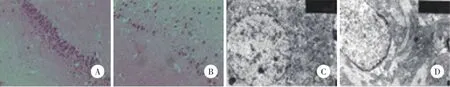
图2 光镜和电镜下观察2组大鼠CA3神经元Fig.2 Observation of CA3 neurons in the rats of 2 groups
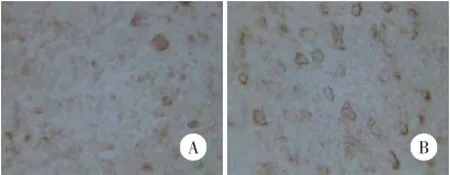
图3 2组大鼠Nestin表达×400Fig.3 Nestin expression in the rats of 2 groups×400
3.1 抑郁症模型大鼠的整体表现
为开展相关研究,本实验首先建立了大鼠慢性不可预见性应激模型。相关检测结果显著,经过21 d的慢性应激刺激,模型组大鼠的体质量及其增长率、行为学得分均显著低于对照组。首先,体质量及其增长率显著下降,反映了大鼠的营养状态下降,这主要是大鼠饮食减少的结果,与抑郁症患者出现的食欲下降、体质量降低相似;其次,模型组大鼠在箱体中搜索时过多通过中心强光区域,且水平和垂直活动得分也明显降低,提示经过慢性应激刺激,模型组大鼠出现活动减少、反应迟钝、对外界事物关注度降低和探索行为减少等症状,这与抑郁症患者极为相似。这些现象提示,模型组大鼠已出现了人类抑郁症的相关表现,可以以此为载体开展相关研究。
3.2 抑郁症HPA轴亢进与海马神经元损伤
HPA轴是人体重要的内分泌轴,由下丘脑、腺垂体和肾上腺皮质分别释放的CRH、ACTH和糖皮质激素组成,在应激反应中发挥重要调节作用。HPA轴功能亢进是抑郁症的突出特征,患者常出现CRH分泌亢进、ACTH基础分泌过高和肾上腺皮质对ACTH反应过高等现象。本实验结果显示,模型组大鼠的CRH、ACTH和CORT均高于对照组,说明在慢性应激刺激下,大鼠的HPA轴处于亢进状态,这与文献结果相同[8]。
慢性应激会持续兴奋HPA轴,继而导致海马神经元过度兴奋而出现损伤。本实验观察到,模型组出现HPA轴亢进的同时,其海马CA3区出现了细胞层次减少、细胞大量坏死和细胞器减少、线粒体破坏、细胞核异常等变化,与相关报道相似[4]。由于海马功能涉及了情绪产生、学习记忆和内脏功能调节等众多方面,因此其结构损伤必然导致机体出现一系列异常。
3.3 抗抑郁与海马齿状回神经再生
现代社会的工作压力大、生活节奏快,为了生存人们难以摆脱这种社会应激,因此抑郁症发病率急剧升高。而确诊为抑郁症后,又因为工作和生活压力难以完成系统治疗,造成抑郁症反复发作,海马损伤日渐加重。研究发现,海马损伤程度与抑郁症的病变程度呈正相关[9]。因此,修复海马就成为抗抑郁的重要环节。
成年哺乳动物海马的齿状回处存在神经干细胞,能够增殖分化生成新的神经元,迁移至颗粒细胞层,与CA3区神经元建立突触联系。这就使修复受损伤的海马功能成为可能,但抑郁状态下这种现象是否仍然存在、程度如何,目前尚不十分清楚。
本实验以Nestin及其mRNA为指标,对海马的再生能力进行评价。结果显示,对照组大鼠齿状回处有少量Nestin及其mRNA表达,提示生理状态下大鼠海马存在神经再生,但并不显著;而模型组齿状回处的Nestin及其mRNA表达均显著上升,结果与相关报道类似[4,10],说明抑郁状态下海马的再生能力增强,提示海马仍然具备相当的自我修复能力,这就为通过促进海马神经再生来抗抑郁带来了希望。不过值得提出的是,Nestin及其mRNA表达增加,并不表示海马的神经干细胞最终能够发育成所需的神经元,这中间还需要适当的内环境因素诱导。而抑郁状态下,海马神经再生的内环境出现了何种变化、如何利用、从而为抗抑郁服务,还存在许多未知,需要在以后的工作中进行深入研究。
参考文献:
[1]Wang Z,Neylan TC,Mueller SG,et al.Magnetic resonance imaging of hippocampal subfields in posttraumatic stress disorder[J].Arch Gen Psychiatry,2010,67(3):296-303.
[2]Hattiangady B,Shetty AK.Neural stem cell grafting counteracts hippocampal injury-mediated impairments in mood,memory,and neurogenesis[J].Stem Cells Transl Med,2012,1(9):696-708.
[3]单德红.定志小丸的抗抑郁机制研究[J].北京中医药大学,2004,6(16):239-246.
[4]阎醒予,柴瑞华,单德红,等.定志小丸对雌性抑郁模型大鼠海马结构的影响[J].中国中医药信息杂志,2008,4(23):43-44.
[5]柴纪严,单德红,王德山,等.定志小丸对抑郁模型大鼠海马神经干细胞Nestin表达的影响[J].中国中医药信息杂志,2004,4(44):29-30.
[6]孙晓红,孟秀君,徐枫,等.米氮平对抑郁症大鼠海马凋亡相关蛋白表达的调节作用[J].中国医科大学学报,2012,41(1):8-10.
[7]孔令韬,吴枫,汤艳清,等.氟西汀和噻奈普汀对慢性应激抑郁模型大鼠海马Bcl-2表达的影响[J].中国医科大学学报,2012,41(7):484-487.
[8]陈宝忠,姚丹,于鸿飞,等.归脾汤对抑郁模型大鼠血中ACTH及CORT含量的影响[J].中医药学报,2010,4(27):19-21.
[9]Sala M,Perez J,Soloff P,et al.Stress and hippocampal abnormalities in psychiatric disorders[J].Eur Neuropsychopharmacol,2004,14(4):393-404.
[10]闫醒予,王德山,单德红,等.定志小丸对雌性抑郁大鼠雌二醇和齿状回神经干细胞的影响[J].中国实验方剂学杂志,2007,6(12):43-44.
(编辑 陈姜)
Proliferation Study of HippocampalNeuralStem Cellsin Dentate Gyrusof Depressed ModelRats
WUYi-xin1,SU Sheng-lin1,ZHANGHai-ping1,SHAN De-hong2
(1.Physiology Teaching and Research Section,Institute of Human Movement Science,Shenyang Sport University,Shenyang 110032,China;2.Combination of Chinese and Western Based Professional,Liaoning University ofTraditionalChinese Medicine,Shenyang 110847,China)
ObjectiveTo evaluate the hippocampal neurogenesis in depression.MethodsA total of 20 Wistar rats were randomly divided into control and depression group(model group).Chronic unpredicted stress model was established.Body mass weigh and behavioral scores of the rats were observed.Radioimmunoassay was used to measure plasma concentrations of corticotropin releasing hormone,adrenocorticotropic hormone and cortisone.Light and electron microscope were used to detect the morphological change of hippocampal CA3 neurons.Immunohistochemistry and in situ hybridization were used to detectboth protein and mRNA expressions ofNestin in hippocampaldentate gyrus.ResultsCompared with the control group,rats in the model group,both body mass weigh and the related increase rate were markedly decreased,and the behavioral scores were reduced significantly.In addition,neuraldamage wasobserved in hippocampalCA3 neurons,and the Nestin expressions in hippocampaldentate gyrus were evidently increased.ConclusionHippocampalneurogenesis was increased in depression.
depression;hippocampal;neurogenesis;chronic stress;Nestin
R363
A
0248-4646(2014)04-0347-04
吴翊馨(1973-),女,副教授,博士研究生. E-mail:yixin0414@163.com
2013-10-29
网络出版时间:
