硫氧还蛋白f介导的烟草Rubisco活化酶的氧化还原调控
2014-03-20马为民陈根云米华玲
孙 逸,陈 娟,马为民,陈根云,米华玲
(1. 上海师范大学 生命与环境科学学院,上海 200234;2. 中国科学院 上海生命科学研究院植物生理生态研究所,上海 200032)
0 引 言
Wildman和Bonner 于1947年发现了核酮糖-1,5-二磷酸羧化/加氧酶(Rubisco),它普遍存在于所有自养生物中.Rubisco位于高等植物叶绿体的基质内,在基粒片层区域有少量的分布[1-2].在植物体内并不是所有的Rubisco都具有催化活力,它的光活化需要Rubisco活化酶(Rubisco activase,RCA)来参与[3-4].
RCA是一种核编码的有6个亚基组成的可溶性蛋白[5],植物RCA只在绿色组织中表达.它通常由α(较大)、β(较小)两种亚型组成,亚型的种类及其含量因植物种类不同而有很大变化,如在拟南芥、菠菜、大麦、水稻、棉花和小麦等植物中,RCA含有两种亚型,而在烟草、玉米和衣藻中仅含有一种小亚型.RCA的两个亚型通常是由一个核基因编码的,通过选择性剪接前体mRNA形成,并且两个亚型只在羧基端有差异.但是棉花的RCA的两个亚型是由两个核基因编码的[6].大麦RCA的两个亚型可以由一个核基因编码,但其小亚型还可以被另一个基因编码[7].RCA的两个亚型都具有活化Rubisco的活性,但只有大亚型RCA的氧化还原状态通过硫氧还蛋白f(Trx-f)的介导受体内氧化还原状态的调节,从而引起其活力的变化[8].
硫氧还蛋白(Thioredoxin,Trx)是一类广泛存在于生物体内的多功能酸性蛋白,分子量约12 kDa左右,参与细胞一系列生化反应,包括酶活性的调节、转录因子的调控等[9-12],是酶活力的一个重要调节蛋白.其功能绝大多数依赖于Trx对靶蛋白中的二硫键还原.所有硫氧还蛋白均有一个保守的活性中心:rp-Cys-Gly(Ala)-Pro-Cys,活性中心有2个具有氧还活性的半胱氨酸残基.相邻的两个半胱氨酸可以在分子内部形成二硫键.按电子供体和还原Trx的酶,植物Trx可分为两个系统:即铁氧还蛋白/ 铁硫蛋白还原酶/ 硫氧还蛋白系统 (FTR/ Trx系统) 和NADPH/ NADP+/硫氧还蛋白还原酶/ 硫氧还蛋白系统(NTR/ Trx系统).其中FTR/ Trx系统位于叶绿体中,由铁氧还蛋白(Ferredoxin)、铁硫蛋白还原酶(FTR)和两个由核编码的Trx-m和Trx-f组成,调控参与碳代谢等生化过程一些酶的活性,比如RCA[13-14].Zhang 和Portis 等认为RCA的氧化还原状态的改变是体内的氧化还原物质,如GSH,GSSG等,通过Trx-f介导首先改变大亚型的氧化还原状态[15],然后大亚型RCA可能通过多聚体的各亚型间的相互作用来改变小亚型的活性[8].其中拟南芥的大亚型C-末端的两个Cys残基在受Trx-f的调节中起关键作用,C-末端的一个或两个Cys残基用丙氨酸取代,则转基因植物中的Rubisco的活性不会因光强变弱而下调,而小亚型RCA缺乏这一含Cys残基的C-末端.但很多植物,如烟草等,只有小亚型RCA,缺乏大亚型末端的半胱氨酸,因此Zhang 和Portis 等认为体内氧化还原状态改变不能影响只有小亚型的RCA的活力,但他们也指出以往大量实验证据证明烟草等只有小亚型RCA物种的Rubisco活力在不同光强下其活力有明显的差异,表明这些物种的Rubisco活力也是受光引起的叶绿体内氧化还原状态的调控,因此人们一直在探索烟草等植物体内氧化还原状态变化影响Rubisco活力的机制,然迄今没有任何相关新的研究报道.
通过在菠菜和烟草Trx-f存在条件下,不同氧化还原状态处理双亚型和单亚型RCA后其活化Rubisco活力的体外测定,本文作者发现通过Trx-f介导也能改变单亚型RCA的氧化还原状态,从而影响其活力,而且Trx-f介导的RCA氧化还原的调控存在明显的种属差异性.这对RCA活力的氧化还原调控研究提供了新的思路.
1 实验材料与方法
1.1 植物材料
烟草(Nicotianatabacum)、菠菜(SpinaciaoleraceaL)、番茄(Solanumlycopersicum)和拟南芥(Arabidopsisthaliana)种植于中国科学院上海植物生理生态研究所人工气候室.培养条件为:28/20℃,光通量电子密度(PPFD)约600 μmol·m-2·s-1,12 h光/12 h暗.烟草ΔndhCKJ突变体由T.shikanai博士提供[16].
1.2 烟草与菠菜Trx-f的分离纯化
烟草与菠菜Trx-f的分离纯化参照Wolosiuk等的方法进行[17].得到的Trx-f保存于65%硫酸铵沉淀悬浮液中.
1.3 Rubisco的初始活力测定
参考Van de Loo等的方法[18],光下取得的叶圆片分别置于培养皿,将培养皿置与0~500 μmol·m-2·s-15个不同光强下处理60 min.处理结束后叶圆片用液氮速冻.将样品在液氮中快速研磨成粉末.加入预冷到4 ℃ 400 μL蛋白提取液(50 mmol·L-1Tris-Cl,pH 8.0,50 mmol·L-1NaCl,2 mmol·L-1EDTA,4 mmol·L-1巯基乙醇),充分研磨.13000 r·min-1,4 ℃ 离心2 min,收集上清液,马上用于活力测定,并用Bradford法进行蛋白定量[19].
预先配制Rubisco活力测定的反应体系.如下:50 mmol·L-1Tris-HCl pH 8.2,10 mmol·L-1MgCl2,10 mmol·L-1NaHCO3,0.4 mmol·L-1RuBP ,0.1 mmol·L-1EDTA.最后加入适量的(1∶100) NaH14CO3.
1.4 烟草、拟南芥、菠菜、番茄叶片RCA的分离与纯化
新鲜叶片马上经液氮速冻后磨碎,加入蛋白提取液(50 mmol·L-1Tris-HCl (pH 7.8),1 mmol·L-1EDTA,50 mmol·L-1NaCl,0.1% β-mercaptoethanol,1% PVPP(polyvinylpyrrolidone,SERVA),0.5 mmol·L-1phenylmethylsulphonyl fluoride (PMSF),protease inhibitor cocktail for plants (Sigma,P9599))混匀,提取物经过离心后(10000 r·min-1/10 min)取上清,加入硫酸铵至终浓度为35%饱和度,12000 r·min-1离心10 min,去上清.沉淀用适量缓冲液(20 mmol·L-1Tris,pH 7.0,20 mmol·L-1NaCl,0.1% β-mercaptoethanol,1 mmol·L-1EDTA,0.4 mmol·L-1ATP,5 mmol·L-1phenylmethylsulphonyl fluoride (PMSF),protease inhibitor cocktail for plants (Sigma),溶解,离心(12000 r·min-1/5 min)后弃沉淀.蛋白纯化在 Pharmacia FPLC system上完成,将脱盐柱(Sephadex G-25)和弱阴离子交换柱 (DEAE-650) 串联.先用70 mmol·L-1NaCl,20 mmol·L-1Tris-HCl (pH 8.0) 洗脱杂蛋白,之后用150 mmol·L-1NaCl,20 mmol·L-1Tris-HCl (pH 8.0) 洗脱Rubisco 活化酶,分管收集,收集含RCA的部分,加入 protease inhibitor cocktail for plants (Sigma,P9599),0.1 mmol·L-1ATP和10%的甘油,保存在液氮中.
1.5 烟草、拟南芥、菠菜、番茄叶片Rubisco的分离和纯化
新鲜叶片马上经液氮速冻后磨碎,加入蛋白提取液(50 mmol·L-1Tris-HCl (pH 7.8),1 mmol·L-1EDTA,50 mmol·L-1NaCl,0.1% β-mercaptoethanol,1% PVPP,0.5 mmol·L-1phenylmethylsulphonyl fluoride (PMSF))混匀,提取物经过离心后(10000 g/10 min)取上清加入硫酸铵粉末至终浓度为35%饱和度,冰上放置0.5 h后离心(10000 r·min-1/10 min),取上清加入硫酸铵粉末至终浓度65%饱和度,冰上放置0.5 h后离心(10000 r·min-1/10 min).沉淀用适量缓冲液(20 mmol·L-1Tris,pH7.0,20 mmol·L-1NaCl,0.1% β-mercaptoethanol,1 mmol·L-1EDTA) 溶解,离心(12000 r·min-1/5 min).蛋白纯化在 Pharmacia FPLC system上完成,将脱盐柱(Sephadex G-25)和弱阴离子交换柱 (DEAE-650) 串联.先用100 mmol·L-1NaCl,20 mmol·L-1Tris-HCl (pH 8.0) 洗脱杂蛋白,之后用200 mmol·L-1NaCl,20 mmol·L-1Tris-HCl (pH 8.0) 洗脱Rubisco.蛋白浓度用Bradford法测定[19].
1.6 RCA的预处理及其活力的测定
RCA氧化还原处理及其活力的测定参照Zhang等方法进行[14],用RCA活化Rubisco的活力代表RCA的活力.以未用DTT处理的对照为100%.
1.7 烟草叶片光系统II激发压(1-qL)与净光合速率的测定
烟草叶片光系统Ⅱ激发压使用Maxi-imaging-PAM叶绿素荧光仪(IMAGING-PAM chlorophyll fluorometer,Heinz Walz GmbH,Effeltrich,Germany)进行测定.根据湖泊模型进行计算,1-qL=1- (Fm′-F)/(Fm′-Fo′)xFo′/Fs[20].
净光合速率测定用便携式光合气体分析系统Li-COR 6400(LI-COR Inc.Lincoln,Nebraska,U.S.A)光合仪进行.测定方法参见Chen等[21],测定时CO2浓度控制在380 μmol CO2·mol-1.
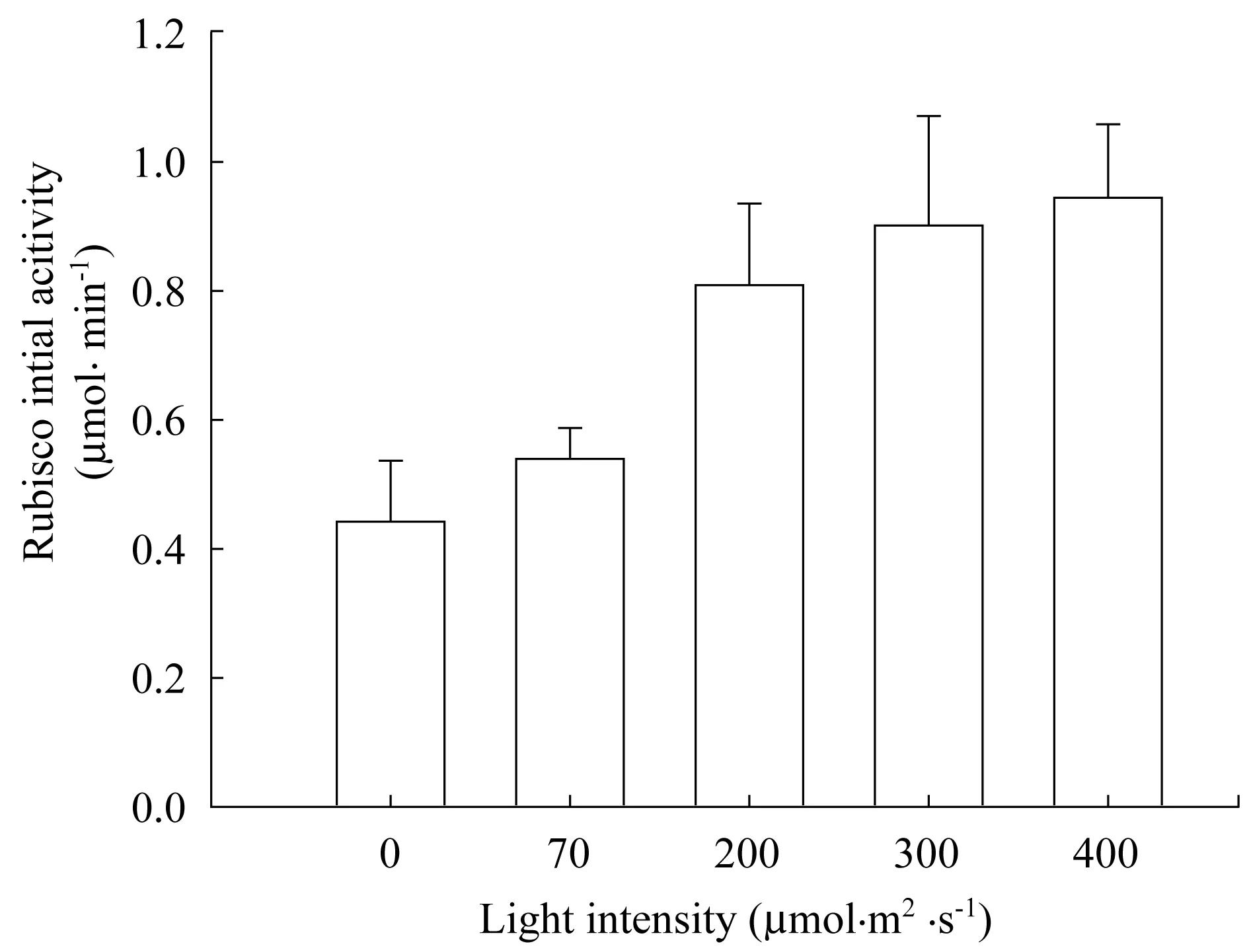
图1 不同光强处理对烟草Rubisco活力的影响横坐标所示数字是叶片处理光强(μmol·m-2·s-1)
1.8 统计分析
利用SigmaPlot 9.0(SPSS.Inc.)软件进行统计分析,用双尾studentt-test分析实验样本间的是否存在显著性差异.
2 实验结果
2.1 烟草Rubisco的初始活力受到氧化还原状态的调控
植物体内碳同化酶的活力普遍受到氧化还原状态的调控,它们的活力对不同光强处理有明显的响应[15].将取自人工气候室光下生长的烟草叶圆片分别在0、70、200、300和400 μmol/m2/s 光强下处理60 min后,提取可溶性蛋白进行Rubisco初始活性测定.结果显示(图1),暗处理(光强为0)的烟草的Rubisco初始活力最低,大约为0.4 mmol·mg-1·min-1,随着处理光强的增加,Rubisco初始活力迅速增加,当光强达到300 μmol·m-2·s-1后,活力上升速率变缓,在光强为400 μmol·m-2·s-1时,Rubisco的初始活力最高,为0.9 mmol·g-1·min-1.处理光强与烟草Rubisco的初始活力存在明显的正相关,这与以往的许多研究结果一致.由于体内Rubisco在ATP存在的条件下由RCA活化,由于Rubisco总量保持不变,其活力的变化反映了RCA的活力变化.在体外RCA的活力与ATP/ADP比值密切相关,然而在正常的生理条件下其比值基本保持恒定[22],而不同光强下电子传递引起的氧化还原状态则有明显的改变[15].从上述结果可以推测烟草RCA与其他双亚型RCA一样,同样受光引起的体内氧化还原状态的调控.
2.2 烟草突变体ΔndhCKJ体内氧化还原状态的改变导致其Rubisco活化状态的改变
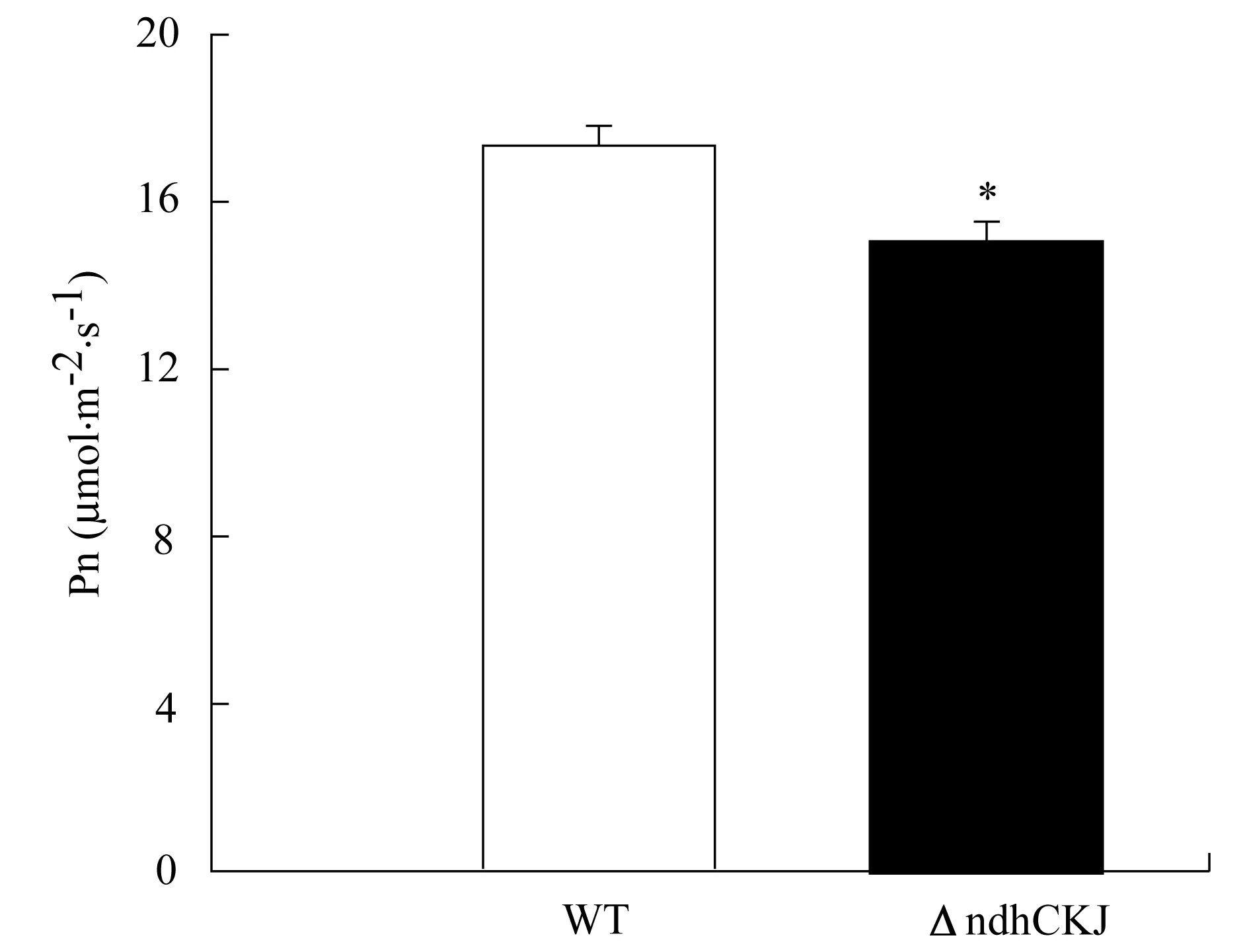
烟草ΔndhCKJ突变体为NDH复合体的ndhC、ndhK和ndhJ 3个亚基基因缺失突变体,与野生型的烟草相比,由于3个亚基的缺失,NDH蛋白复合体的全酶结构破坏,其NDH复合体介导的循环电子传递能力缺失,导致植物体叶绿体内氧化还原状态发生改变.叶绿素荧光参数1-qL(光系统Ⅱ的激发压)可以用来表示叶绿体类囊体膜氧化还原状态的一个指标,光下烟草突变体叶片1-qL显著高于野生型(图2),并随着照光时间的延长其差异越来越明显.这说明野生型和突变体叶绿体内的氧化还原状态在光下有显著的差异.同时,净光合速率测定结果显示突变体叶片的净光合速率为14 μmol·m-2·s-1,显著低于野生型的18 μmol·m-2·s-1(图3).
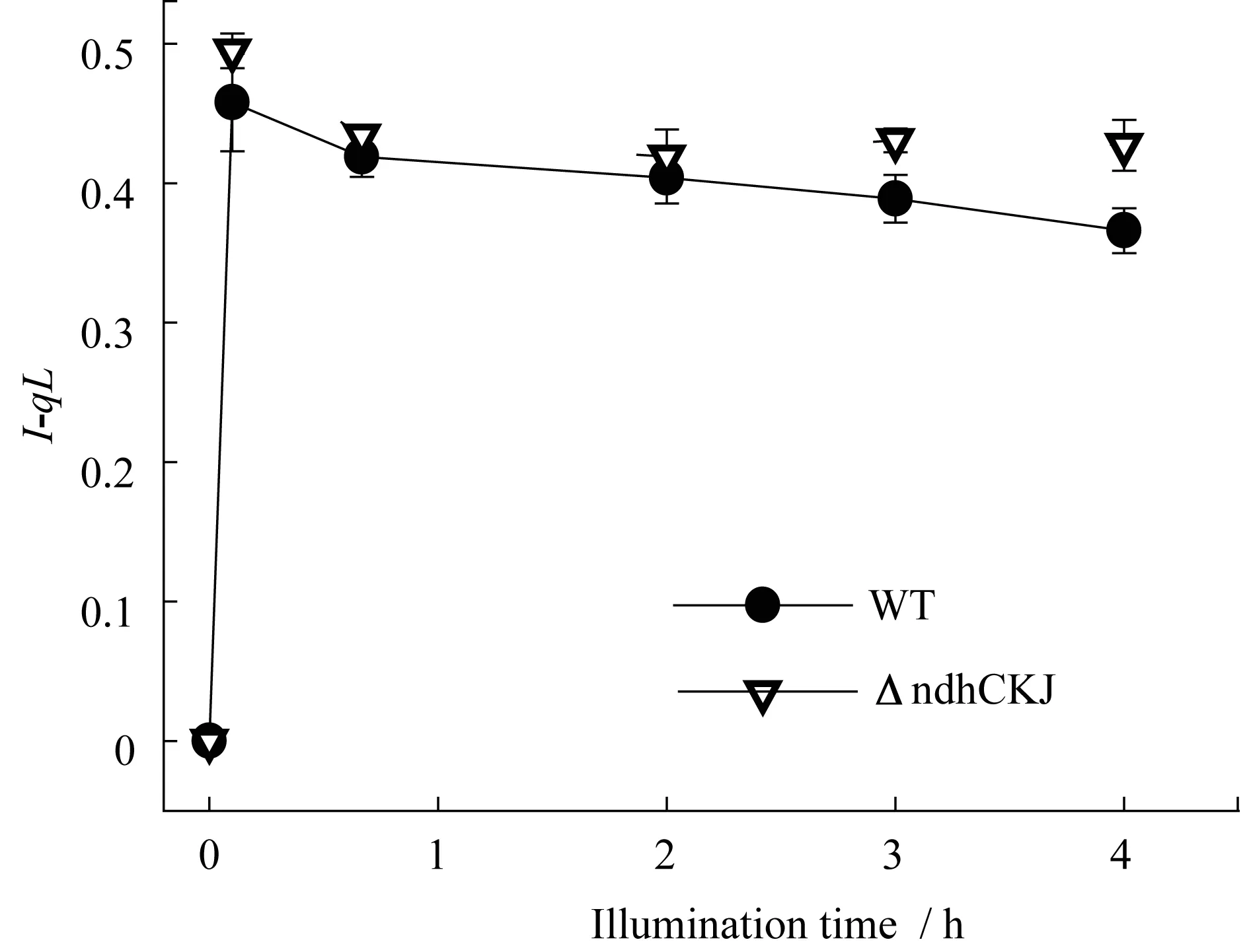
图2 烟草ΔndhCKJ突变体与野生型1-qL的比较
双尾 student t-test,n=8.*表示5%的显著水平.
Rubisco活力测定结果显示(图4),暗中野生型和突变体的Rubisco活化状态没有显著性差异,分别为25%和24%;而光下野生型中68%的Rubsico是活化的,突变体中只有57%;它们的Rubisco活化状态有显著差异.突变体氧化还原状态的改变伴随着Rubisco活化状态的改变进一步说明了烟草Rubisco的活力也是受氧化还原状态调控的.
2.3 不同氧化还原状态下菠菜和烟草Trx-f对单亚型RCA活力的影响
Zhang等[8]利用拟南芥的Trx-f证明了双亚型RCA通过大亚型RCA末端的巯基,感受体内的氧化还原状态信号,从而对RCA活力进行调控;同时他们认为只有小亚型的RCA不受氧化还原调控.然而前面的实验结果表明烟草RCA与其他双亚型RCA一样,其活力同样能受氧化还原状态改变的影响,这里的矛盾是很明显的.由于这是在拟南芥Trx-f或菠菜存在时用DTT/GSSG对烟草的RCA进行处理得到的结果,而拟南芥和菠菜同属于非茄科植物,而烟草属于茄科植物,而RCA具有明显的茄科特异性.因此,在菠菜和烟草Trx-f存在时对烟草RCA进行处理来进行活力的对比测定很有必要.实验结果显示(图5),当菠菜Trx-f存在时,DTT处理对烟草RCA的活力基本没有影响,为未处理对照的102%,这与Zhang等的结果基本一致;而当烟草Trx-f存在时,DTT处理使得烟草RCA活力显著增加,为对照的227%;随后加入等量GSSG抵消DTT的还原效应,烟草RCA 活力又基本回到了初始水平,为对照的98%.上述结果验证了不同光强以及突变体得到的结果,即烟草RCA活力也接受氧化还原状态的调控;而且与Zhang等的报道一致,烟草RCA的氧化还原调控也是Trx-f介导的.Zhang等[8]没有发现烟草RCA接受氧化还原调控的主要原因是因为他们实验中只用了拟南芥/菠菜的Trx-f而没有用烟草的.这结果还暗示着Trx-f介导的RCA氧化还原调控可能与RCA活化Rubisco存在茄科专一性[22]相似,存在某种形式的种属差异性.
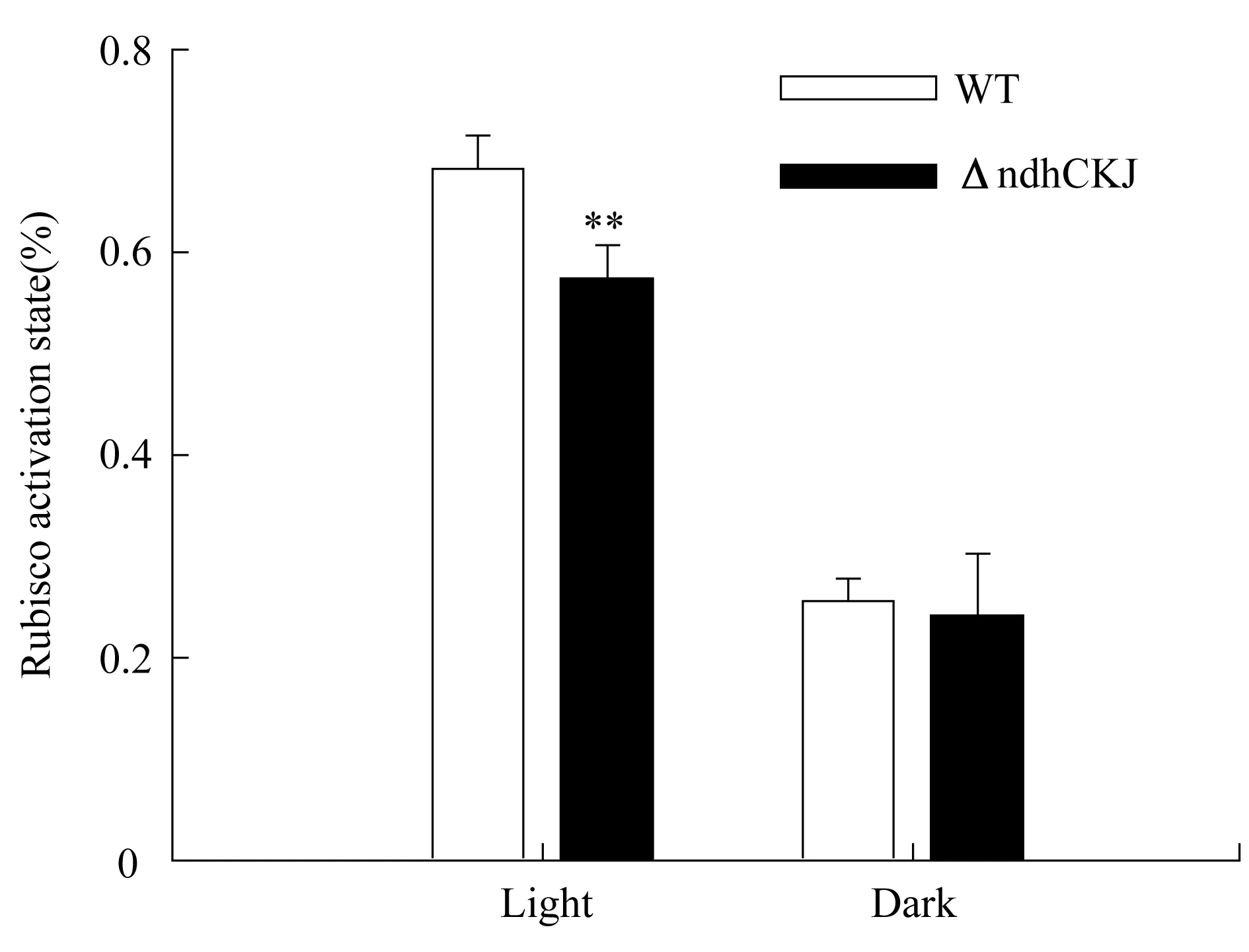
WT:野生型烟草; ΔndhCKJ:ndhC亚基、ndhK亚基、ndhJ亚基缺失烟草突变体. **表示1%的显著水平.双尾student t-test,n=3.
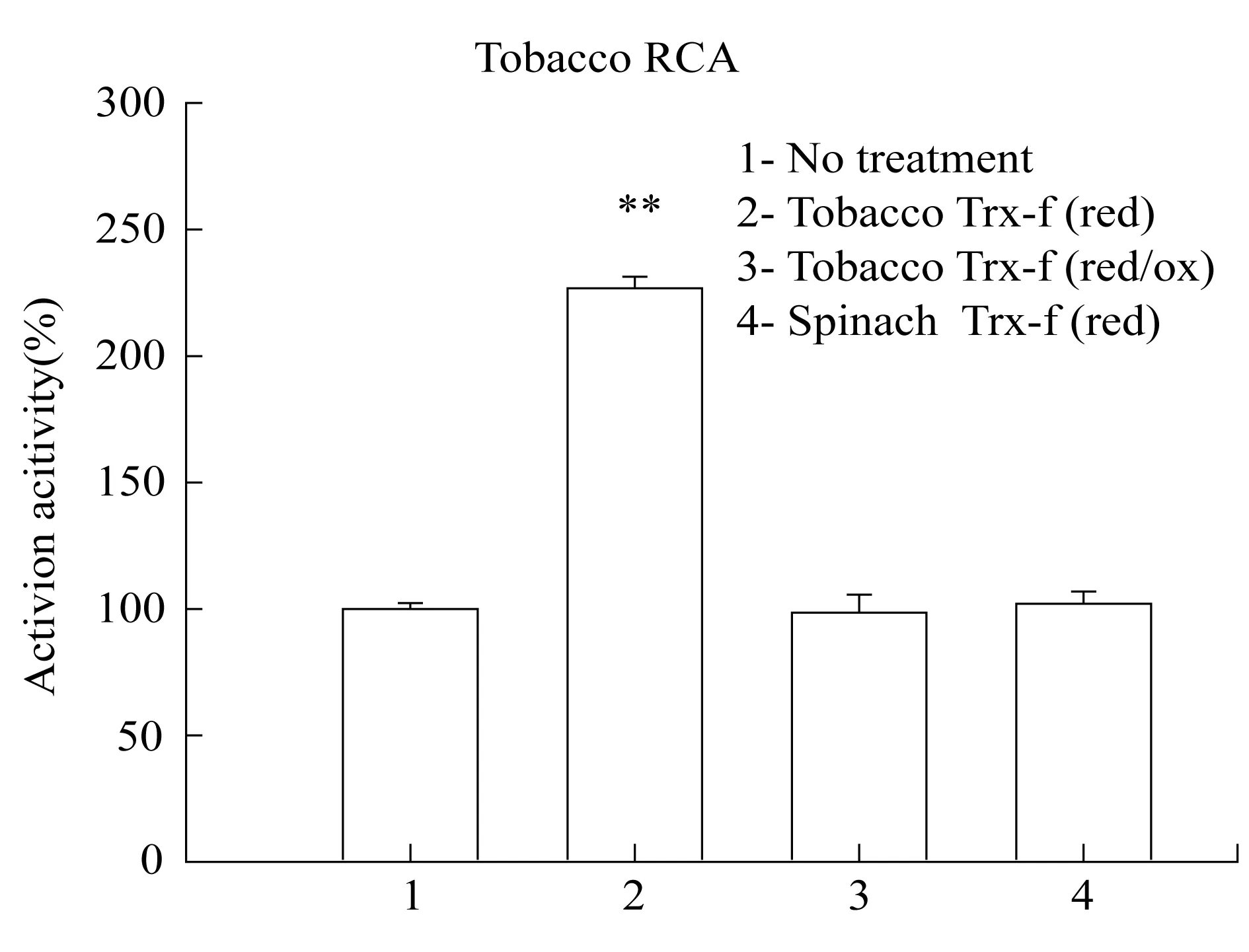
1:未处理对照; 2:烟草Trx-f存在条件下,用DTT处理RCA 5 min; 3:在2条件下,再额外加入GSSG处理5 min; 4:在菠菜Trx-f存在时,用DTT处理RCA 5 min.DTT与GSSG在反应体系中终浓度均为2 mmol·L-1.双尾student t-test,n=4.**表示1%的显著水平.
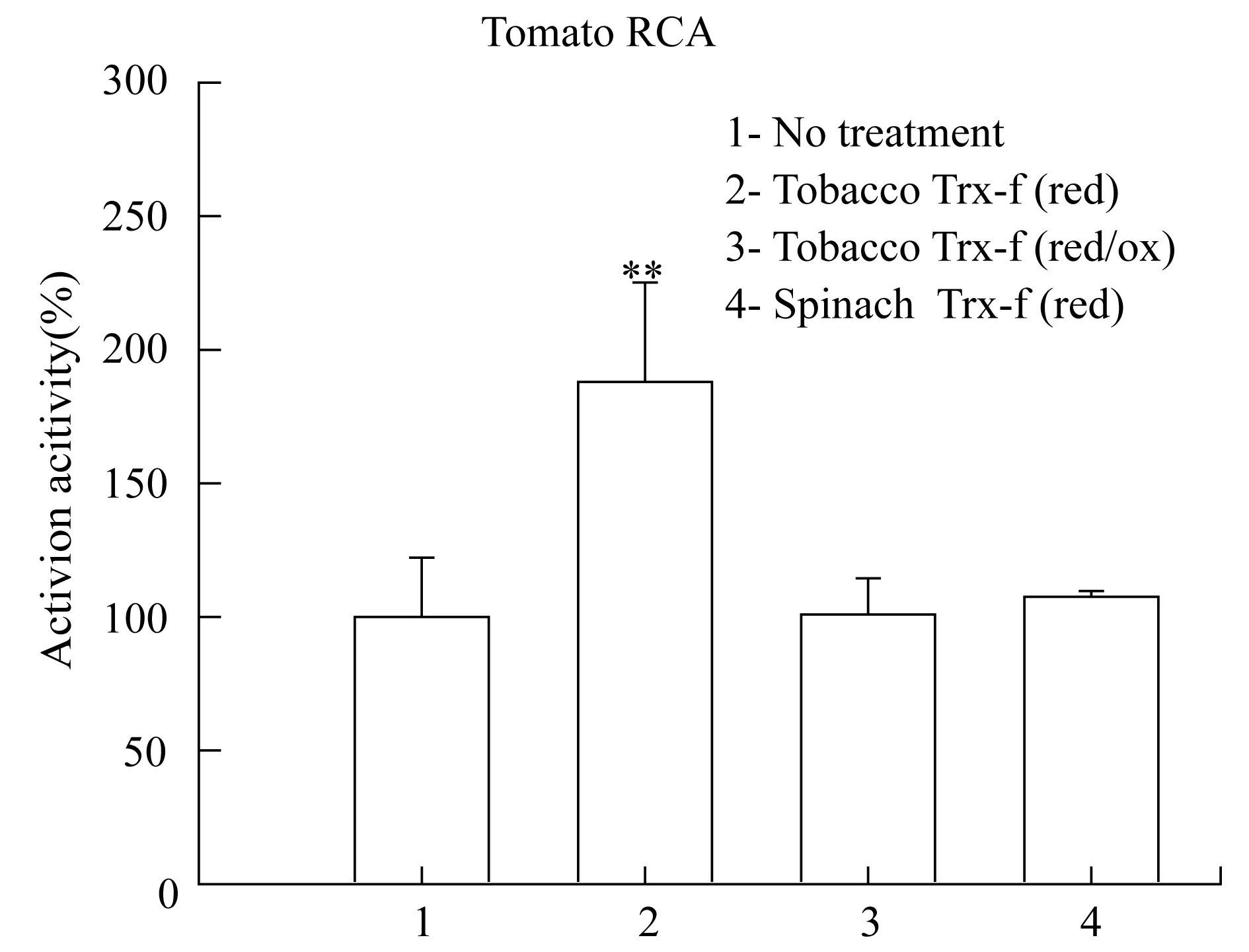
1:未处理对照; 2:烟草Trx-f存在条件下,用DTT处理RCA 5 min;3:在2条件下,再额外加入GSSG处理5 min; 4:在菠菜Trx-f存在时,用DTT处理RCA 5 min.DTT与GSSG在反应体系中终浓度均为2 mmol·L-1.双尾student t-test,n=4.**表示1%的显著水平.
进一步利用烟草和菠菜Trx-f对另外一种来自番茄的单亚型RCA活力进行处理.实验结果与烟草RCA基本一致(图6).烟草Trx-f存在时DTT处理显著促进了番茄RCA的活力,上升了88%,同样额外加入GSSG可逆转DTT处理的促进效果.而当用菠菜Trx-f替代烟草Trx-f后,DTT处理后番茄RCA活力为对照的107%,没有明显作用.这表明烟草Trx-f不仅可以介导自身RCA而且还可以介导同是单亚型的番茄RCA的氧化还原状态的改变,但双亚型RCA物种菠菜的Trx-f却不能.这初步验证了前面关于RCA氧化还原调控可能存在茄科特异性的推测.
2.4 不同氧化还原状态下菠菜和烟草Trx-f对双亚型RCA活力的影响
前面的实验结果表明是烟草而不是菠菜的Trx-f才能介导单亚型RCA的氧化还原状态的改变,从而引起其活力变化.为了进一步阐明Trx-f介导的RCA活力氧化还原调控的种属专一性,进一步在菠菜和烟草的Trx-f存在时,用DTT/GSSG处理双亚型RCA后对其活力进行了测定.
首先对菠菜RCA进行处理.与以往研究结果一致,结果显示在菠菜Trx-f存在的情况下,DTT处理使得菠菜RCA活力上升了152%,达到了极显著的水平.但当随后加入等量的GSSG后,菠菜RCA活力基本回到了初始水平,是对照的91%.而用烟草Trx-f代替菠菜Trx-f后,DTT处理对菠菜RCA活力没有影响.上述结果表明与菠菜Trx-f不能介导烟草RCA活力的氧化还原调控一样,烟草的Trx-f也不能介导菠菜RCA活力的氧化还原调控.
为了进一步验证在菠菜中获得的结果,又在菠菜和烟草Trx-f存在时,对拟南芥RCA进行处理,测定结果与菠菜RCA相似(图8),当加入菠菜Trx-f后,DTT处理的拟南芥RCA活力上升到对照的175%,随后加入额外的GSSG使得拟南芥RCA活力又回复到初始水平的90%.而用烟草Trx-f替代菠菜Trx-f后,DTT处理拟南芥RCA后其活力为对照的110%,没有显著变化.根据上述结果得出结论:菠菜的Trx-f可以介导自身RCA及双亚型RCA的氧化还原状态的改变,而不能介导单亚型RCA的RCA的氧化还原状态的改变.而烟草Trx-f,则相反,只能介导单亚型RCA的氧化还原状态的改变.Trx-f介导的RCA氧化还原状态的改变具有的种属专一性,与其RCA是双亚型还是单亚型有关.
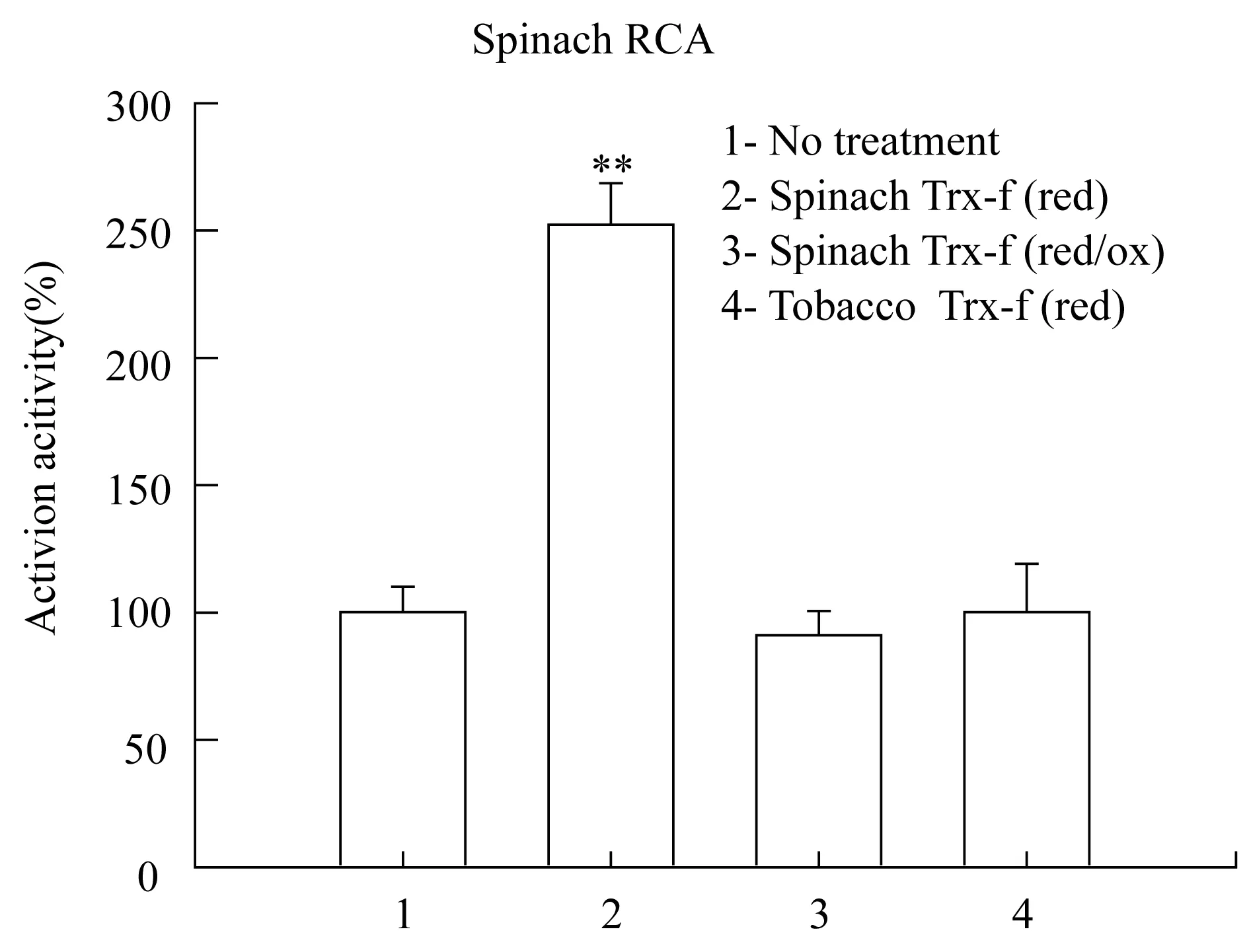
1:未处理对照; 2:菠菜Trx-f 存在条件下,用DTT处理RCA 5 min; 3:在2条件下,再额外加入GSSG处理5 min; 4:在烟草Trx-f存在时,用DTT处理RCA 5 min.DTT与GSSG在反应体系中终浓度均为2 mmol·L-1.双尾student t-test,n=4.**表示1%的显著水平.
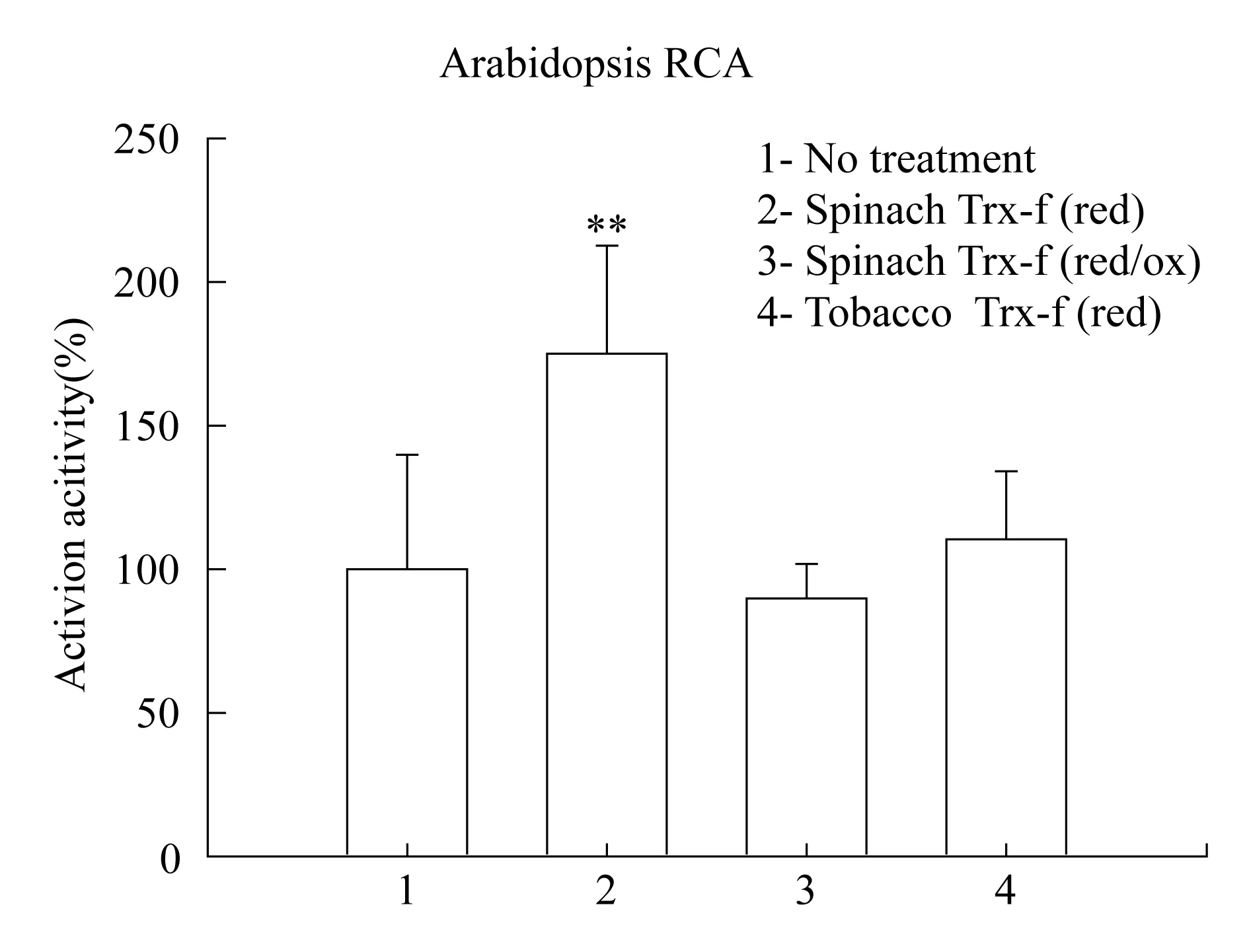
1:未处理对照; 2:菠菜Trx-f 存在条件下,用DTT处理RCA 5 min; 3:在2条件下,再额外加入GSSG处理5 min; 4:在烟草Trx-f存在时,用DTT处理RCA 5 min.DTT与GSSG在反应体系中终浓度均为2 mmol·L-1.双尾student t-test,n=4.**表示1%的显著水平.
3 结 论
植物碳同化酶活性普遍受叶片氧化还原状态的调节,特别是作为光合碳同化的限速酶Rubisco.以往研究表明当提取液中含有较高浓度的DTT时,光下植物叶片的Rubisco活力比较高.自从发现Rubisco的活力在体内是由RCA活化后,人们就致力于氧化还原状态对RCA的调控研究.很早就有文献报道体内RCA对Rubisco的活化需要电子传递,特别是光系统I的电子传递[23].近年来,人们还发现Rubisco活化的氧化还原调控是通过Trx-f对RCA的大亚型的氧化还原状态的改变来完成:光推动的电子传递链传递电子给铁氧还蛋白,铁氧还蛋白可以提供电子给硫氧还蛋白还原酶,后者还原Trx-f,进而完成对大亚型RCA的还原;大亚型通过RCA寡聚体中的不同亚型间的相互作用来改变小亚型RCA的氧化还原状态,从而改变其活性,但只有小亚型的RCA的活力不受氧化还原状态调控[8].然而大量研究和实验结果都表明,烟草等单亚型RCA物种的Rubisco活力是明显受到不同光强 (图1) 和氧化还原状态调控的(图2~4).由此可见烟草RCA的活力同样是受到了体内氧化还原状态的调控.因此人们一直努力在这些物种中寻找是否存在大亚基,这方面的工作一直没有进展(与Portis私人交流).
通过对Zhang等[8]的实验结果分析后发现,他们是用拟南芥/菠菜而不是烟草Trx-f来研究烟草RCA的氧化还原调控的,这可能会导致结论失之偏颇.RCA活化Rubisco时具有茄科特异性[22],这说明茄科RCA在结构上与其他物种不同,陈娟等的工作[24]发现茄科的RCA基本上都是单亚型的.这可能是烟草RCA不受拟南芥的Trx-f的调控的一个重要的原因.单亚型RCA氧化还原调控只能由烟草Trx-f介导,而双亚型RCA氧化还原状态的改变只能由菠菜Trx-f介导的结果验证了上述推测,表明不管是单亚型还是双亚型RCA活力都受氧化还原调控,都是Trx-f介导的.而Trx-f介导RCA氧化还原调控和之前报道的RCA活化Rubisco一样[25]存在种属专一性,但不同的是这种特异性是与该物种具有的RCA是双亚型还是单亚型有关.而由于这种种属专一性的存在导致了Zhang和Portis的结论存在偏差.
本研究结果说明Trx-f介导的RCA氧化还原调控存在种属差异性,但导致其种属差异性的内在机制还不清楚.文献报道Trx-f与大亚型的RCA的半胱氨酸位点与其氧化还原调控有着密不可分的关系[8],然而单亚型RCA缺失大亚型RCA中的C末端序列,因此单亚型中的半胱氨酸位点如何接受Trx-f的调控,以及RCA中的哪些位点导致其种属特异性的发生,还有待于进一步的研究.
参考文献:
[1] KAWASHIMA N,WILDMAN S G.Fraction l protein[J].Ann Rev Plant Physiol,1990,21:325-358.
[2] 王卫兵,洪健,胡东维,等.Rubisco及其活化酶定位于豌豆和蚕豆叶绿体中[J].电子显微学报,2002,24:146-150.
[3] SOMEVILLE C R,PORTIS AR JR,OGREN W L.A mutant ofArabdopsisthalianawhich lacks activation of RuBP caroxylaseinvivo[J].Plant Physiol,1982,70:381-387.
[4] SALVUCCI M E,WERNEKE J M,OGREN W L.Purification and species distribution of Rubisco activase[J].Plant Physiol,1987,84:930-936.
[5] STOTZ M,MUELLER-CAJAR O,CINIAWSKY S,et al.Structure of green-type Rubisco activase from tobacco[J].Nat Strut Mol Biol,2011,18(12):1366-1370.
[6] SALVUCCI M E,VAN DE LOO F J,STECHER D.Two isoforms of Rubisco activase in cotton,the products of separate genes not alternative splicing[J].Planta,2002,216(5):736-744.
[7] RUNDLE S J,ZIELINSKI R E.Organization and expression of two tandemly oriented genes encoding ribulosebisphosphate carboxylase/oxygenase activase in barley[J].J Biol Chem,1991,266:4677-4685.
[8] ZHANG N,SCHüRMANN P,PORTIS AR JR.Characterization of the regulatory function of the 46-kDa isoform of Rubisco activase fromArabidopsis[J].Photosynth Res,2001,68:29-37.
[9] HOLMGREN A.Thioredoxin and glutaredoxin systems[J].J.Biol Chem,1989,264 :13963-13966.
[10] ARNéR E S J,HOLMGREN A.Physiological functions of thioredoxin and thioredoxin reductase[J].Eur J Biochem,2000,267:6102-6109.
[11] SCHENK H,KLEIN M,ERDBRUGGER W,et al.Distinct effects of thioredoxin and antioxidants on the activation of transcription factors NF-kappa-Band-AP21[J].Proc Natl Acad Sci USA,2000,91:1672-1676.
[12] ANTONIO J,SERRATO,FRANCISCO J,et al.Type-h thioredoxins accumulate in the nucleus of developing wheat seed tissues suffering oxidative stress[J].Planta,2003,217:392-399.
[13] 卫丽,黄晓书,李鹏坤,等.植物硫氧还蛋白研究进展[J].贵州农业科学,2006,34(6):129-131.
[14] HIROTA K,MURATA M,SACHI Y.Distinct roles of thioredoxinin the cyto-plasma and in the nucleus-a two-step-mechanism of redox regulation of transcription factor NF-kappa B[J].Biol Chem,1991,274:27891-27897.
[15] ZHANG N,PORTIS AR JR.Mechanism of light regulation of Rubisco:A specific role for the larger Rubisco activase isoform involving reductive activation by thioredoxin-f[J].Proc Natl Acad Sci USA,1999,96:9438-9443.
[16] TAKABAYASHI A,ENDO T,HASHIMOTO T.Directed disruption of the tobacco ndhB gene impaired cyclic electron flow around photosystem[J].Proc Natl Acad Sci USA,1997,95:9705-9709.
[17] WOLOSIUK R A,SCHURMANN P,BUCHANAN B B.Thioredoxin and ferredoxin-thioredoxin reductase of spinach chloroplasts[J].Methods Enzymol,1980,69:382-391.
[18] FRANK J,VAN DE LOO,MICHAEL E,et al.Activation of Ribulose-1,5-bisphosphate Carboxylase/Oxygenase (Rubisco) Involves Rubisco Activase Trp16[J].Biochemistry,1996,35(25):8143-8148.
[19] BRADFORD M M.A rapid method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical biochemistry,1976,72:248-254.
[20] KRAMER D M,JOHNSON G,KIIRATS O.New fluorescence parameters for the determination of QAredox state and excitation energy fluexes[J].Photosyn Res,2004,79:209-218.
[21] CHEN J,WANG P,MI H,et al.Reversible association of ribulose-1,5-bisphosphate carboxylase/oxygenase activase with the thylakoid membrane depends upon ATP level and pH in rice without heat stress[J].Journal of Experimental Botany,2010,61:2939-2950.
[22] RUUSKA S A,ANDREWS T J,BADGER M R.The role of chloroplast electron transport and metabolites in modulating Rubisco activity in tobacco.Insights from transgenic plants with reduced amounts of cytochrome b/fcomplex or glyceraldehydes 3-phosphate dehydrogenase[J].Plant Physiol,2000,122:491-504.
[23] CAMPBELL W J,OGREN W L.Electron transport through photosystem stimulates light activation of ribulose bisphosphate carboxylase/oxygenase (Rubisco) by Rubisco activase[J].Plant Physiol,1990,94:479-484.
[24] 陈娟.Rubisco活化酶与类囊体结合及其在非热胁迫下的生理意义[D].北京:中科院研究生院博士毕业论文,2010.
[25] ZHANG N,KALLIS R P,EWY R G.Light modulation of Rubisco in Arabidopsis requires a capacity for redox regulation of the larger Rubisco activase isoform[J].Proc Nat Acad Sci USA,2002,99:3330-3334.
