太平洋牡蛎(Crassostrea gigas)精液的超低温保存研究*
2014-03-19韩龙江刘清华纪利芹张国范温海深
韩龙江 黄 雯 刘清华① 纪利芹 张国范 李 军① 温海深
(1. 中国海洋大学水产学院 青岛 266003; 2. 中国科学院海洋研究所 青岛 266071;3. 中国科学院大学 北京 100049; 4. 海洋生态养殖技术国家地方联合工程实验室 青岛 266071)
牡蛎精液冷冻保存已有几十年的历史(Hughes,1973; Zellet al, 1979; Bougrieret al, 1986; Douilletet al, 1994), 近年来, 国外有学者进行了一系列牡蛎种质保存相关方面的研究, 取得了比较不错的效果, 部分成功应用到生产实践中(Gwo, 1995; 张岩等, 2004;Adamset al, 2004, 2009; Tervitet al, 2005; Songet al,2009; Suquetet al, 2012)。但其降温过程大多采用在液氮面以上一定高度停留一段时间的办法控制降温速率进行降温, 其稳定性较差(Yanksonet al, 1991;李赟等, 2002; Usukiet al, 2002; Donget al, 2006;Salinas-Floreset al, 2008), 另外, 由于解冻后精液的运动率、受精率、孵化率较差(Donget al, 2007), 冷冻方法仍待优化。在我国, 太平洋牡蛎(Crassostrea gigas)主要分布于山东及辽宁地区, 是我国养殖十分广泛的优良品种。近年来, 随着养殖规模的不断扩大,对太平洋牡蛎种质的需求也不断提高(董晓伟等,2004; 张跃环等, 2012)。开展太平洋牡蛎精液的超低温冷冻保存技术的研究, 建立健全我国太平洋牡蛎的种质库, 对维持种质资源的稳定具有重要意义: 太平洋牡蛎精液超低温保存可以使精液的长距离运输得以实现, 有利于贝类的杂交、选育, 有利于太平洋牡蛎优良性状的保持及其基因多样性的保护。本实验成功筛选出了稳定可靠的太平洋牡蛎精液的冷冻保存方法: 筛选了多种抗冻剂、稀释液、添加剂和稀释比例等影响冷冻精液活力的因素; 采用程序降温仪来控制降温速率; 借助计算机来辅助分析精液活力。效果稳定可靠, 尤其是通过将冻融后精液与卵子进行人工授精, 测定其受精率、孵化率来验证了结果的可靠性。通过实验, 测定冷冻后精子受精率、孵化率可达到90%以上, 与鲜精差异不显著, 成功的应用于500个大规模家系的构建实验等大型项目中, 证明该方法冷冻的太平洋牡蛎的精液可以满足科研和生产的需要。
1 材料与方法
1.1 太平洋牡蛎的采集
实验所用的太平洋牡蛎于性成熟季节(2013年7月)购自青岛崂东海珍品良种培育有限公司, 壳高9.0—11.2cm, 壳宽5.5—6.0cm, 数量120只。暂养于中国科学院海洋研究所海洋贝类增养殖与生物技术实验室100L水族箱内, 暂养期间水温16—18°C, 每天换水一次, 实验时选择性腺饱满的雄性牡蛎, 解剖后取精液, 放入50mL离心管里, 置于4°C冰箱, 备用。
1.2 精液活力的检测
检测精液活力: 载玻片上滴加100μL海水, 吸取5μL精液与其混匀后迅速置于显微镜下观察, 随机取6个视野镜检, 通过计算机辅助精液分析(computerassisted sperm analysis, CASA)统计运动率, 得平均值,运动率高于90%的精液样品带回实验室进行冷冻保存。精液运动率为一个视野内快速运动精子数目占全部精子数目的百分比。
1.3 抗冻保护液的配制
配制三种稀释液: 无钙HBSS (Hanks, 1975)和过滤海水(FSW), 以这三种稀释液为基础液, 分别稀释甘油(GLY)、二甲亚砜(DMSO)、丙二醇(PG)、乙二醇(EG)、甲醇(MeOH)、二甲基乙酰胺(MDA)六种抗冻保护剂成6%、8%、10%、12%、14% (V/V)浓度, 于4°C冰箱内预冷备用。
1.4 实验设计
1.4.1 抗冻保护剂种类对太平洋牡蛎精液冷冻保存的影响 将收集到50mL离心管的精液与预先配好的五种抗冻液[HBSS溶液为稀释液, 将五种抗冻保护剂稀释到浓度10% (V/V)并添加有0.45mol/L的海藻糖]按1︰4的比例混装于2mL的冻存管中, 装入程序降温仪(Kryo-360-1.7, UK)中, 采用分步降温程序B (0°C开始, –15°C /min降温至–60°C, 平衡2min, 然后以–20°C /min降温至–150°C, 平衡5min后将冻存管投入到液氮中)降温, 完成后将冻存管分装于冻存盒中保存, 37°C水浴解冻检测冻精活力。
1.4.2 抗冻剂浓度对太平洋牡蛎精液冷冻保存效果的影响 以HBSS溶液为稀释液, 将抗冻保护剂DMSO稀释成的6%、8%、10%、12%和14%五种浓度梯度, 添加0.45mol/L的海藻糖后与精液按4︰1(抗冻液︰精液)的比例稀释, 分装于2mL的冻存管中,摇匀后置于4°C的冰箱中平衡20min, 然后装入程序降温仪(Kryo-360-1.7, UK), 按分步降温程序B降温,结束后分装于冻存盒中保存, 37°C水浴解冻, 检测冻精活力。
1.4.3 三种稀释液对精液冷冻效果的影响 用DMSO作为抗冻保护剂, 分别用HBSS溶液、人工海水(ASW)、过滤海水(FSW)稀释成10%的浓度, 添加0.45mol/L的海藻糖, 精液和抗冻液按1︰4比例加入到2mL冻存管中, 摇匀后置于4°C的冰箱中平衡20min, 然后装入程序降温仪(Kryo-360-1.7, UK), 按分步降温程序B降温, 结束后分装于冻存盒中保存,37°C水浴解冻, 检测冻精活力。
1.4.4 精液与抗冻液稀释比例对太平洋牡蛎精液冷冻保存效果的影响 用HBSS溶液将DMSO稀释成10%的浓度, 并添加0.45mol/L的海藻糖, 精液和抗冻液分别按1︰1、1︰2、1︰4、1︰6的稀释比例加入到2mL冻存管中, 摇匀后置于4°C的冰箱中平衡20min, 然后装入程序降温仪(Kryo-360-1.7, UK), 按分步降温程序B降温, 结束后分装于冻存盒中保存,37°C水浴解冻, 检测冻精活力。
1.4.5 不同降温程序对精液冷冻保存效果的影响 用DMSO作为抗冻保护剂, 用HBSS溶液稀释成10%(V/V)的浓度, 添加0.45mol/L的海藻糖, 精液和抗冻液按1︰4比例加入到2mL冻存管中, 摇匀后置于4°C的冰箱中平衡20min, 然后装入程序降温仪(Kryo-360-1.7, UK)中分别按分步降温程序A (0°C开始,–10°C/min降温至 –60°C, 平衡2min, 然后以–20°C/min降温至–150°C, 平衡5min后将冻存管投入到液氮中)、程序B (0°C开始, –15°C /min降温至–60°C, 平衡2min, 然后以–20°C /min降温至–150°C, 平衡5min后将冻存管投入到液氮中)、程序C (0°C开始,–20°C/min降温至–60°C, 平衡2min, 然后以–20°C/min降温至–150°C, 平衡5min后将冻存管投入到液氮中),分装于冻存盒中, 37°C水浴解冻, 检测冻精活力。
1.4.6 抗冻添加剂对精液冷冻效果的影响 用DMSO作为抗冻保护剂, 用HBSS溶液稀释成10%(V/V)的浓度, 分别添加0.45mol/L的葡萄糖、蔗糖和海藻糖作为添加剂, 精液和抗冻液按1︰4比例加入到2mL冻存管中, 摇匀后置于4°C的冰箱中平衡20min, 然后装入程序降温仪(Kryo-360-1.7, UK)按分步降温程序B降温, 结束后分装于冻存盒中保存,37°C水浴解冻, 检测冻精活力。
1.4.7 受精率和孵化率的测定 分别取鲜精、DMSO作为抗冻保护剂, 用HBSS溶液稀释成10%的浓度, 添加0.45mol/L的葡萄糖, 精液和抗冻液按1︰3比例加入到2mL冻存管中, 摇匀后置于4°C的冰箱中平衡20min, 装入程序降温仪冻存前和程序B冻存后的三组精液与新鲜解剖的卵子进行人工授精, 测定其受精率和孵化率, 具体操作为: 鲜精、程序冷冻前和程序冷冻后的精子与卵子按精卵比100︰1混合于20°C过滤海水(混合前卵子在过滤海水中活化30min, 精液在过滤海水中活化5min)。2h后取受精卵(100个以上)统计受精率; 授精后14h统计孵化率。受精率指开始分裂的牡蛎受精卵占总总卵量的百分比; 孵化率指发育至D形幼虫的胚胎与受精卵的百分比。实验设3个重复。
1.4.8 统计分析 数据采用Spss17.0统计软件包中的单因素方差分析(ANOVA)和Duncan氏多重范围比较进行分析,P<0.05表示有显著差异, 所有结果均以平均值±标准差表示。
2 结果
2.1 抗冻剂种类对太平洋牡蛎精液冷冻保存效果的影响
不同的抗冻剂种类对精液的保存效果见图1。由图1可以看出, 在抗冻液浓度10% (V/V)的五种抗冻剂中, 10% DMSO+组精液运动率最高, 达到71.53%±1.00%, 显著高于其它抗冻剂种类(P<0.05), 10GLY+次之(56.20%±5.77%), 以下依次为PG (32.13%±2.60%)、EG (27.93%±2.32%)、DMA (22.73%±3.61%)。

图1 抗冻剂种类对太平洋牡蛎精液冷冻保存效果的影响Fig.1 The effect of different antifreeze protectants on C. gigas sperm cryopreservation
2.2 抗冻剂浓度对太平洋牡蛎精液保存效果的影响
不同体积分数DMSO抗冻保护液的保存效果见图2。由图2可以看出, 在6%、8%、10%、12%和14%五种浓度梯度中, 不同体积分数的DMSO处理组, 精液运动率明显不同, 当DMSO浓度为6%时,超低温保存精液运动率为43.75%±3.43%, 浓度为8%时, 精液运动率为47.77%±2.45%, 10%浓度下冻存精液的运动率达到最高值71.53%±1.00%, 显著高于与其它浓度下的精液运动率(P<0.05), 但当浓度大于10%时, 冻存精液的运动率开始明显下降, 当浓度为12%时, 精液运动率为60.47%±1.80%, 当浓度为14%时, 精液运动率为42.83%±2.79%。随着DMSO浓度的升高, 精液运动率呈现先升高后降低的趋势。
2.3 稀释液种类对太平洋牡蛎精液保存效果的影响
不同稀释液对精液冷冻的影响见图3。由图3可以看出, 以人工海水(ASW)、过滤海水(FSW)、HBSS溶液为稀释液冷冻保存太平洋牡蛎精液, 不同稀释液中的精液存活率差异显著(P<0.05); 其中, 以HBSS溶液为稀释液的精液存活率最高, 达到71.53%±1.00%, 其次是过滤海水47.43%±2.97%, 最后是人造海水, 仅为24.90%±3.35%)。
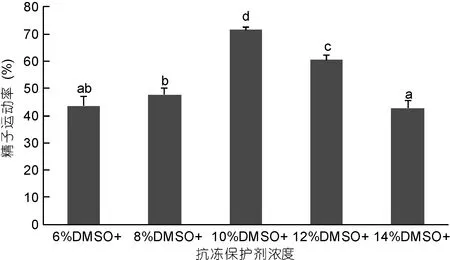
图2 抗冻剂浓度对太平洋牡蛎精液保存效果的影响Fig.2 The effect of different antifreeze protectants concentration on C. gigas sperm preservation
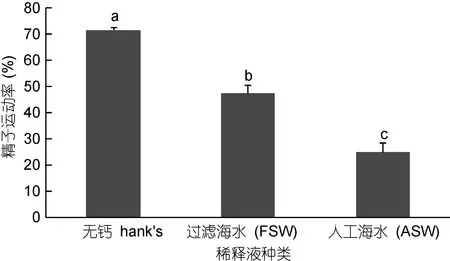
图3 稀释液种类对太平洋牡蛎精液冷冻保存效果的影响Fig.3 The effect of different diluent on C. gigas sperm cryopreservation
2.4 不同稀释比例对太平洋牡蛎精液保存效果的影响
不同稀释比例对精液运动率的影响见图4。由图4可知, 精液和抗冻液按1︰1、1︰2、1︰4、1︰6四种稀释比例中, 随着精液浓度的降低, 太平洋牡蛎精液的运动率呈现先上升后下降的趋势, 各不同稀释比例之间差异显著: 在1︰1的稀释比例时, 精液运动率达到22.93%%±3.27%; 在1︰2的稀释比例时,精液运动率达到49.60%±3.60%; 在1︰4的稀释比例时, 精液运动率达到最大值71.53%±1.00%, 与其它各组差异显著(P<0.05); 在1︰6的稀释比例时, 精液运动率达到59.60%±2.44%。
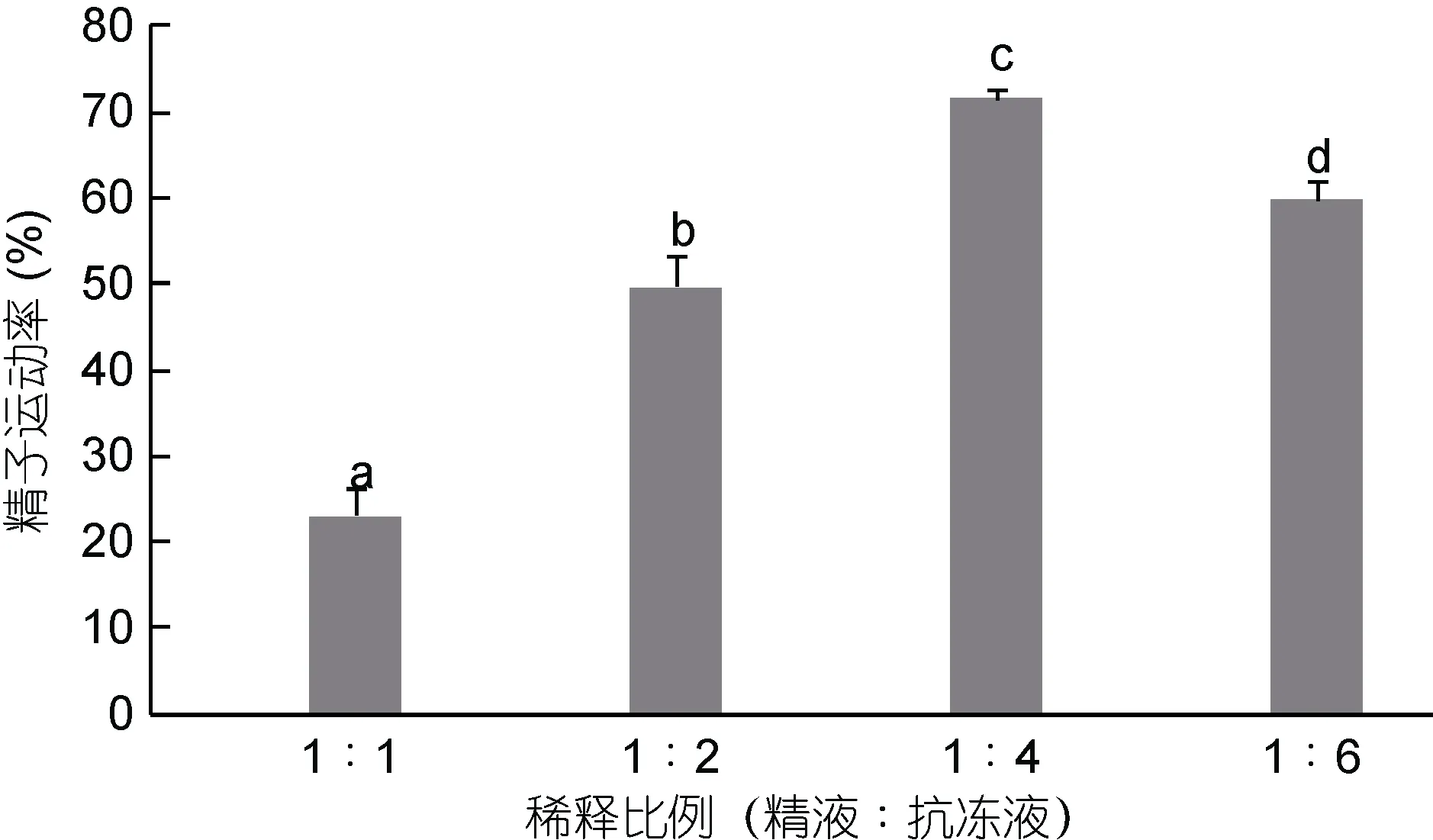
图4 不同稀释比例对太平洋牡蛎精液冷冻保存效果的影响Fig.4 The effect of different diluent ratio on C. gigas sperm cryopreservation
2.5 不同添加剂对太平洋牡蛎精液保存效果的影响
不同添加剂对太平洋牡蛎精液冷冻保存效果见图5。由图5可知, 添加0.45mol/L的葡萄糖、蔗糖、海藻糖作为添加剂的各处理组中, 含0.45mol/L海藻糖组精液运动率最高, 达到(71.53%±1.00%), 显著高于蔗糖组(56.47%±5.22%)、葡萄糖组(49.57%±5.14%)的精液运动率。
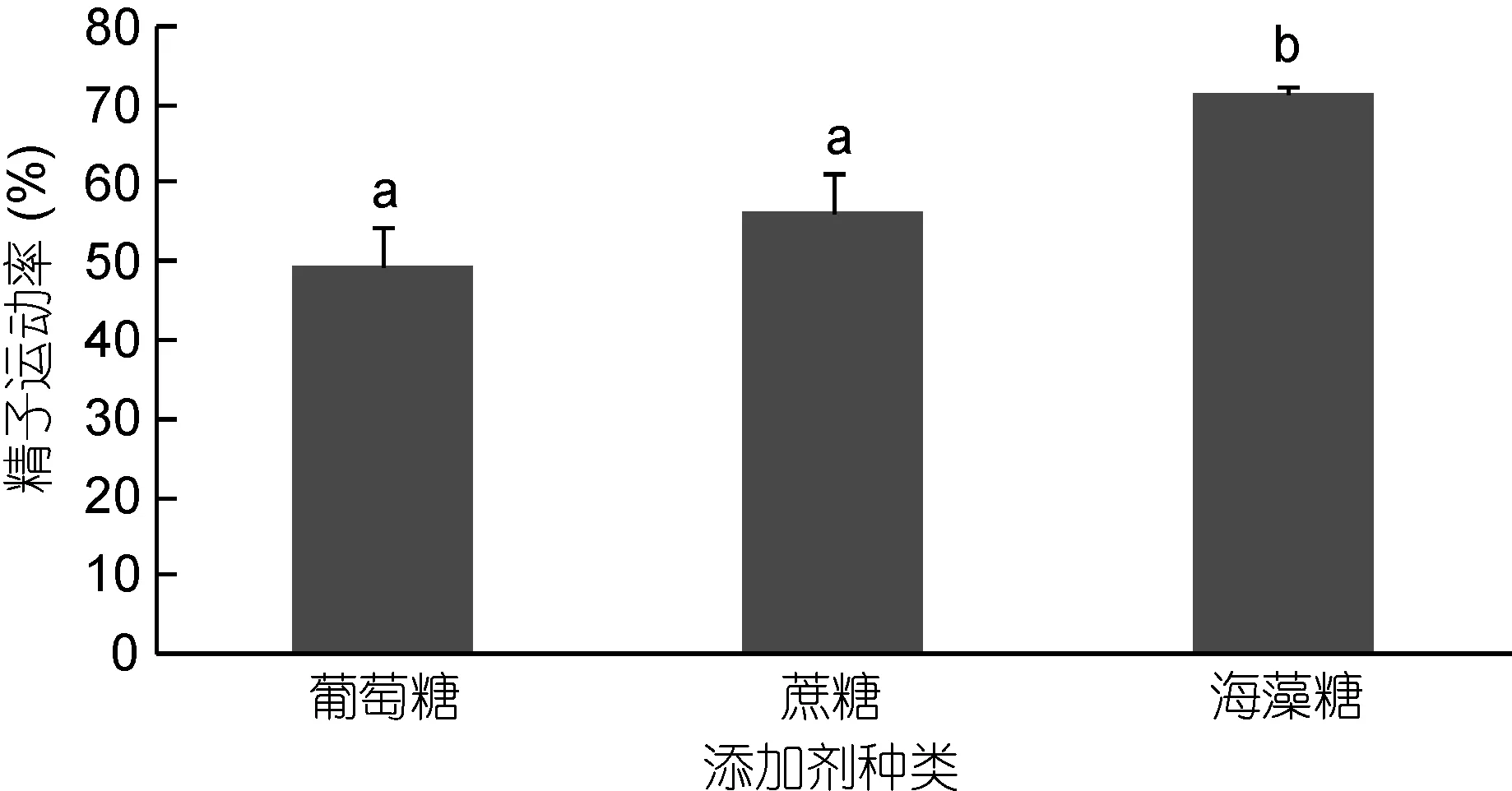
图5 不同添加剂对太平洋牡蛎精液冷冻保存效果的影响Fig.5 The effect of different additives on C. gigas sperm cryopreservation
2.6 不同降温程序对太平洋牡蛎精液保存效果的影响
不同降温程序对太平洋牡蛎精液冷冻保存效果见图6。由图6可知, 采用分步降温程序A、分步降温程序B、分步降温程序C三种降温程序冷冻保存太平洋牡蛎精液, 程序B精液运动率最高(71.53%±1.00%),与程序A (68.17%±4.68%)差异不显著(P>0.05), 与程序C (53.93%±7.41%)差异显著(P<0.05)。
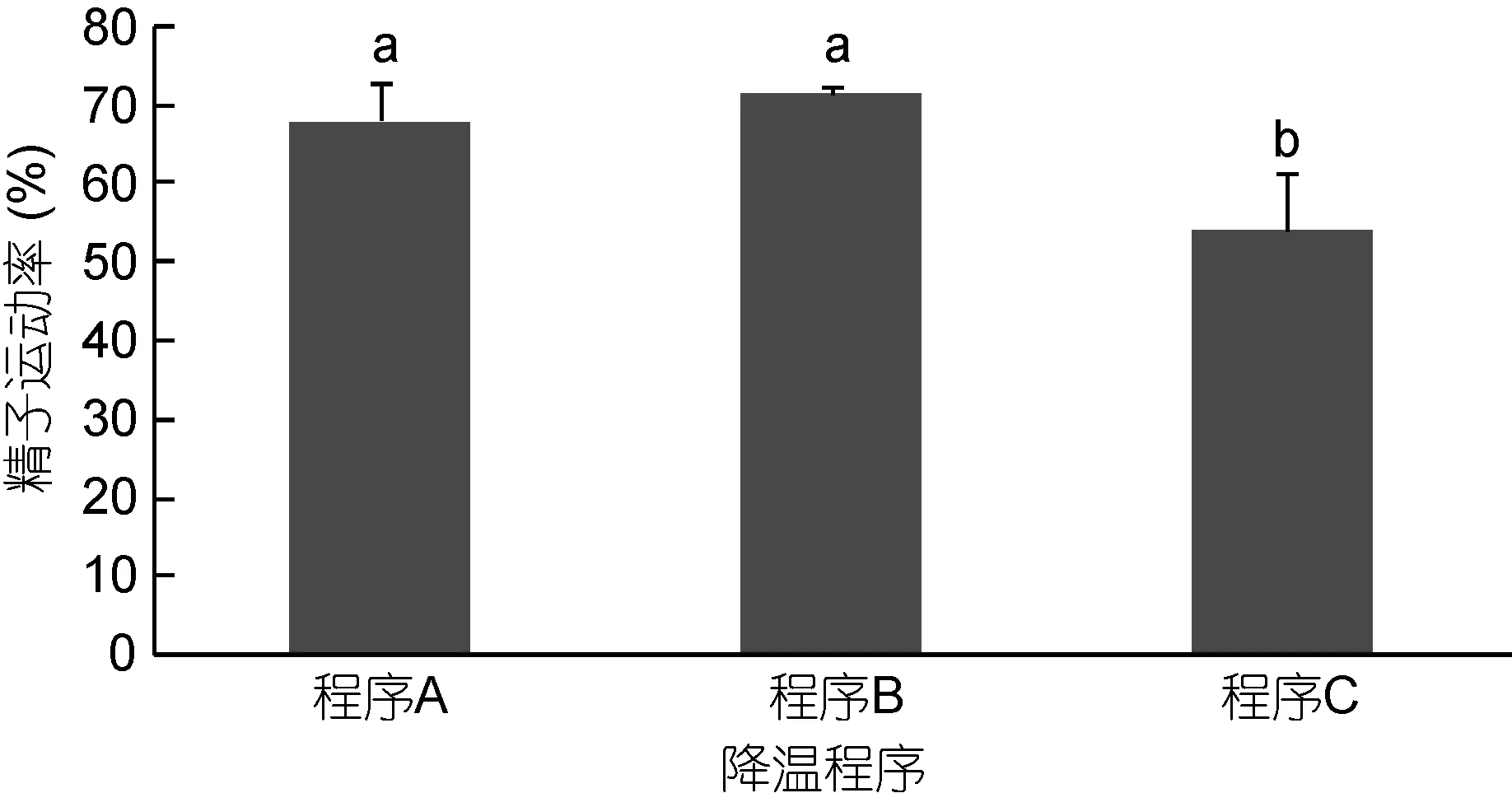
图6 不同降温程序对太平洋牡蛎精液冷冻保存效果的影响Fig.6 The effect of different cooling process on C. gigas sperm cryopreservation
2.7 太平洋牡蛎精液超低温保存对受精率和孵化率的影响
精液超低温保存对精液受精率和孵化率的影响见图7。由图7可知, 鲜精、冻存前和冻存后三组精液与新鲜解剖的卵子进行受精实验(鲜精做对照), 结果表明: 经超低温保存的精液与未经超低温保存的精液相比, 受精率和孵化率没有明显差异(P>0.05)。表明经超低温保存的精液仍具有正常的受精能力。鲜精、冻存前和冻存后精液受精率达到95%左右, 各组之间差异不显著(P>0.05), 其中冷冻前精液受精率最高, 达到95.96%±2.15%, 其次是冷冻后精液, 达到95.04%±1.99%, 鲜精受精率略低(94.90%±0.95%);鲜精、冷冻前精液和冷冻后精液的孵化率达到90%左右, 各组之间差异不显著(P<0.05), 其中冷冻后精液孵化率最高, 达到93.33%±1.33%, 其次是冷冻前精液,达到92.67%±14.83%, 鲜精孵化率略低(88.89%±15.16%)。授精能力和孵化率与鲜精无差异(P<0.05)。
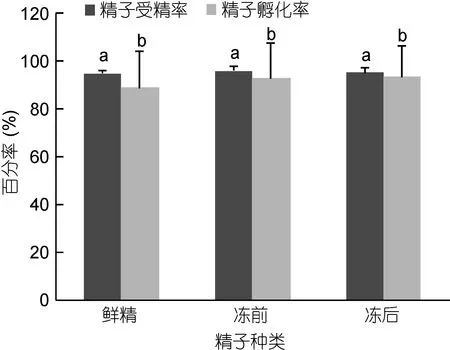
图7 太平洋牡蛎精液超低温保存对受精率和孵化率的影响Fig.7 The effect of C. gigas sperm cryopreservation on fertilization rate and hatching rate
3 讨论
3.1 不同抗冻剂种类对太平洋牡蛎精液保存效果的影响
抗冻保护剂主要通过改变精液细胞耐渗透压及细胞内离子浓度, 保护精液免受温度变化过程中的损伤(Donget al, 2007)。不同的抗冻保护剂由于其渗透能力、水活性等各不相同, 对精液冷冻保存效果亦有差异。贝类精液保存的抗冻保护剂常用的有GLY、DMSO、PG、EG、METH、MDA等(Adamset al, 2004;孙振兴等, 2005)。DMSO具有分子小, 毒性低, 易渗入细胞, 分布均匀等特征。Dong等(2007)发现2.5%—15%的DMSO可以适度改进太平洋牡蛎精液的运动率; 余祥勇等(2005)的研究发现体积分数10%—12%的DMSO可对马氏珠母贝(Pinctada martensi)的精液有较好的抗冻保护作用; DMSO对虾夷扇贝(Patinopecteny essoensis)精液的保护作用明显高于GLY和MET(杨培民等, 2007, 2008)。 本研究中, 采用10% DMSO的冷冻保存太平洋牡蛎精液效果最好:DMSO组70%以上精子存活, 表明在其它因素一定的条件下, DMSO是太平洋牡蛎最优抗冻保护剂, 这是由DMSO作为抗冻保护剂所具有的渗透速度快、渗透力强、亲水性好、毒性小的特性所决定的。本实验结果发现, 在太平洋牡蛎精液冷冻保存中选用DMSO作为冷冻保护剂效果最好。
3.2 不同抗冻剂浓度对太平洋牡蛎精液保存效果的影响
不同贝类精液的最适抗冻保护剂浓度是不同的。抗冻液通过增加细胞质的粘滞度和降低冰点等作用起到对精液的低温保护, 随着抗冻液浓度的增加, 精液的保护作用加强; 但是由于抗冻液本身所具有的毒性又是其使用量的限制因子(Nascimentoet al,2005)。例如栉孔扇贝(Chlamys farreri)精液在5%—10% DMSO中具有很高活力, 但浓度升高时精液活力大幅度下降(李纯等, 2000)。有研究表明, 不同种类、不同浓度的冷冻保护剂对各个发育期胚胎的毒性不同(Usukiet al, 2002)。本研究表明, 冻存的太平洋牡蛎精液运动率随着浓度的上升呈现先上升后下降的趋势, 低浓度的DMSO由于其渗透作用差, 因而精液运动率低; 高浓度下DMSO随着浓度的增大毒害作用明显增大。DMSO对太平洋牡蛎精液既有抗冻保护作用又具一定的毒性, 需要筛选出一个适宜浓度,既能起到良好的抗冻作用, 又不会导致精液损伤。结果显示, 浓度为10%的DMSO对精液冷冻的保护作用最好。
3.3 不同稀释液对太平洋牡蛎精液保存效果的影响
稀释液是保存精液的基础环境, 不同物种所使用的稀释液不同。稀释液是否合适, 不仅影响冷冻保存的效果, 也会影响受精率、孵化率以及胚胎发育等。稀释液可分为天然的和人工配制的两种, 贝类精液冷冻保存采用的天然稀释液一般为过滤海水, 这是由于多数贝类受精过程是在海水中进行, 海水符合大部分精液渗透压、pH的要求(丁兆坤等, 2013)。但海水的理化性质随水域、季节甚至天气变化而变化,又考虑到精液原生质的pH和渗透压通常比海水低,人工配制的稀释液目前应用日益广泛, HBSS溶液和人工海水作为稀释液, 在很多贝类物种取得了有较好的保存效果(Yanget al, 2012)。本实验以过滤海水、HBSS溶液和人工海水为稀释液冷冻保存太平洋牡蛎精液, 在筛选稀释液的过程中发现, 以海水为稀释液的冻存精液活力普遍低, HBSS溶液精液运动率明显高于其它两种稀释液。这是由于太平洋牡蛎作为变渗动物, 其精液在高盐水域、高渗的外部环境中会对精液造成脱水等损害, 使精液活力降低。HBSS溶液与过滤海水、人工海水为稀释液冷冻保存太平洋牡蛎精液差异显著, HBSS溶液对精液的保存效果明显好于其它两种稀释液, 表明HBSS溶液为太平洋牡蛎精液冷冻保存最优稀释液。
3.4 不同稀释比例对太平洋牡蛎精液保存效果的影响
精液在抗冻液中的浓度对精液冷冻保存具有显著的影响, 不同物种间精液浓度不同。由于太平洋牡蛎解剖取精液, 精液浓度高, 因此筛选一种适宜的稀释比例既能够使其充分渗透保护细胞, 又能够尽可能多的保存精液。本研究结果表明, 当解剖精液与抗冻液按1︰4的比例稀释时, 精液冷冻取得最好的结果, 研究发现, 1︰4的比例下, 太平洋牡蛎精液既能充分渗透, 又不会因精液浓度过稀致毒死亡。因此,该比例为太平洋牡蛎最佳稀释比例。
3.5 不同添加剂对太平洋牡蛎精液保存效果的影响
添加剂又称非渗透性抗冻剂, 多为糖类或蛋白,特征是分子量较大, 不容易透过细胞膜, 比较常见的有葡萄糖、海藻糖、聚乙烯比咯烷酮、抗冻蛋白等。其作用主要是通过提高精子细胞外的渗透压以减少冰晶的形成(Salinas-Floreset al, 2008)。贝类精液冻存中常会添加海藻糖、葡萄糖、蔗糖等添加剂, 有研究发现, 海藻糖对香港牡蛎(Crassostrea hongkongensis)精液冻存有正面作用(丁兆坤等, 2013)。因此, 本研究在抗冻剂中添加海藻糖、蔗糖、葡萄糖, 以探究三种不同添加剂对牡蛎精液冻存效果的影响, 结果发现海藻糖显著提高精液冷冻保存, 可见在太平洋牡蛎精液的超低温冷冻保存中, 添加海藻糖冻存效果好。
3.6 不同降温速率对太平洋牡蛎精液保存效果的影响
降温速率对太平洋牡蛎精液超低温保存具有显著影响(Choiet al, 2003)。不同物种之间精液大小、细胞膜的渗透性、体积大小、生理特性及生态环境的不同, 致使其精液的抗逆性也不尽相同。过慢或过快的冷却速率都会导致细胞的损伤: 当降温速度过慢时,细胞会长期处于高渗环境失去水分, 产生渗透休克带来伤害; 当降温速率过快时, 细胞内水分来不及渗出, 胞内容易形成冰晶, 刺破细胞膜和细胞器致细胞破损死亡(张轩杰, 1987)。适宜的降温速率既能避免细胞长时间处于高渗环境中又能使细胞适当脱水,提高渗透压, 有效防止冰晶对精液细胞造成的损伤(Ieropoliet al, 2004)。降温速率控制多采用液氮面上一定距离停留一定时间来达到, 该方法操作简便, 费用低廉, 应用十分广泛, 但是由于液氮容器规格的不同, 该法无法取得精准的降温速率, 数据间的可比性差, 冷冻保存精液效果往往不理想。通过程序降温仪控制温度的变化, 温度控制精确, 可以有效地减少冰晶对细胞的损伤, 并且试验重复性。本实验采用程序降温仪控制降温速率表明, 在冰晶易生区(0—–40°C), 当降温速率在-15°C /min时, 冻精活力最高, 而–20°C /min的降温速率对冻融精液运动率影响较大, –10°C /min的降温速率与–15°C /min的降温速率差异不大, 结果表明–15—–10°C /min的降温速率均为太平洋牡蛎精液的适宜降温速率。
3.7 太平洋牡蛎精液超低温冷冻对受精率和孵化率的影响
判定精液冷冻保存效果最重要的一个因素是通过授精实验检测其受精率、孵化率: 杨培民等(2008)发现, 冷冻90天内虾夷扇贝精液活力没有发生显著变化, 扇贝与栉孔扇贝之间无论是正交和反交均能正常授精, 与各自交组无明显差别。本试验证实了太平洋牡蛎的冻精、冻前和鲜精与牡蛎卵子人工授精,受精率和孵化率间无显著差异, 均能发育至D形幼虫。但是太平洋牡蛎精液的超低温保存导致精子运动能力的下降, 超微结构分析表明, 精液细胞膜和细胞器有一定损伤(结果待发表)。因此, 对太平洋牡蛎精液冷冻保存细胞膜及DNA的损伤需进一步研究(Paniagua-Chávezet al, 2006)。
丁兆坤, 朱豪磊, 杨春玲等, 2013. 不同稀释液对香港牡蛎精子冷冻的保存效果. 水生态学杂志, 34(3): 67—74
李 纯, 李 军, 薛钦昭, 2000. 栉孔扇贝精子的超低温保存研究. 海洋水产研究, 21(1): 57—62
李 赟, 王品虹, 贺桂珍等, 2002. 太平洋牡蛎精液的超低温保存. 青岛海洋大学学报(自然科学版), 32(2): 207—211
杨培民, 杨爱国, 刘志鸿等, 2007. 虾夷扇贝精子的冷冻保存及其杂交试验应用研究. 上海水产大学学报, 16(4): 351—356
杨培民, 杨爱国, 刘志鸿等, 2008. 虾夷扇贝精子形态结构和超低温冷冻损伤的电镜观察. 海洋水产研究, 29(1): 98—102
余祥勇, 王梅芳, 陈钢荣等, 2005. 马氏珠母贝精子低温保存主要影响因素的研究. 华南农业大学学报, 26(3): 96—99
张 岩, 陈四清, 于东祥等, 2004. 海洋贝类配子及胚胎的低温冷冻保存. 海洋水产研究, 25(6): 73—78
张轩杰, 1987. 鱼类精液超低温冷冻保存研究进展. 水产学报,9(3): 259—267
张跃环, 王昭萍, 闫喜武等, 2012. 太平洋牡蛎与近江牡蛎的种间杂交. 水产学报, 36(8): 1215—1224
董晓伟, 姜国良, 李立德等, 2004. 牡蛎综合利用的研究进展.海洋科学, 28(4): 62—65
Adams S L, Smith J F, Roberts R Det al, 2004. Cryopreservation of sperm of the Pacific oyster (Crassostrea gigas):development of a practical method for commercial spat production. Aquaculture, 242: 271—282
Adams S L, Tervit H R, McGowan L Tet al, 2009. Towards cryopreservation of GreenshellTMmussel (Perna canaliculus)oocytes. Cryobiology, 58: 69—74
Bougrier S, Rabenomanana L D, 1986. Cryopreservation of spermatozoa of the Japanese oyster,Crassostrea gigas.Aquaculture, 58: 277—280
Choi Y H, Chang Y J, 2003. The influence of cooling rate,developmental stage, and the addition of sugar on the cryopreservation of larvae of the pearl oysterPinctada fucata martensii. Cryobiology, 46: 190—193
Dong Q, Huang C, Eudeline Bet al, 2006. Systematic factor optimization for sperm cryopreservation of tetraploid Pacific oysters,Crassostrea gigas. Theriogenology, 66: 387—403
Dong Q, Huang C, Eudeline Bet al, 2007. Cryoprotectant optimization for sperm of diploid Pacific oysters by use of commercial dairy sperm freezing facilities. Aquaculture, 271:537—545
Douillet P A, Langdon C J, 1994. Use of a probiotic for the culture of larvae of the Pacific oyster (Crassostrea gigasThunberg). Aquaculture, 119: 25—40
Gwo J C, 1995. Cryopreservation of oyster (Crassostrea gigas)embryos. Theriogenology, 43: 1163—1174
Hanks J H, 1975. Hanks' balanced salt solution and pH control.Methods in Cell Science, 1: 3—4
Hughes J B, 1973. An examination of eggs challenged with cryopreserved spermatozoa of the American oyster,Crassostrea virginica. Cryobiology, 10: 342—344
Ieropoli S, Masullo P, Santo M D Eet al, 2004. Effects of extender composition, cooling rate and freezing on the fertilisation viability of spermatozoa of the Pacific oyster(Crassostrea gigas). Cryobiology, 49: 250—257
Nascimento I A, Leite M B N L, Sampaio de Araújo M Met al,2005. Selection of cryoprotectants based on their toxic effects on oyster gametes and embryos. Cryobiology, 51:113—117
Paniagua-Chávez C G, Jenkins J, Segovia Met al, 2006.Assessment of gamete quality for the eastern oyster(Crassostrea virginica) by use of fluorescent dyes. Cryobiology,53: 128—138
Salinas-Flores L, Adams S L, Lim M H, 2008. Determination of the membrane permeability characteristics of Pacific oyster,Crassostrea gigas, oocytes and development of optimized methods to add and remove ethylene glycol. Cryobiology, 56:43—52
Song Y P, Suquet M, Quéau Iet al, 2009. Setting of a procedure for experimental fertilisation of Pacific oyster (Crassostrea gigas) oocytes. Aquaculture, 287: 311—314
Suquet M, Le Mercier A, Rimond Fet al, 2012. Setting tools for the early assessment of the quality of thawed Pacific oyster(Crassostrea gigas) D-larvae. Theriogenology, 78: 462—467
Tervit H R, Adams S L, Roberts R Det al, 2005. Successful cryopreservation of Pacific oyster (Crassostrea gigas)oocytes. Cryobiology, 51: 142—151
Yankson K, Moyse J, 1991. Cryopreservation of the spermatozoa ofCrassostrea tulipaand three other oysters. Aquaculture,97: 259—267
Zell S R, Bamford M H, Hidu H, 1979. Cryopreservation of spermatozoa of the American oyster,Crassostrea virginicaGmelin. Cryobiology, 16: 448—460
