青蛤(Cyclina sinensis)TLR2基因的克隆与表达分析*
2014-03-19任毅鹏潘宝平闫春财
任毅鹏 高 晶 潘宝平 高 虹 闫春财
(天津师范大学生命科学学院 天津市动植物抗性重点实验室 天津 300387)
青蛤(Cyclina sinensis)是我国重要的海产经济贝类, 广泛分布于我国南北沿海滩涂及河口的泥砂质区域。近年来, 随着我国海产贝类养殖产业的高速发展及养殖环境的恶化, 青蛤的增养殖业受到了病害的严重困扰, 相继出现了大面积死亡事件(孙国铭等,2004; 曹华, 2004)。因此, 亟待探索青蛤的免疫信号传导通路及免疫抗病害机理。
Toll样受体(Toll-like receptors, TLRs)早在(Nusslein-Volhardet al, 1980)研究果蝇胚胎发育时发现的一种蛋白, 属于天然免疫过程中参与识别病原体相关的分子模式(PRRs), 是一种重要的模式识别受体(PAMPs)(Medzhitovet al, 2002; Janewayet al, 2002)。它可以识别多种仅表达在病原微生物上的高度保守结构序列,其中包括细菌细胞壁成分, 鞭毛蛋白等。TLRs是一类跨膜蛋白, 胞外有参与病原体识别的一些富含亮氨酸的重复序列(leucine-rich repeats, LRRs)。胞内存在一段保守序列, 该序列被称为TIR结构域(Toll/Interleukin-1 homologous region) (Xuet al, 2000; Yamamotoet al,2005), 这段区域是高度保守的, 与果蝇(Drosophila melanogaster)同源, 可以激活已经被转染的细胞中的菌肽启动子(Tausziget al, 2000), 并与髓样分化因子88(Myd88)相互作用, 参与细胞内的信号传递。
目前, 大部分的脊椎动物中TLRs已经被克隆,并阐释了其在先天免疫和获得性免疫中的重要作用(Pasareet al, 2004)。其中, 在海洋无脊椎动物中鲜有报道, 如中华鲎(Tachypleus tridentatus) (Inamoriet al,2004)、夏威夷短尾鱿鱼(Euprymna scolopes) (Goodsonet al, 2005)和栉孔扇贝(Chlamys farreri)等Toll基因的序列全长已被克隆, 从现有的文献来看, 青蛤(Cyclina sinensis)的Toll基因的相关序列目前还没有报道。本实验的结果为探索青蛤抗病害机理和免疫反应机制提供重要的实验数据。
1 材料与方法
1.1 材料
青蛤(Cyclina sinensis)样品采于天津大港滩涂,暂养于通气海水中, 海水密度1.02—1.04g/cm3, 水温21—24°C, 投喂5‰小球藻, 选择没有损伤, 形态上无显著差异的成体[平均壳宽(19.12±0.57)mm, 平均壳长(29.14±1.23)mm, 平均壳高(29.52±1.47)mm],一周后开始实验。
将实验室保存的鳗弧菌(Vibrio anguillarum)和藤黄微球菌(Micrococcus luteus)菌种用2216E 培养基于28°C下培养24h, 用无菌海水重悬菌液, 将浓度调为OD600= 0.4。采用随机分组方法, 每次试验均设10个平行组。实验组青蛤注射50μL/只的鳗弧菌菌液和藤黄微球菌菌液, 对照组注射等量的灭菌生理盐水。注射前提取血淋巴、肝脏、外套膜、闭壳肌、鳃和性腺, 准确称取组织质量50mg; 注射后3h、6h、9h、12h、24h、48h、96h时提取血淋巴。以上组织迅速放入液氮冷冻备用。
1.2 方法
1.2.1 青蛤转录组文库的构建 利用TRIZOL法,提取青蛤各个组织的总RNA, 采用QIAGEN公司的Oligotex mRNA Kits方法进行分离纯化。采用第二代MiSeq测序仪, pair end双端模式完成青蛤转录组测序,利用De novoRNA-seq analysis技术综合分析, 对相关基因进行功能注释和代谢途径的分析。
1.2.2 生物信息学分析 将获得的青蛤基因类似序列的全长cDNA序列与GenBank中的核酸数据库作BLASTX分析, 使用开放阅读框(open reading frame, ORF)在线分析, ProtParam工具在线预测序列的分子式、分子量和等电点, SignalP 3.0和SMART查找信号肽及结构域, Clustal W对氨基酸序列进行多重比对和同源性分析, 利用MEGA4.1以邻接法(NJ)构建分子系统树。
1.2.3 青蛤TLR2基因在各组织内的表达分析 利用TRIZOL法提取血淋巴、肝脏、外套膜、闭壳肌和鳃的总RNA, 反转成cDNA在–20°C保存备用。以β-actin基因为内参基因, 实时定量引物分别为βactin-F: 5’ CACCACAACTGCCGAGAG 3’, β-actin-R: 5’CCGATAGTGATGACCTGACC 3’; TLR2-F: 5’ ACGG GATAATTTACTTGGA 3’, TLR2-R: 5’ GCGAGACTT TGTAGTGGGT 3; 反应在Rotor-Gene 6000实时定量PCR仪上进行, 扩增体系为20μL, 反应程序为: 95°C预变性30s, 94°C变性5s, 60°C退火30s, 72°C延伸30s,40个循环。数据处理采用2–ΔΔCT法计算(Livaket al,2001), 使用SPSS软件分析数据。
1.2.4 鳗弧菌刺激后青蛤TLR2基因在血淋巴内的时序性表达 参照1.2.3的方法提取鳗弧菌侵染后各时间点血淋巴总RNA, 并反转成cDNA。以β-actin基因为内参基因, 引物参照1.2.3。反应程序为: 95°C预变性30s, 95°C变性5s, 58°C退火30s, 72°C延伸30s,40个循环。数据处理采用2–ΔΔCT法(Livaket al, 2001),使用SPSS软件对同一时间点实验与对照组, 实验组和空白组的表达水平进行单因素方差分析。
1.2.5 藤黄微球菌刺激后青蛤TLR2基因在血淋巴内的时序性表达 利用TRIZOL法提取藤黄微球菌侵染后各时间点血淋巴总RNA, 并反转成cDNA。荧光定量PCR引物、反应体系、程序、数据分析和处理同1.2.4。
1.2.6 Poly I:C刺激下青蛤TLR2基因在血淋巴内的时序性表达 利用TRIZOL法提取藤黄微球菌侵染后各时间点血淋巴总RNA, 并反转成cDNA。荧光定量PCR引物、反应体系、程序、数据分析和处理同1.2.4。
2 结果
2.1 青蛤TLR2基因的结构
用转录组所建的库中, 有893个基因注释到15个免疫相关的通路中。利用BLASTX在线比对后分析发现Toll样受体家族基因类似序列。该序列与长牡蛎(Crassostrea gigas)Toll样受体家族TLR2基因相似性最高, 一致性达到68%。将该序列其命名为青蛤TLR2, 在GenBank的注册号为KJ841929。
青蛤TLR2基因cDNA开放阅读框为2082bp, 编码693个氨基酸(图1), 其理论分子量为80.40kDa, 理论等电点pI=7.35, 分子式为C3641H5649N959O1026S35,氨基酸序列1—28位为信号肽序列。氨基酸组成中亮氨酸(Gly)最高, 占12.8%。利用SMART软件预测的青蛤的TLR基因, 结果表明其有六个亮氨酸重复序列(leucine-rich repeats) (103—131, 158—180, 202—225,231—254, 255—278, 385—407), 还有一个LRRCT(LRR-C-terminal)结构域(445—499), 单次跨膜区为503—525, 末端的TIR区(Toll/IL-1R homologous region)为554—693。
2.2 青蛤TLR基因的分子系统学分析
用MEGA4.1软件以邻接法(NJ)构建了TLRs的系统树, 如图2, 采用bootstrap 1000个循环检验拓扑结构的置信度。结果表明青蛤TLR2与长牡蛎(Crassostrea gigas)的进化距离最近, 称为最近的一支。
2.3 青蛤TLR2基因在不同组织间的表达
以β-actin在各组织中的表达量为内参对照, 利用实时荧光定量PCR分析了青蛤TLR2基因在青蛤血淋巴、肝脏、外套膜、闭壳肌、鳃和性腺等六个组织的表达情况, 结果显示青蛤TLR2基因在青蛤的以上六个组织中普遍性表达(图3), 但表达量存在明显差异, 其中血淋巴中表达含量最高, 显著高于其它组织(P<0.05), 是表达量最低的肝脏的8倍, 外套膜表达次之。表明青蛤TLR2基因主要在血淋巴中表达。


图1 青蛤TLR2基因cDNA序列的开放阅读框及功能域分析Fig.1 The open reading frame of CsTLR2 gene and analysis on the structural domain
2.4 在鳗弧菌刺激下青蛤TLR2基因在血淋巴中的时序性表达
在鳗弧菌侵染青蛤后, 以β-actin 为内参基因,利用实时荧光定量PCR分析了青蛤TLR2基因在血淋巴组织中的表达时序变化(图4)。发现实验组在感染后3h开始升高; 直到48h的时候达到了最大值, 并与对照组有极显著性差异(P<0.01), 约为对照组的6.8倍左右; 且与空白组有极显著性差异(P<0.01)。96h后其表达量开始下降, 恢复并接近至正常水平。
2.5 在藤黄微球菌刺激下青蛤TLR2基因在血淋巴中的时序性表达
在藤黄微球菌侵染青蛤后, 以β-actin为内参基因, 利用实时荧光定量PCR分析了青蛤TLR2基因在血淋巴组织中的表达时序变化(图5)。发现实验组在感染后3h开始升高; 直到48h的时候达到了最大值,并与对照组有显著性差异(P<0.05), 约为对照组的8.5倍左右。在刺激96h后其表达量开始下降, 恢复并接近至正常水平。
2.6 在Poly I:C刺激下青蛤TLR2基因在血淋巴中的时序性表达
在Poly I:C侵染青蛤后, 以β-actin为内参基因,利用实时荧光定量PCR分析了青蛤TLR2基因在血淋巴组织中的表达时序变化(图6)。发现实验组在感染后3h开始逐渐升高; 直到48h的时候达到了最大值, 并与对照组有极显著性差异(P<0.01), 约为对照组的18.3倍左右, 且与空白组有极显著性差异(P<0.01)。在刺激96h后其表达量开始下降, 恢复并接近至正常水平。
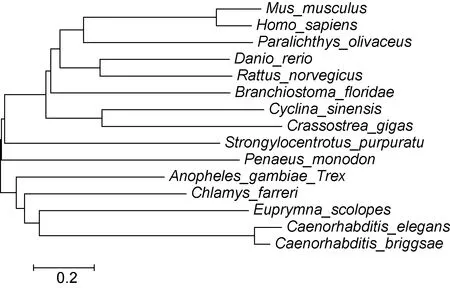
图2 使用邻接法(NJ)构建的15个物种TLRs氨基酸序列系统树Fig.2 The phylogenetic tree constructed by the amino acid sequences of TLRs of 15 species using neighbor-joining method

图3 青蛤TLR2基因在青蛤不同组织间的表达情况Fig.3 Expression characterization of C. sinensis in organs revealed by real time PCR
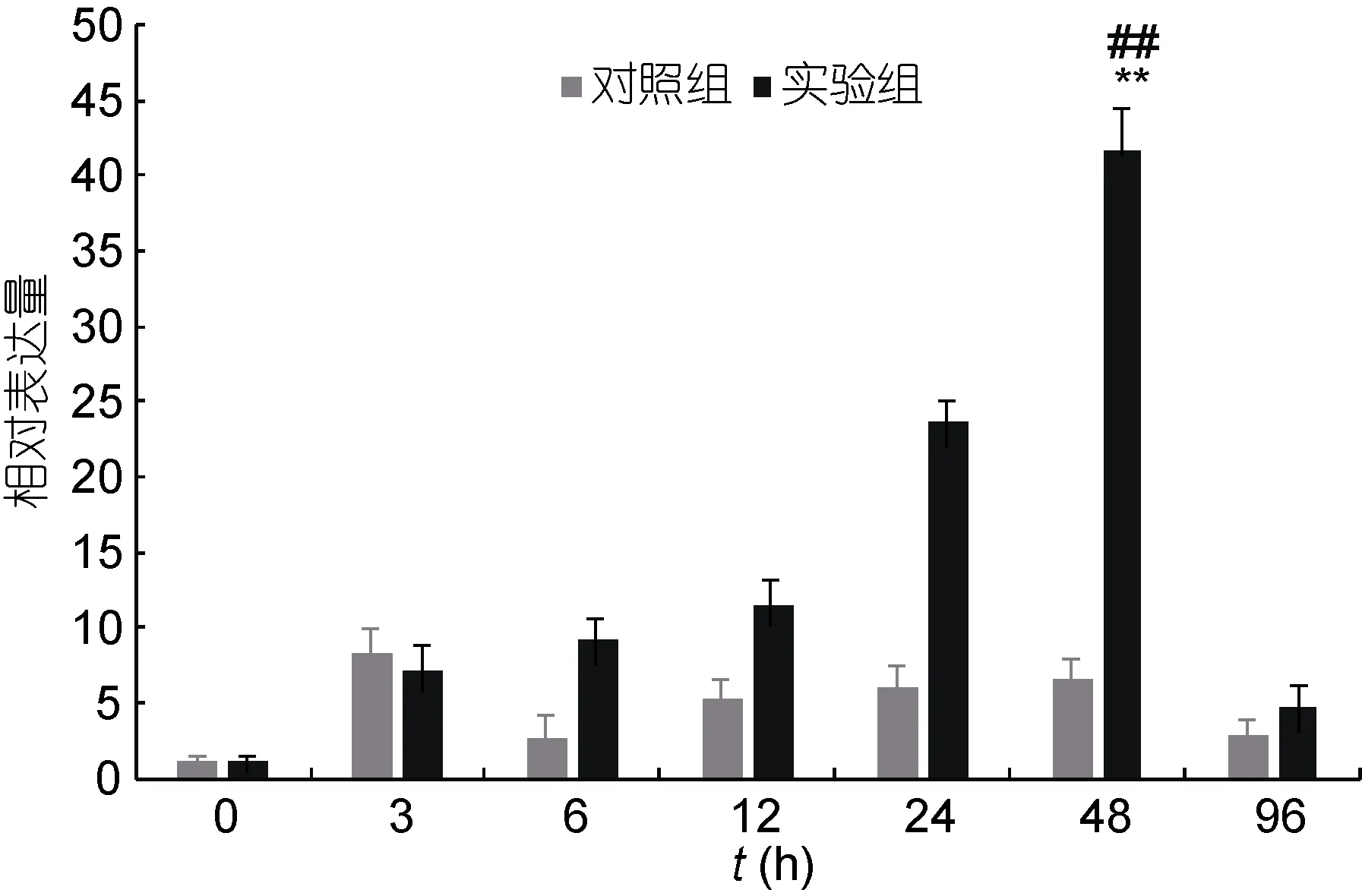
图4 青蛤血淋巴TLR2基因在鳗弧菌刺激不同时间相对表达量的变化Fig.4 The relative expression of CsTLR2 gene in hemolymph of C. sinensis infected by V. anguillarum in different periods
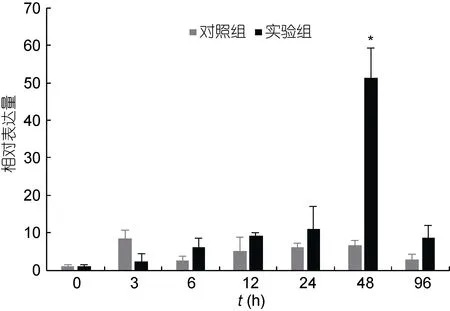
图5 青蛤血淋巴TLR2基因在藤黄微球菌刺激不同时间相对表达量的变化Fig.5 The relative expression of CsTLR2 gene in hemolymph of C. sinensis infected by M. luteus in different periods
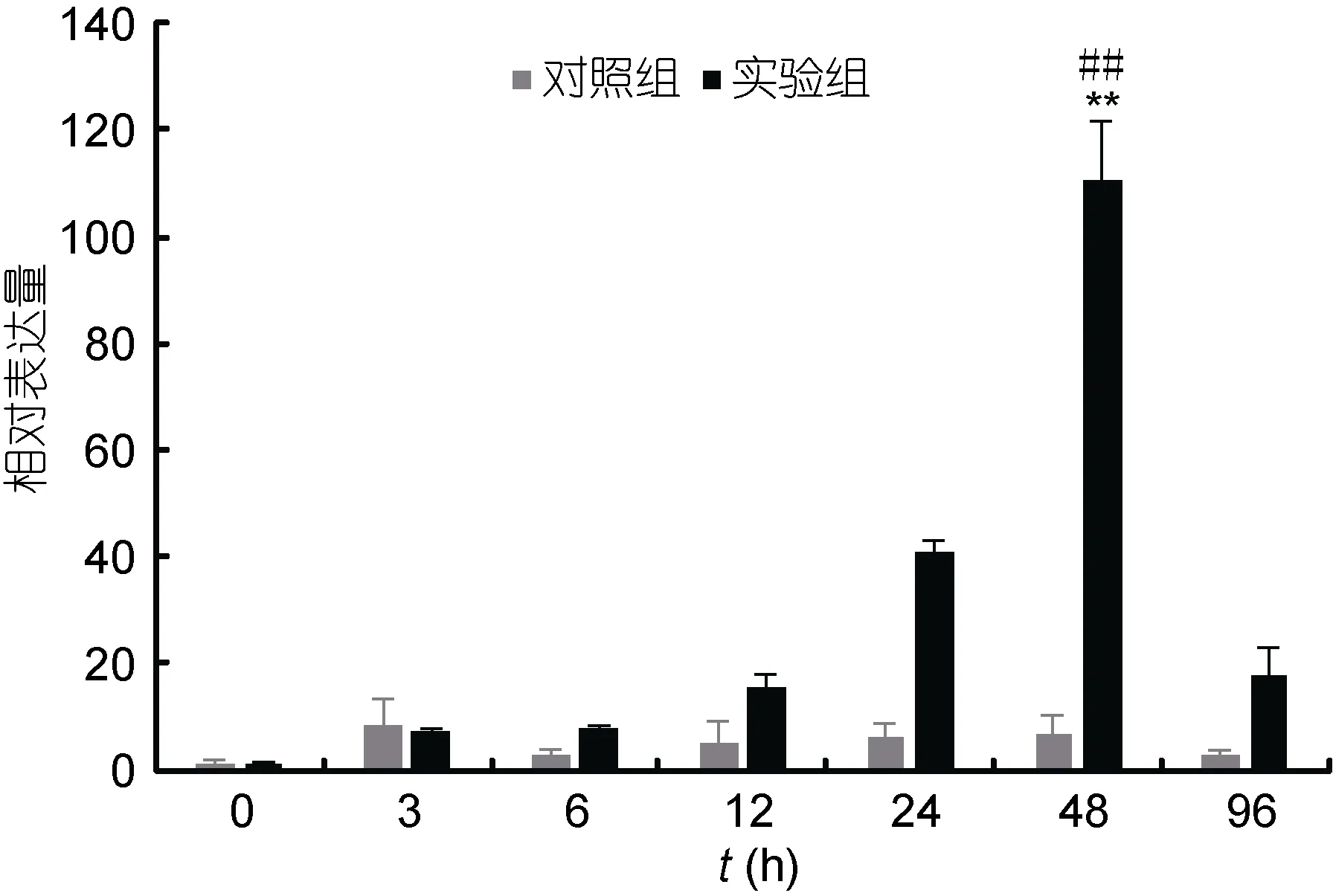
图6 青蛤血淋巴TLR2基因在Poly I:C刺激不同时间相对表达量的变化Fig.6 The relative expression of CsTLR2 gene in hemolymph of C. sinensis infected by Poly I:C in different periods
3 讨论
本研究通过转录组建库, 得到了青蛤TLR2基因的cDNA序列, 通过比对发现该基因与许多水生生物的TLR2基因亲缘关系相近, 例如长牡蛎(Crassostrea gigas)和文昌鱼(Branchiostoma floridae)等。在已经报道的长牡蛎(Gueguenet al, 2003)、太平洋长牡蛎(De Lorgerilet al, 2011)、虾夷扇贝(Houet al, 2011)、地中海贻贝(Venieret al, 2011)和夏威夷短尾鱿鱼(Goodsonet al, 2005)中都发现了TLR2基因片段, 这有利于了解软体动物非特异性免疫应答中模式识别受体的作用机制。蛋白序列经SMART结构预测与分析, 发现其胞外段存在6个LRR结构域, LRR结构域参与病原识别、信号传递、细胞粘连和细胞发育等(Buchananet al, 1996; Kajava, 1998; Bellet al, 2003)。还发现了6个N-糖基化位点, 均位于Toll样受体胞外区。几乎所有的Toll样受体都具有胞外N-糖基化位点, 其能影响受体表面的特性、结合和模式识别等有关, 例如TLR2和TLR4都有相应结构以便发挥功能(Ohnishiet al, 2003; Weberet al, 2004)。此外在胞外的TIR区域是TLRs与其下游蛋白激酶相互作用的关键部位, 与髓样分化因子88(Myd88)相互作用, 参与细胞内的信号传递。它们之间构成一种网络, 对于识别病毒、真菌、细菌等“非己”物质, 启动并激活先天免疫系统等方面有着重要的作用(Akiraet al, 2001; Goldsteinet al, 2004)。
本实验结果显示, 青蛤TLR2基因的在各组织中的表达量基本表现为血淋巴>鳃>性腺>外套膜>闭壳肌>肝脏。而且在血淋巴中的表达量与其它组织有显著性的差异(P<0.05)。血淋巴可以直接吞噬和破坏微生物, 在抗感染中发挥作用。还可以产生和释放抗菌性物质, 最后血淋巴还在炎症中的包囊形成和损伤修复中发挥作用(孙虎山等, 2001; 刘志鸿等, 2003)。青蛤的先天性免疫主要依赖于血淋巴的循环, 其在软体动物的内部防御中起到至关重要的作用(Pipeet al, 1997; Woottonet al, 2003)。青蛤TLR2基因的相对表达量在血淋巴中最高, 也再一次证明了其参与青蛤的先天性免疫反应。
无脊椎动物中存在识别和和结合细菌、真菌和病毒细胞成分的蛋白因子, 这些蛋白因子可以识别并结合微生物的脂多糖、葡萄糖等并且激发一系列的免疫反应。革兰氏阴性菌表面的脂多糖结构被称为内毒素, 是激发机体天然免疫的重要分子(Biswaset al,1999; Iwanaga, 2002); 革兰氏阳性菌表面细胞壁的主要成分肽聚糖, 其是真核生物先天性免疫系统识别的靶标(Doyleet al, 1994); Poly I:C中文名称为聚肌胞苷酸、聚肌苷酸-聚胞苷酸, 为双链RNA(dsRNA)的类似物, 可以激活青蛤的非特异性免疫, 本实验用鳗弧菌作为阴性菌的代表, 藤黄微球菌作为阳性菌的代表, 用Poly I:C模拟病毒的双链来刺激青蛤。在等量的三种外源刺激物刺激青蛤3h后, TLR2基因在血淋巴中的表达量均呈现上调的趋势, 直到48h表达量达到最大值。在鳗弧菌和Poly I:C的刺激下, 48h的相对表达量与对照组和空白组均有极显著性差异(P<0.01),在藤黄微球菌的刺激下, 48h的相对表达量也与对照组有显著性差异(P<0.05), 该结果与青蛤其它免疫相关因子如溶菌酶(潘宝平等, 2010)、磷酸酶(宋欣等,2010)的研究结果基本一致。实验结果说明在外界刺激下青蛤TLR2基因的转录水平随之升高, 其参与了青蛤的免疫应答反应, 对于革兰氏阳性菌、阴性菌和病毒均有识别作用。在鳗弧菌和Poly I:C刺激下, 青蛤TLR2基因的表达量与对照组和实验组均有显著性差异(P<0.01), 说明该基因与革兰氏阳性菌相比对于病毒和革兰氏阴性菌有更强的识别作用。本研究结果可为进一步深入研究贝类TLR2基因的作用机理奠定基础, 并为贝类养殖中的病害防治提供技术支撑。
刘志鸿, 牟海津, 王清印, 2003. 软体动物免疫相关酶研究进展. 海洋水产研究, 24: 86—90
孙虎山, 李光友, 2001. 双壳贝类参与免疫防御的体液因子.海洋科学, 25: 34—36
孙国铭, 万夕和, 刘培庭等, 2004. 通州海区滩涂青蛤死亡原因的初步分析. 水产养殖, 25(2): 26—27
宋 欣, 张丽岩, 高玮玮等, 2010. 鳗弧菌(Vibrio anguillarum)侵染对青蛤(Cyclina sinensis)磷酸酶活性的影响. 海洋与湖沼, 41(2): 254—258
曹 华, 2004. 沿海滩涂青蛤死亡原因初探及对策. 科学养鱼,(4): 47—48
潘宝平, 宋 欣, 罗凯娅等, 2010. 青蛤(Cyclina sinensis)溶菌酶基因在鳗弧菌(Vibrio anguillarum)刺激下的表达. 海洋与湖沼, 41(6): 901—906
Akira S, Takeda K, Kaisho T, 2001. Toll-like receptors: critical proteins linking innate and acquired immunity. Nat Immunol,2: 675—680
Bell J K, Mullen G E, Leifer C Aet al, 2003. Leucine-rich repeats and pathogen recognition in Toll-like receptors.Trends Immunol, 24: 528—533
Biswas C, Mandal C, 1999. The role of amoebocytes in endotoxin-mediated coagulation in the innate immunity ofAchatina fulicasnails. Scand J Immunol, 49: 131—138
Buchanan S G, Gay N J, 1996. Structural and functional diversity in the leucine-rich repeat family of proteins. Prog Biophys Mol Biol, 65: 1—44
De Lorgeril J, Zenagui R, Rosa R Det al, 2011. Whole transcriptome profiling of successful immune response to vibrio infections in the oysterCrassostrea gigasby digital gene expression analysis. PLoS ONE, 6(8): 23142
Doyle R J, Marquis R E, 1994. Flexible peptidoglycan and bacterial cell wall properties. Trends Microbiol, 2: 57—60
Goldstein D R, 2004. Toll-like receptors and other links between innate and acquired alloimmunity. Curr Opin Immunol, 16:538—544
Goodson M S, Kojadinovic M, Troll J Vet al, 2005. Identifying components of the NF-kappaB pathway in the beneficialEuprymna scolopes-Vibrio fischerilight organ symbiosis.Appl Environ Microbiol, 71: 6934—6946
Gueguen Y, Cadoret J, Flament Det al, 2003. Immune gene discovery by expressed sequence tags generated from hemocytes of the bacteria-challenged oyster,Crassostrea gigas. Gene, 303: 139—145
Hou R, Bao Z M, Wang Set al, 2011. Transcriptome sequencing andDe novoanalysis for yesso scallop (Patinopecten yessoensis) using 454 GS FLX. PLoS ONE, 6(6): 21560
Inamori K, Ariki S, Kawabata S, 2004. A Toll-like receptor in horseshoe crabs. Immunol Rev, 198: 106—115
Iwanaga S, 2002. The molecular basis of innate immunity in the horseshoe crab. Curr Opin Immunol, 14: 87—95
Janeway Jr C A, Medzhitov R, 2002. Innate immune recognition.Annu Rev Immunol, 20: 197—216
Kajava A V, 1998. Structural diversity of leucine-rich repeat proteins. J Mol Biol, 277: 519—527
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCTmethods. Methods, 25: 402—408
Medzhitov R, Janeway Jr C A, 2002. Decoding the patterns of self and non-self by the innate immune system. Science, 296:298—300
Nusslein-Volhard C, Lohs-Schardin M, Sander Ket al, 1980. A dorso-ventral shift of embryonic primordia in a new maternaleffect mutant ofDrosophila. Nature, 283: 474—476
Ohnishi T, Muroi M, Tanamoto K, 2003. MD-2 is necessary for the toll-like receptor 4 protein to undergo glycosylation essential for its translocationto the cell surface. Clin Diagn Lab Immunol, 10: 405—410
Pasare C, Medzhitov R, 2004. Toll-like receptors: linking innate and adaptive immunity. Microbes Infect, 6: 1382—1387
Pipe R K, Farley S R, Coles J A, 1997. The separation and characterisation of haemocytes from the musselMytilus edulis. Cell Tissue Res, 289: 537—545
Tauszig S, Jouanguy E, Hoffmann J Aet al, 2000. Toll-related receptors and the control of antimicrobial peptide expression inDrosophila. Proc Natl Acad Sci USA, 97: 10520—10525 Venier P, Varotto L, Rosani Uet al, 2011. Insights into the innate immunity of the Mediterranean musselMytilus galloprovincialis. BMC Genomics, 12: 69
Weber A N, Morse M A, Gay N J, 2004. Four N-linked glycosylation sites in human toll-like receptor 2 cooperate to direct efficient biosynthesis and secretion. J Biol Chem, 279:34589—34594
Wootton E C, Dyrynda E A, Ratcliffe N A, 2003. Bivalve immunity:comparisons between the marine mussel (Mytilus edulis), the edible cockle (Cerastoderma edule) and the razor-shell (Ensis siliqua). Fish Shellfish Immunol, 15: 195—210
Xu Y, Tao X, Shen Bet al, 2000. Structural basis for signal transduction by the Toll/interleukin-1 receptor domains.Nature, 408: 111—115
Yamamoto M, Akirz S, 2005. TIR domain-containing adaptors regulate TLR signaling pathways. Adv Exp Med Biol, 560:1—9
