流化冰对于鲣鱼的保鲜效果研究*
2014-03-19邓尚贵励建荣AUBOURGSantiago
高 萌 张 宾 邓尚贵 励建荣 AUBOURG Santiago
(1. 浙江海洋学院食品与医药学院 舟山 316000; 2. 渤海大学化学化工与食品安全学院 锦州 121013;3. Consejo Superior de Investigaciones Científicas (CSIC) Vigo Spain)
鲣鱼(Skipjack tuna)又称正鲣, 是金枪鱼的一种,其蛋白质含量高、营养价值好, 与黄鳍和蓝鳍金枪鱼相比, 又具有资源丰富、价格低廉等优点。据联合国粮农组织统计, 鲣鱼年产量约占金枪鱼总产量的48%以上, 已成为了全球金枪鱼渔业中最为重要的目标鱼种之一(方建民等, 2006)。鲣鱼死亡后极易腐败变质, 若在捕捞后不立即进行适当的保鲜处理, 则细菌、酶和化学变化会迅速消耗鱼肉中的营养物质, 降低鱼的品质并缩短鱼的货架期。目前常用的保鲜方法是碎冰保鲜。淡水冰在制备、船载运输等过程中需要消耗大量劳动力, 且更为重要的是碎冰具有尖锐的棱角, 会在运输过程中对鱼体表面造成损伤(如刮伤和擦伤), 进而影响鱼的商品价值。因此急需一种新的高效低耗的保鲜方法来取代碎冰保鲜。近年来, 流化冰保鲜作为一种可进行水产品快速冷却的新技术,受到了极大关注。流化冰是指由冰粒子和载液组成的两相均匀混合物, 其载液可以是由纯淡水或由水和冰点抑制剂构成的二元溶液(Kauffedet al, 2010)。流化冰冰晶的熔化潜热很高且具有很大传热表面积, 使其具备了储能密度高、冷却速率快的优良特性, 因此在冷却过程中可保持恒定低温, 并比水或其他任何单相液体制冷速度都要快(Fernández-Searaet al,2010)。此外, 流化冰可直接由海水制取, 还可经泵由管道进行输送(Ashleyet al, 2010; Kumanoet al, 2010),这使其更加适用于捕获鱼类的快速降温、远途运输及超市销售等。此外, 流化冰预冷处理可使鱼体体温由外至内快速下降, 进而杀死体表部分微生物且对未死微生物产生强烈抑制作用; 另一方面, 低温环境可有效减缓鱼体内的生化反应进程, 降低鱼体营养物质的消耗, 从而可最大限度地保持鱼体鲜度、食用价值及加工性能(Fukusakoet al, 1999; Piñeiroet al, 2004; 高红岩等, 2010)。本研究针对目前海水鱼类鲜度难保持这一问题, 以远洋钓捕鲣鱼为研究对象, 以传统淡水碎冰贮藏保鲜为对照, 重点探讨流化冰保鲜对鲣鱼鱼肉的理化性质及微生物特性的影响情况, 为远洋海水鱼类的捕后保鲜、长途运输及贮藏加工等提供参考。
1 材料与方法
1.1 材料与仪器
原材料: 鲣鱼(Skipjack tuna, 捕捞于中国东海,长550—600mm; 捕后于–30°C下速冻后, –18°C冻藏; 运至港口后立即采用无菌袋包装, 30min内运至实验室, –60°C冻藏, 备用), 由浙江兴业集团有限公司提供。
主要试剂: 氯化钠、三氯甲烷、三氯乙酸、2-硫代巴比妥酸、乙二胺四乙酸及高氯酸等, 购于国药化学试剂有限公司。所用试剂均为分析纯。
主要仪器: RF-1000-SP型流化冰生成器, 南通瑞友工贸有限公司; 751UVGD型紫外可见分光光度计,上海第三分析仪器厂; WSC-100型色差仪, 北京光学仪器公司; HS-1300型洁净工作台, 苏州安泰空气技术有限公司; MDF-U53V型超低温冰箱, 日本SANYO公司。
1.2 试验分组及处理
试验分组: 空白组、淡水碎冰保鲜组和流化冰保鲜组。流化冰的制备采用质量分数为3.3%NaCl溶液。制备流化冰组成为40%体积颗粒冰和60%体积水。
试验处理: (1)冷藏保鲜实验: 从鲣鱼背部取大小相似的鱼肉块(每块6×6×6cm, 共约1500g), 样本共30个, 鱼肉块分别用保鲜膜包好后进行空白(即将保鲜膜包好的鱼肉, 直接放入冰箱内)、淡水碎冰敷没和流化冰浸没保鲜处理, 然后置于–4°C (流化冰温度受含盐量影响, 本实验所用流化冰在–4°C下能维持较长时间的两相共存状态)冷藏条件下, 每隔1d分别取1个样本, 进行理化及微生物指标测定。(2)室温保鲜实验: 从鲣鱼背部取大小相似的鱼肉块切片(每片6×4×0.5cm, 共约750g)样本共30个, 分别置于3个密胺钵盆内, 保鲜膜进行覆盖封口, 然后将密胺钵盆放入不同保温箱中。保温箱分为空白保温箱(仅放入鱼肉, 未加其它冷却介质)、含淡水碎冰的保温箱(4h取样后换冰)及含流化冰的保温箱(4h取样后换冰)。3组样品均置于室温环境下(25±1°C), 每隔2h分别取1个样本, 进行理化及微生物指标测定。
1.3 鲣鱼理化性质及微生物测定
1.3.1 pH值测定 根据GB/T 9695.5-2008《肉与肉制品pH值测定》进行测定。
1.3.2 挥发性盐基氮(TVB-N)测定 根据SC/T3032-2007《水产品中挥发性盐基氮的测定》进行测定。
1.3.3 微生物含量测定 根据GB 4789.1-2010《食品卫生微生物学检验菌落总数测定》进行测定。
1.3.4 色差值测定 选用直径30mm透镜对样品分别测定3次。采用白度指数(International commission on illumination, CIE)L*、a*、b*表色系统,L*为明度指数,a*、b*为色调; 其中a*值越大, 颜色越接近红色(a*=60), 反之越接近绿色(a*= –60)。鲣鱼鱼肉样品主要为红色, 因此本实验采用a*值反映鱼肉肉色变化。
1.3.5 巴比妥酸值(TBA)测定 采用硫代巴比妥酸法(宁正祥, 2001)。取5g样品于加入少量石英砂的研钵中研碎, 加入50mL, 7.5%三氯乙酸(含0.1%EDTA), 振摇25min, 双层滤纸过滤2次。取5mL滤液,然后加入5mL, 0.02mol TBA溶液, 于90°C水浴中保温30min。取出后冷却1h, 12000r/min离心20min, 加入5mL氯仿于上清液中, 摇匀后静置分层。取上清液分别于532nm(OD532)和600nm(OD600)处比色并记录吸光值, 计算TBA值。TBA值(mg/kg)= [(OD532-OD600)×0.05×72.6]/(155×m)×1000, 其中m为样品质量(g)。
1.3.6 汁液流失率 称量保鲜前、后鱼肉的质量,计算汁液流失率。
汁液流失率%=(保鲜前鱼肉质量-保鲜后鱼肉质量)/保鲜前鱼肉质量×100
1.3.7 统计分析 数据处理采用SPSS 13.0统计分析软件, 结果为平均值±标准偏差; 显著性分析方法为单因素方差分析两两比较法中的LSD法。
2 结果与分析
2.1 流化冰对于冷藏鲣鱼的保鲜效果
2.1.1 流化冰对于冷藏鲣鱼pH值变化的影响 pH值常被用来作为评定水产品鲜度及品质优劣的重要指标。研究表明, 随着鱼肉pH值上升, 金枪鱼类肌肉的美味程度会大大减弱: pH值为6.0时, 鱼肉略有腥臭味, 口感不佳; pH值为6.5时, 金枪鱼类肌肉腐败变质, 不能食用(励建荣等, 2010)。流化冰保鲜鲣鱼肉pH随贮藏时间变化情况, 如图1所示。新鲜鲣鱼肉pH为5.52—5.58, 相对于其他海水鱼类较低, 其原因是鲣鱼钓捕过程中剧烈挣扎, 鱼体肌肉中大量糖原酵解产生乳酸、三磷酸腺苷降解产生磷酸, 致使肌肉pH值较低(苗振清等, 2003)。空白鲣鱼肉在0—18d贮藏时间内, pH值显著升高(至6.01); 碎冰冰敷保鲜鱼肉pH也表现出明显上升趋势(5.68), 表明碎冰敷冰保鲜无法有效抑制腐败微生物及内源酶活性, 致使鱼肉蛋白分解生成氨基酸、AMP脱氨、TMAO分解产生TMA及DMA等含氮碱性化合物, 致使鱼肉pH值上升、品质下降(Yamamotoet al, 1994)。而流化冰保鲜鲣鱼肉在整个冷藏期内, 肌肉pH值均维持在一个较低的范围内(5.53—5.59), 说明流化冰浸没保鲜法可有效降低鱼体内酶的活性, 减缓酶促反应的进行, 进而抑制肌肉pH值的升高。
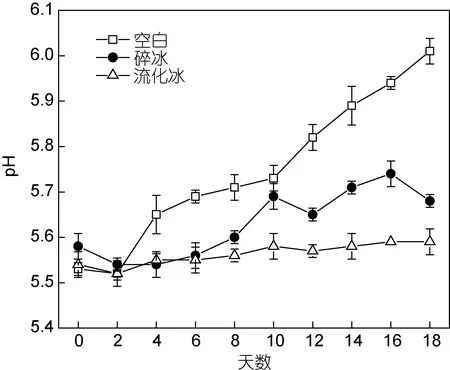
图1 不同保鲜方式下鲣鱼肉pH的变化(–4°C)Fig. 1 Changes of pH values in different preservation methods at–4°C
2.1.2 流化冰对于冷藏鲣鱼TVB-N含量的影响
挥发性盐基氮(TVB-N)与动物性食品的腐败程度之间有明确的对应关系, 它是评定动物性食品新鲜度的重要化学指标。水产品TVB-N值在冷藏期间不断升高, 是由于体内的酶和微生物使肌肉蛋白质分解产生氮及胺类等碱性含氮物质所引起的(王秉栋,1989)。部分学者提出, 鱼类肌肉TVB-N值<12mgN/100g为新鲜鱼、12—20mgN/100g为品质略下降但仍可食用、20—25mgN/100g为可食用的临界值、>25mgN/100g则被定为已腐败不可食用(刘源等, 2010)。我国《生食金枪鱼》标准(SC/T 3117-2006)中要求真空包装的低温生食金枪鱼TVB-N含量≤25mgN/100g。由图2可知, 贮藏期间空白组鱼肉TVB-N值迅速上升, 并于第12d达到不可食用程度(25.1mgN/100g); 碎冰保鲜鱼肉TVB-N值上升较空白组缓慢, 但在整个冷藏过程中仍有较大幅度变化, 18d后为20.3mgN/100g; 流化冰保鲜鱼肉TVB-N值仅在冷藏前期有一定程度上升,而经过18d冷藏后鱼肉TVB-N值仅为11.2mgN/100g, 可见流化冰可抑制TMAO还原酶的活性(Ryderet al,1984), 使鲜度保持良好。
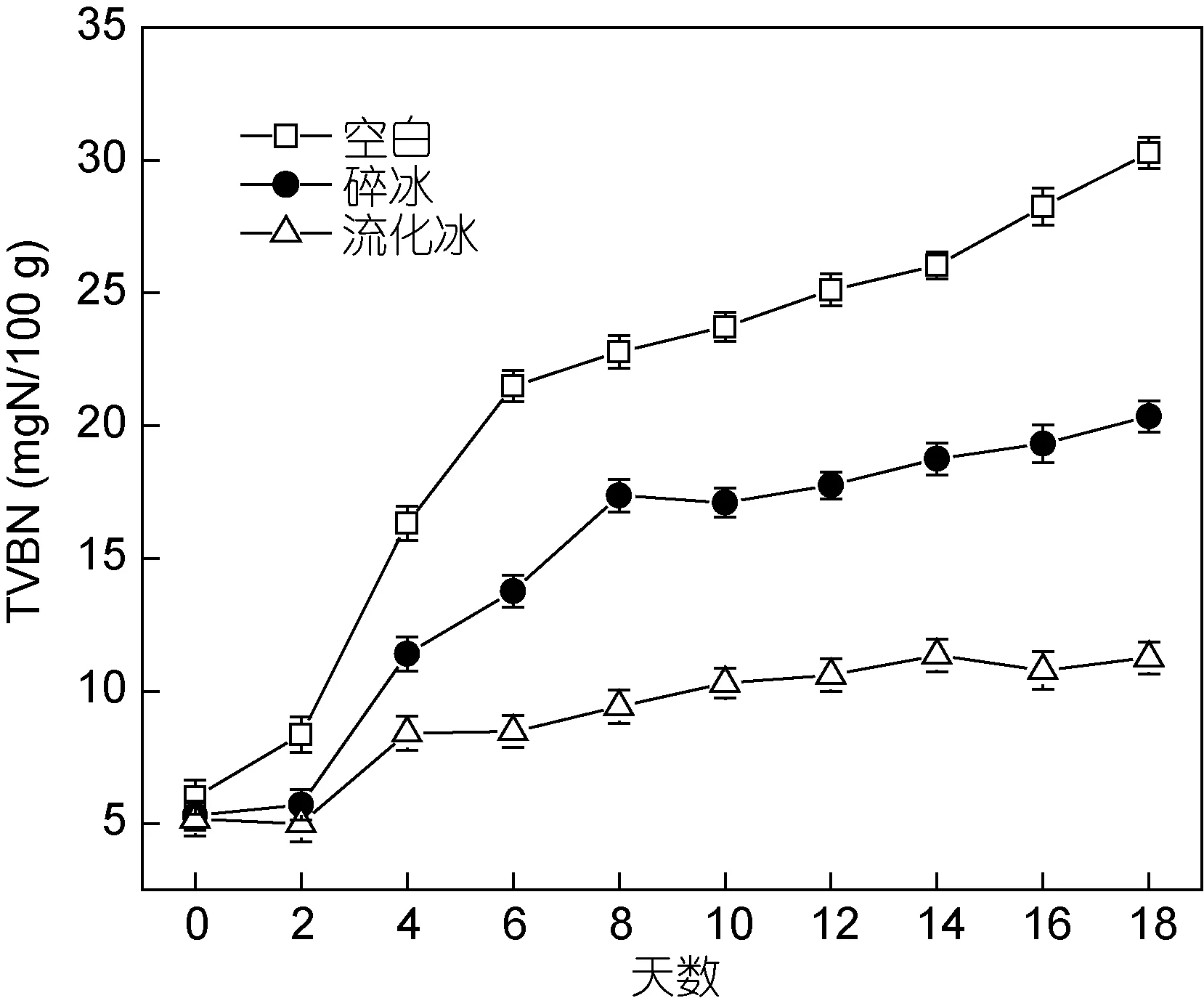
图2 不同保鲜方式下鲣鱼肉TVB-N的变化(–4°C)Fig.2 Changes of TVB-N values in different preservation methods at –4°C
2.1.3 流化冰对于冷藏鲣鱼中菌落总数的影响 菌落总数作为判定水产品受污染程度的重要指标,《生食金枪鱼》标准(SC/T3117-2006)要求生食金枪鱼中菌落总数≤4lgCFU/g。由图3可知, 在0—18d冷藏时间内, 空白、碎冰及流化冰保鲜处理鲣鱼肉中,菌落总数均呈明显上升趋势, 其中空白鱼肉菌落总数上升速率最快, 并在第14—16d接近于限量标准,此变化趋势符合鱼肉pH及TVB-N值测定结果; 对于碎冰和流化冰处理组, 菌落总数在冷藏初期(0—4d)上升速率较快, 而在冷藏中后期逐渐趋于平缓, 并始终维持在一个较低水平范围内(18d后为3.02lgCFU/g和2.61lgCFU/g); 同时, 流化冰处理组在整个贮藏期内, 菌落总数始终低于碎冰处理组, 其抑制微生物繁殖效果显著。冷藏初期(0—4d), 碎冰与流化冰组菌落总数迅速上升, 其原因可能是由于所用碎冰及流化冰本身含有大量细菌, 在浸没处理初期对鱼肉产生了污染, 该问题可通过在流化冰中加入一定的抑菌物质加以控制(关于流化冰结合生物抑菌剂保鲜技术研究将另文报道)。
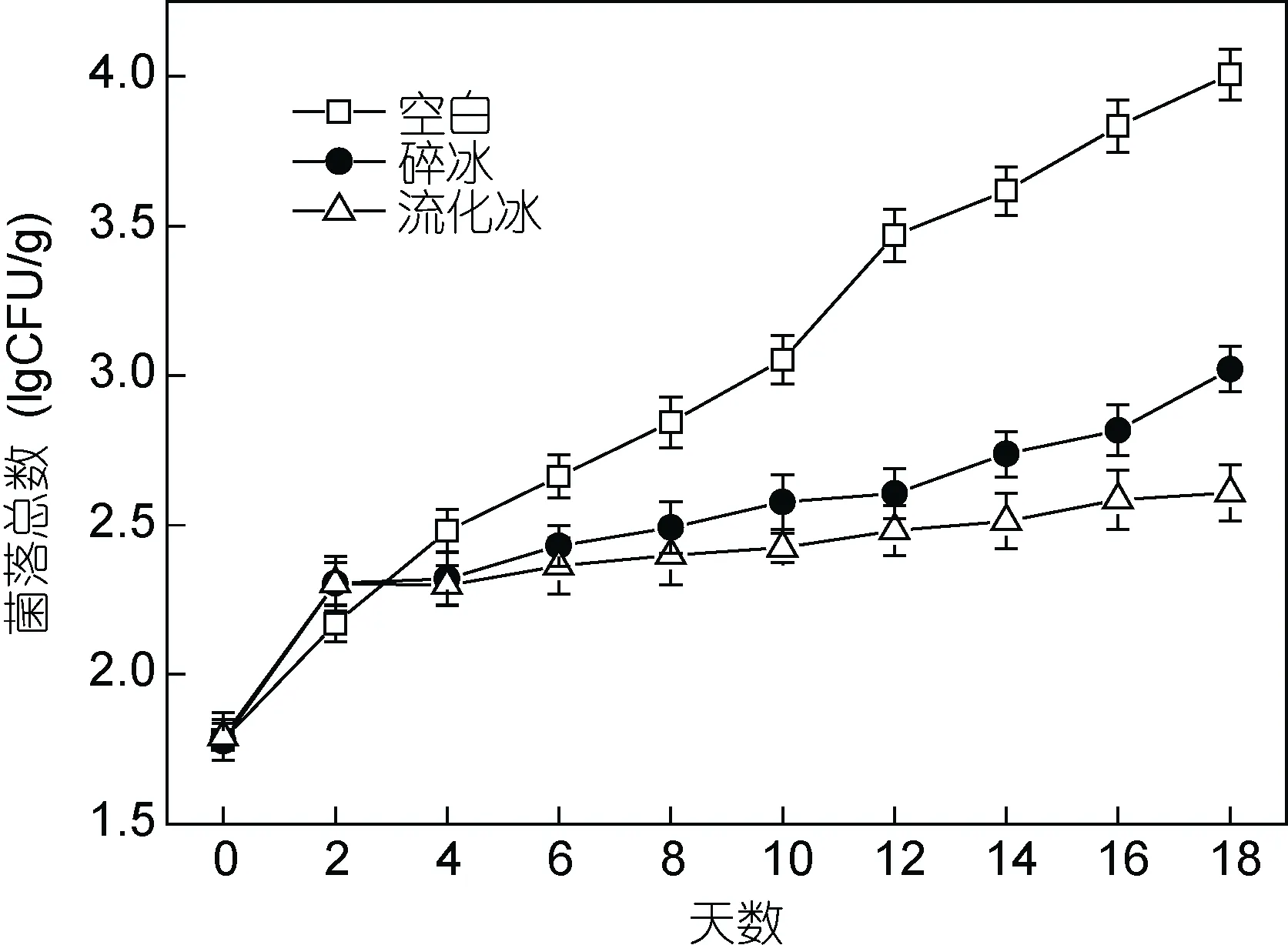
图3 不同保鲜方式下鲣鱼肉菌落总数的变化(–4°C)Fig.3 Changes in total viable count in different preservation methods at –4°C
2.1.4 流化冰对于冷藏鲣鱼肉色的影响 鲣鱼鱼肉在冻藏及后续加工过程中, 会有明显颜色变化, 其颜色测量值和感官评价具有很好的相关性。流化冰保鲜对于鲣鱼肉色的影响, 如图4所示。随着冷藏时间延长, 空白、碎冰及流化冰保鲜鲣鱼肉a*值均呈明显下降趋势, 其中流化冰组变化幅度(a*值18d后为8.92)显著低于空白组和碎冰组(a*值18d后为7.17)。冷藏鲣鱼肉贮藏过程中,a*值下降主要是由于鱼肉中还原型肌红蛋白与含有二价铁离子的氧合肌红蛋白发生自动氧化, 生成呈褐色的含有三价铁离子的氧化肌红蛋白(叶伏林等, 2012)。由结果可知, 流化冰保鲜处理对于鲣鱼肌肉色泽表现出一定的正调节作用, 其作用机制可能是流化冰处理显著抑制了鲣鱼肉中含三价铁的氧化肌红蛋白的生成, 进而减缓鱼肉的褐变速度, 维持了鱼肉原有色泽(机制有待进一步研究)。
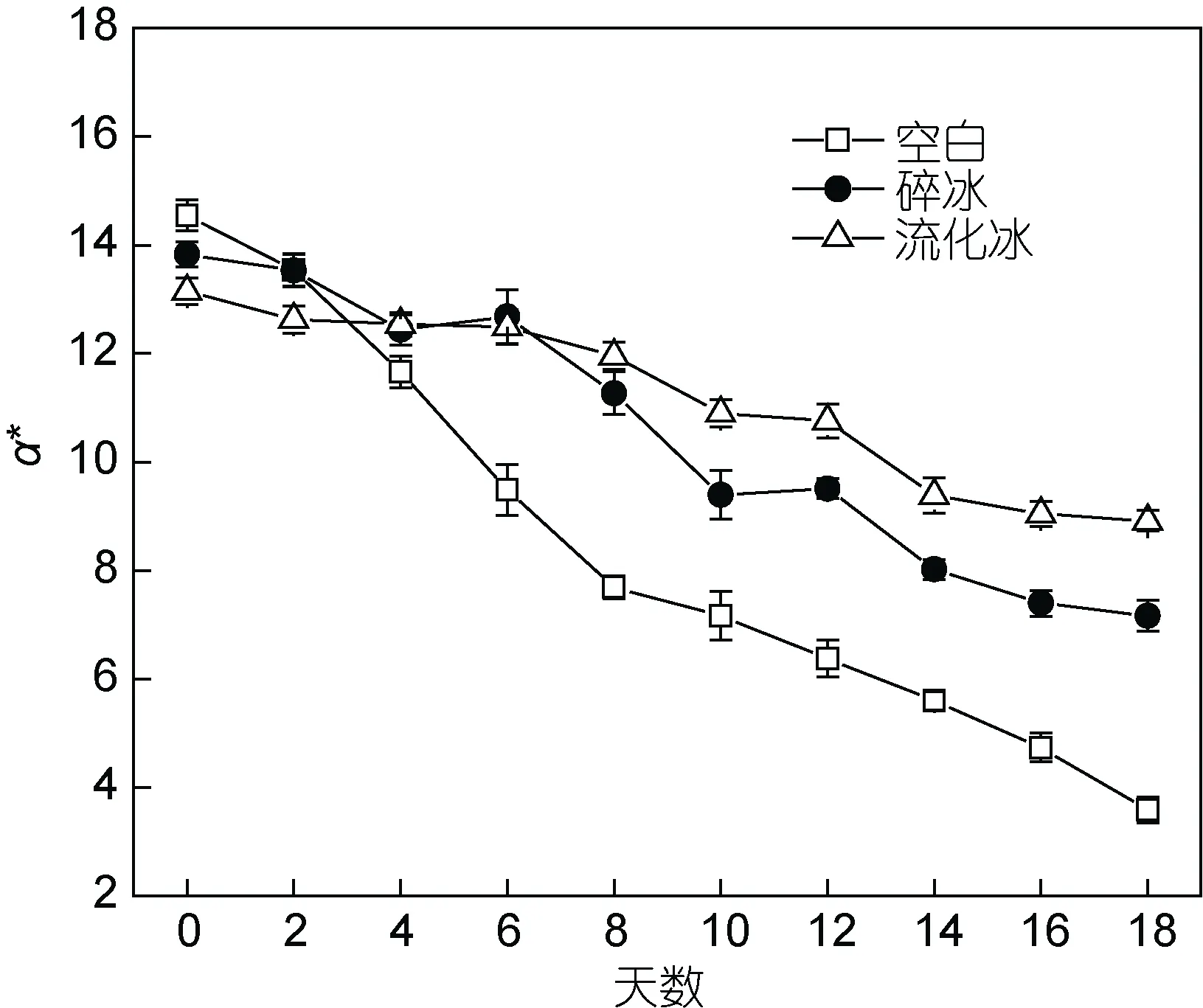
图4 不同保鲜方式下鲣鱼肉红度值的变化(–4°C)Fig.4 Changes of a* values in different preservation methods at –4°C
2.1.5 流化冰对于冷藏鲣鱼TBA含量的影响 TBA值是目前表征脂肪氧化程度最常用方法之一, 主要是测定脂肪氧化分解为丙二醛的程度。鲣鱼油脂含量较高, 尤其多不饱和脂肪酸含量丰富, 因此在冻藏过程中会发生自动氧化或水解作用, 产生低级醛酮类,致使鱼肉变色酸败(单衡明, 2002; 王亚青等, 2003)。由图5可知, 空白和碎冰保鲜鲣鱼肉TBA值在贮藏过程中快速上升, 冷藏18d后分别达到7.93mg/100g和6.60mg/100g。流化冰保鲜鲣鱼肉TBA值在冷藏初期(0—8d)有所上升, 第10d后达2.64mg/100g, 而第10—18d内无显著性变化。由此可见, 普通的碎冰敷冰浸没处理, 由于碎冰间隙中仍存在大量空气, 无法有效抑制鲣鱼肉的脂肪氧化。流化冰作为一种颗粒冰和水相的两相混合物, 其冰粒细小、圆滑且具有流动性, 可快速包裹鱼体表面并与之紧密接触, 因此通过其良好的密封作用和极高的冷却速度, 有效抑制了鱼肉的脂肪氧化及微生物繁殖, 从而确保了鱼体的新鲜度和保质期。
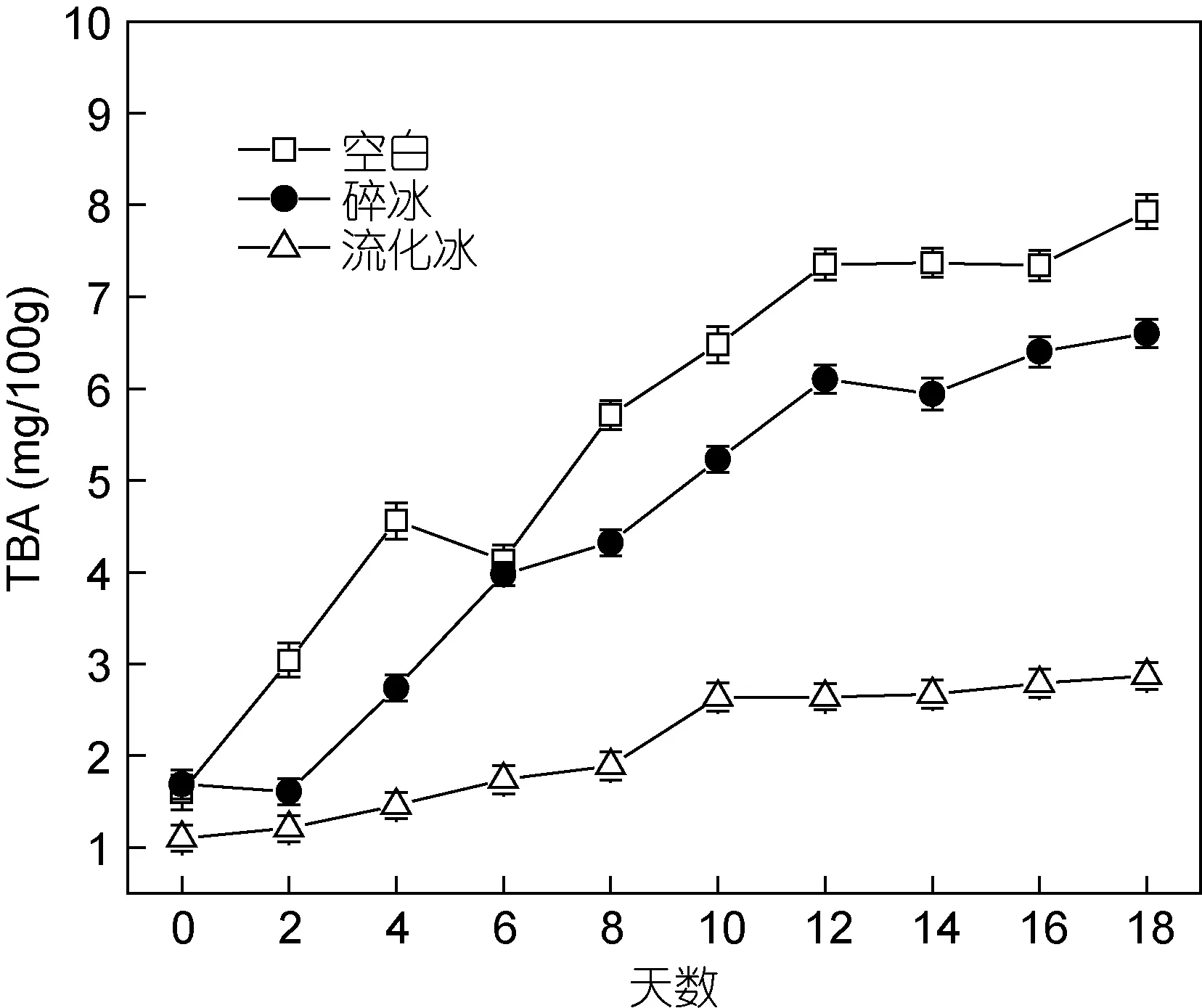
图5 不同保鲜方式下鲣鱼肉TBA的变化(–4°C)Fig.5 Changes of TBA values in different preservation methods at –4°C
2.2 流化冰对于室温下鲣鱼的保鲜效果
2.2.1 流化冰对于鲣鱼pH、TVB-N及TBA的影响如表1所示, 在室温条件下通过保温箱来保鲜样品时, 空白和碎冰处理鲣鱼肉pH值, 在0—2h内无显著性变化, 在2—8h开始迅速升高(P<0.05); 而流化冰处理鲣鱼肉pH值在0—6h内无显著性变化, 仅在6—8 h内显著性增加(P<0.05); 从第6h起, 流化冰处理组pH值显著低于空白、碎冰处理组(P<0.05), 表明流化冰处理对于室温下贮藏鱼肉仍具有较好的保鲜效果。
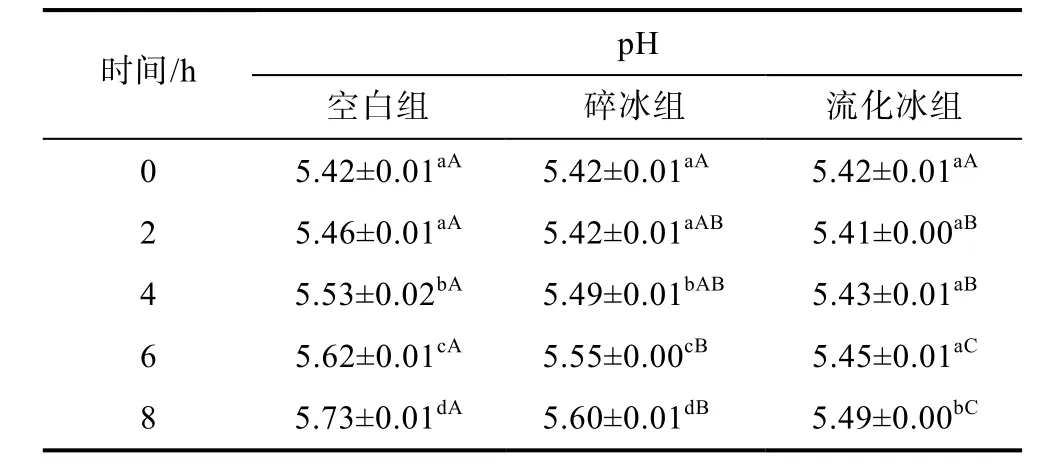
表1 不同保鲜方式下鲣鱼肉pH值的变化(25±1°C)Tab.1 Changes of pH values in different preservation methods at 25±1°C
由TVB-N测定结果(表2), 空白鱼肉在3—5h内品质已有所下降但仍可食用, 在5—7h左右达到临界值, 8h时完全超过可接受范围(29.43mgN/100g)。碎冰组鱼肉在4h时仍能保持新鲜水平, 且在8h内鱼肉品质略下降但仍可食用(17.78mgN/100g)。流化冰组鱼肉TVB-N值在6h时才达到10.90mgN/100g, 仅在8h左右时略超出了新鲜范围, 保持在12.40mgN/100g,远低于食用临界值。由鱼肉TBA值测定结果, 空白组鱼肉脂肪氧化随着贮藏时间延长显著性增强, 8h时TBA值为1.83mg⁄kg; 碎冰鱼肉在贮藏前期(0—6h)脂肪氧化速度较快, 后期(6—8h)氧化速度逐渐减慢;流化冰组鱼肉前期氧化速度较慢, 而后期略有加快,但在8h时TBA值比空白组小1.01mg/kg、仅为碎冰组1/2左右。由此可见, 在室温条件下, 流化冰依靠其较高的载冷能力, 对贮藏鲣鱼肉仍具有较好保鲜效果。

表2 不同保鲜方式下鲣鱼肉TVB-N值及TBA值的变化(25±1°C)Tab.2 Changes of TVB-N and TBA values in different preservation methods at 25±1°C
2.2.2 流化冰对于鲣鱼肉中菌落总数的影响 由表3可知, 空白组鱼肉中菌落总数, 随贮藏时间延长而不断上升(P<0.05); 碎冰及流化冰组鱼肉中菌落总数则是经过短暂下降后(0—2h)又开始逐渐上升(2—8h), 且流化冰组上升速率最为缓慢。在贮藏8h时, 流化冰组菌落总数仅相当于空白组2h、碎冰组6h时的水平。由此可见, 在无交叉污染情况下, 流化冰强制冷能力可有效抑制鲣鱼鱼肉中微生物的生长与繁殖。
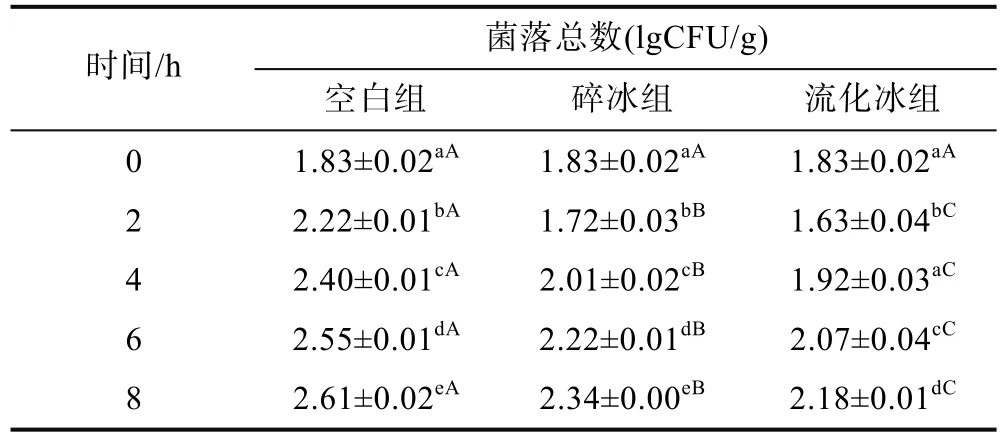
表3 不同保鲜方式下鲣鱼肉中菌落总数的变化(25±1°C)Tab.3 Changes of total viable count in different preservation methods at 25±1°C
2.2.3 流化冰对于鲣鱼汁液流失率及肉色变化的影响 如表4所示, 实验过程中3组a*值均明显降低。空白组a*值变化始终显著; 碎冰组贮藏前期(0—4h)a*值变化较快, 后期(4—8h)a*值变化逐渐减缓;流化冰组在整个实验中a*值变化较慢, 仅在最后阶段(6—8h)有明显变化。碎冰及流化冰组在8h内对a*值的保护作用明显优于空白组, 且流化冰组在4h后显著优于碎冰组(P<0.05)。由于空白组内发生的生化反应较剧烈, 故其汁液流失率较高。而碎冰组与流化冰组虽生化反应较缓慢, 但在处理过程中由于温度下降至冰点以下, 组织细胞内部会产生大小不一的冰晶, 从而对细胞膜结构造成机械损伤; 而实验中伴随着解冻过程, 由于细胞膜已被破坏, 细胞液中一些营养组分(可溶性蛋白等)随之溶出, 宏观上表现为组织的汁液流失(李金平等, 2010), 故碎冰组与流化冰组汁液流失率变化同样显著(P<0.05)。由于流化冰制冷迅速, 能使鱼快速降温, 故形成的冰晶较小, 因而汁液流失率较低。
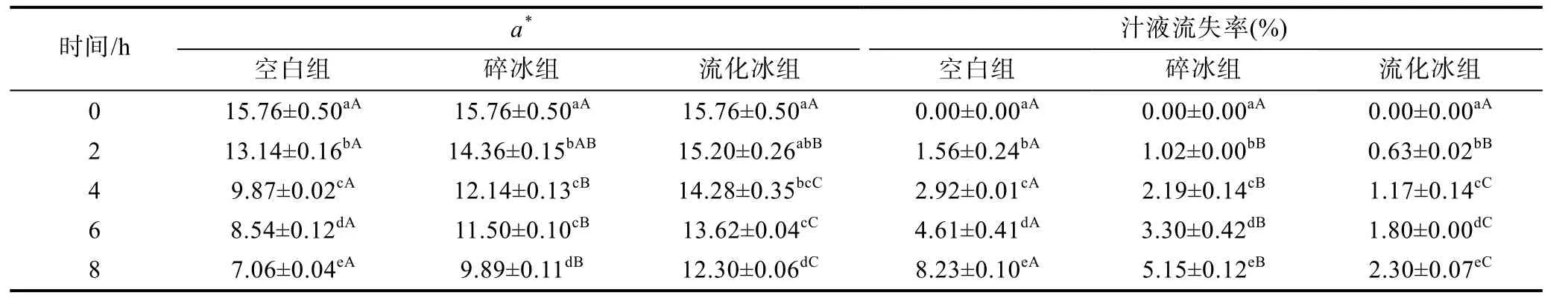
表4 不同保鲜方式下鲣鱼肉中a*值的变化(25±1°C)Tab.4 Changes of a* values in different preservation methods at 25±1°C
3 结论
本文以远洋鲣鱼为研究对象, 以空白和传统碎块冰保鲜处理为对照, 研究了流化冰保鲜对于冷藏及室温贮藏下鱼肉理化性质及细菌总数的影响情况。结果表明, 相比于淡水碎冰处理及空白组, 流化冰保鲜能更好地维持鲣鱼鱼肉各方面品质, 至冷藏结束时流化冰保鲜鱼肉pH值、TVB-N、TBA、a*值和菌落总数等指标变化幅度均明显小于其它方法。在室温贮藏保鲜条件下, 流化冰组鱼肉a*值、pH值、TVB-N、TBA和菌落总数及汁液流失率, 均显著低于空白和淡水碎冰保鲜处理组(P<0.05)。可见, 在运输及销售中应用流化冰预冷与冰温贮藏技术, 可有效减慢鲣鱼鱼肉腐败变质速度, 更好地保持其鲜度和感官品质, 是一种高效的保鲜方法。
王亚青, 程裕东, 袁春红, 2003. 冻藏过程中鱼类脂肪氧化的研究现状. 中国食品学报, 3(1): 97—100
王秉栋, 1989. 动物性食品卫生理化检验手册. 上海: 上海科学技术出版社, 290—292
方健民, 黄富维, 郑钟新等, 2006. 金枪鱼的营养价值和加工利用. 水产科技, 2: 8—13
叶伏林, 顾赛麒, 刘 源等, 2012. 反复冻结-解冻对黄鳍金枪鱼肉品质的影响. 食品与发酵工业, 38(1): 172—177
宁正祥, 2001. 食品成分分析手册. 北京: 中国轻工业出版社,120—121
刘 源, 王锡昌, 罗 殷, 2010. 冰鲜法对黄鳍金枪鱼片品质的影响. 食品科学, 31(2): 273—276
李金平, 李春保, 徐幸莲等, 2010. 反复冻融对牛外脊肉品质的影响. 江苏农业学报, 26(2): 406—410.
励建荣, 李婷婷, 李学鹏, 2010. 水产品鲜度品质评价方法研究进展. 北京工商大学学报自然科学版, 29(2): 1—8
苗振清, 黄锡昌, 2003. 远洋金枪鱼渔业. 上海: 上海科学技术文献出版社, 245—246
单衡明, 2002. 不同冻藏温度对梭子蟹品质的影响. 冷饮与速冻食品工业, 8(1): 10—12
高红岩, 王丽娜, 张国胜等, 2010. 流化冰预冷与冰温贮藏复合技术水产品保鲜应用分析. 渔业现代化, 37(2): 51—54
Fernández-Seara J, Diz R, Uhía F Jet al, 2010. Experimental analysis on pressure drop and heat transfer of a terminal fancoil unit with ice slurry as cooling medium. International Journal of Refrigeration, 33(6): 1095—1104
Fukusako S, Kozawa Y, Yamada Met al, 1999. Research and development activities on ice slurries in Japan. Proceedings of the First Workshop on Ice Slurries of the International Institute of Refrigeration, 83—105
Kauffeld M, Wang M J, Goldstein Vet al, 2010. Ice slurry applications. International Journal of Refrigeration, 33(8):1491—1505
Kumano H, Hirata T, Shirakawa Met al, 2010. Flow characteristics of ice slurry in narrow tubes. International Journal of Refrigeration, 33(8): 1513—1522
Monteiro A C S, Bansal P K, 2010. Pressure drop characteristics and rheological modeling of ice slurry flow in pipes.International Journal of Refrigeration, 33(8): 1523—1532
Piñeiro C, Barros-Velázquez J, Aubourg S P, 2004. Effects of newer slurry ice systems on the quality of aquatic food products: a comparative review versus flake-ice chilling methods. Trends in Food Science and Technology, 15(12):575—582
Ryder J M, Buisson D H, Scott D Net al, 1984. Storage of New Zealand jack mackerel (Thrachurus nouaezelandoae) in ice:chemical, microbiological and sensory assessment. Journal of Food Science, 49(6): 1453—145
Yamamoto K, Yoshida Y, Morita Jet al, 1994. Morphological and physicochemical changes in the myosin molecules induced by hydrostatic pressure. Journal of Biochemistry, 116(1):215—220
