新疆石河子地区部分规模化猪场猪多杀性巴氏杆菌的分离鉴定及耐药性分析
2014-03-18韩太武赵春光新疆石河子市兽医卫生检疫所832000
韩太武 杨 超 赵春光 (新疆石河子市兽医卫生检疫所 832000)
猪多杀性巴氏杆菌是猪呼吸道综合征的重要原发感染菌[1],有两种常见的猪传染病是由多杀性巴氏杆菌引起的,即猪传染性胸膜肺炎和猪肺疫[2]。其可导致大批猪迅速死亡,给我国养猪业造成了非常大的经济损失,根据菌株间抗原成分的差异,多杀性巴氏杆菌可分为多个血清型。用被动血凝试验对荚膜抗原分类,该菌可分为A、B、C、D、E、F共5个血清型;用凝集反应对菌体抗原分类可分为12个血清型;用琼脂扩散试验对热浸出菌体抗原分类,本菌可分为16个血清型[3]。
该病一年四季均可发生,多在春夏呈爆发[1]。多呈散发性,但有时猪可呈地方流行性,最急性型,全身黏膜、浆膜和皮下组织有出血点,全身淋巴结轻度肿胀、出血、切面深红[4];心外膜和心包膜有出血点;肺急性水肿,呈红白相间的大理石样花纹;脾有出血,但无肿大;皮肤有红斑。急性型,特征性的病理变化为纤维素性肺炎,肺有不同程度的肝变区,周围常伴有水肿和气肿,病程长的肝变区内有坏死灶,肺小叶间浆液浸润,切面呈大理石样纹理;胸膜常有纤维素性附着物,严重的胸膜与病肺粘连;胸腔及心包积液。胸腔淋巴结肿胀,面发红,多汁;支气管、气管内含有多量泡沫状黏液,黏膜发炎。慢性型,以慢性肺炎变化为主。肺肝变区扩大并有黄色或灰色坏死灶,外面有结缔组织包裹,内含干酪样物质,有的形成空洞并与支气管相同;心包与胸腔积液,胸腔有纤维素性沉着,肋膜肥厚,常与病肺粘连。
多杀性巴氏杆菌是规模化猪场的一类重要病菌,严重影响猪群健康[5],在防制方面,首先应注意饲养管理,消除可能降低抵抗力的应激因素,其次应尽可能避免病原侵入,并对圈舍、饲槽、饮水器具定期进行消毒,猪舍内外用2%烧碱彻底消毒[6]。同时定期进行预防接种,增强机体对本病的特异性免疫力。发生本病时,应将患病动物隔离,及早确诊,及时治疗。
目前常用的疫苗是以灭火苗和弱毒苗为主,猪肺疫的预防可用猪肺疫口服弱毒苗,猪肺疫氢氧化铝灭火苗、猪瘟-猪丹毒-猪肺疫三联活疫苗,猪丹毒-猪肺疫氢氧化铝二联灭活苗这四种疫苗免疫期均在半年以上。多杀性巴氏杆菌分布广泛、血清型较多,不同地区的菌种差异明显,导致免疫效果不理想[3]。因而研究的疫苗还不能对多种血清型的菌株引起的疾病都起预防作用,研发针对多种血清型的疫苗是今后研究的方向[7]。
1 材料与方法
1.1 材料
1.1.1 病料 病料采自新疆石河子地区部分规模化猪场送检的因呼吸道引起死亡的猪或濒死猪,无菌采集其肺脏,-20℃保存备用。
1.1.2 培养基和菌株 普通琼脂培养基、5%兔鲜血培养基、麦康凯培养基、LB肉汤、生化鉴定培养基(均石河子大学实验室提供)。
1.1.3 菌株及血液 兔血采自新疆石河子大学动物医院。
1.1.4 主要仪器 CX21FS1生物显微镜、ZHWY-2102C恒温培养振荡器、HDX-9162mBE电热恒温培养箱、单人双面超净工作台、高速冷冻离心机、隔水式恒温培养箱、立式电热压力蒸汽灭菌锅等。
1.1.5 试验动物 25日龄左右的小白鼠8只(均购于新疆石河子动物养殖中心)。
1.1.6 药敏纸片 购于北京华美生物技术有限公司。
1.1.7 主要培养基的配制 TSA和TSB培养基按照相应说明书进行配制,121℃高压灭菌20min后,室温保存备用。培养猪多杀性巴氏杆菌用的TSA在倾注平板前加入5%~10%犊牛血清,TSB待冷却后加入5%~10%犊牛血清。
1.2 试验方法
1.2.1 猪多杀性巴氏杆菌的分离鉴定 (1)Pm的分离培养:将无菌采集的疑似猪多杀性巴氏杆菌感染的病变的肺脏,分别无菌接种到TSB(含5%犊牛血清)培养基上,置37℃增菌培养24h后,接种于脑心浸液鲜血琼脂平板和麦康凯平板,37℃培养24h,观察细菌生长情况、菌落形态以及是否溶血,挑选单个菌落无菌接种到TSA(含5%犊牛血清)培养基上进一步鉴定。(2)细菌培养:将纯化好的细菌划线接种TSA平板,麦康凯琼脂培养基平板,然后分别转接葡萄糖、果糖、甘露醇、麦芽糖、乳糖、鼠李糖等碳源生化鉴定管以及吲哚VP、mR硝酸盐还原生化鉴定管进行生化反应。
1.2.2 药物敏感试验 将已经纯化好的Pm,挑取单个菌落接种到脑心浸液培养基,经过37℃培养14h后,采用比浊管进行比浊计数,后将已经鉴定好的Pm菌株用灭菌的棉拭子均匀涂到到TSA(含5%血清)平板上,然后做药敏试验,贴上标准药敏试纸,经过37℃培养18h后,通过测量药物纸片在平板中产生的抑菌圈直径大小来的标准来判断菌株对药物的敏感程度,每个药敏纸片做3个,结果取其算术平均值。
1.2.3 动物致病试验 将以上分离的所有细菌挑选4菌株接种到TSA(含5%血清)培养基上37℃培养18~24h后,将试验的所有公鼠均匀分为5组,每组选择4个精神状况相似的、个体大小相近的小鼠作为感染实验对象,每株注射4只,最后一组为对照组,试验组每只小鼠腹腔注射菌液0.3ml,对照组腹腔注射相同体积的LB肉汤,隔离例养并观察小鼠的征状,对发病或死亡的小鼠进行剖解,采取病变部位进行细菌分离鉴定。
2 结果
2.1 细菌分离鉴定及部分生物学特性
2.1.1 细菌的培养特性及形态 病料接入TSA(含5%犊牛血清)培养基上,培养14h后,有蓝色荧光,菌落润滑,似水珠状的菌株,分离菌在普通琼脂上生长缓慢,24h后才出现零星的菌株,在麦康凯琼脂上不生长。在脑心浸液鲜血琼脂平板上培养24h后,出现灰白色、光滑湿润、边缘整齐的水滴样小菌落,无溶血现象,同时挑取单个的菌落进行涂片镜检,从显微镜可以看出两级着色的杆菌,初步诊断多Pm菌。
2.1.2 细菌的生化特性 多杀性巴氏杆菌的判定标准为:麦康凯培养基上不能生长,分离菌株能发酵葡萄糖、果糖、甘露醇产酸不产气,不发酵麦芽糖、乳糖、鼠李糖,吲哚、硝酸盐还原试验阳性,mR、VP试验阴性,本次生化结果共分离出Pm菌共12株,主要从病猪的肺脏上分离出。
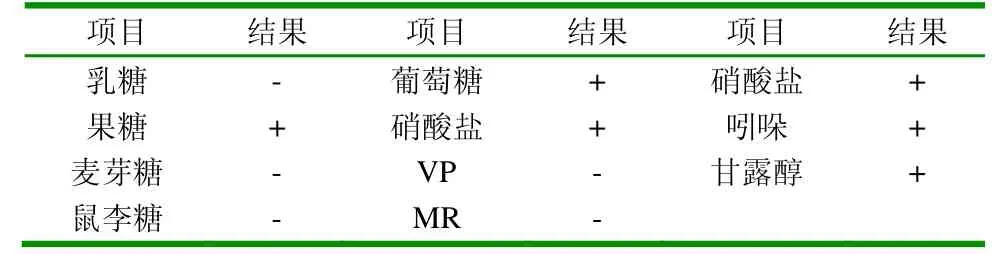
表1 生化试验结果
2.2 细菌药敏试验结果
从药敏结果可以看出:从新疆石河子地区部分规模化猪场猪猪多杀性巴氏杆菌对先锋VI、氯霉素、环丙沙星敏感性较强,其耐药率分别为83.3%、75%、75%,而该菌对其他几种抗生素耐药率较强,该菌对四环素的耐药率为66.7%。
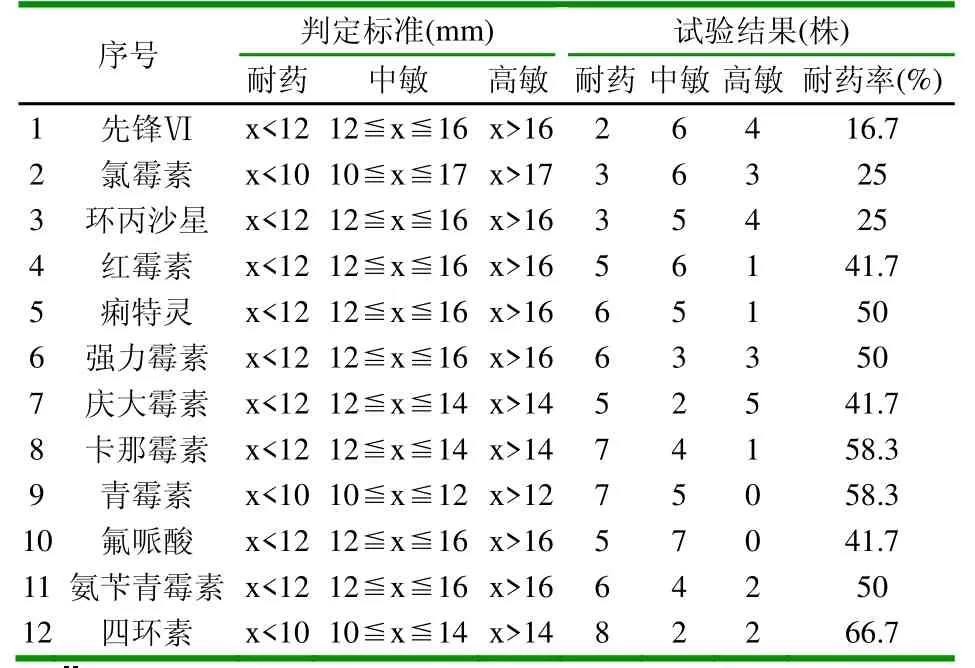
表2 12种抗生素对12株猪多杀性巴氏杆菌抑制作用

图 12种抗生素对12株传染性胸膜肺炎放线杆菌抑制作用
2.3 动物接种试验结果
经过对其中4株Pm菌的致病力进行动物接种试验可知小鼠的死亡情况见表3,XNC01、XNC02、XNC03、XNC04四株菌的致死率分别为25%、100%、100%、75%,同时将死亡的小鼠肺组织接种到TSA(含5%血清)培养基平板上可见有蓝色荧光,菌落润滑,似水珠状的菌株,经过涂片镜检可以看出两极着色的球杆菌。

表3 Pm菌致病力试验
3 讨论
3.1 Pm生物学特性
根据发病猪群的流行病学特征、临床征状、实验室检验结果,综合鉴定此分离菌为猪多杀性巴氏杆菌。同时可以得知,该菌对人工培养基具有选择性,分离菌在普通琼脂上生长缓慢,24h后才出现零星的菌株,在麦康凯琼脂上不生长,但是在TSA(含5%犊牛血清)培养基上生长旺盛,动物试验表明,此分离菌对小白鼠有很强的致病性各菌株直接有差异,而且差异显著,表明不同的菌株致病力不同,主要跟猪多杀性巴氏杆菌的血清型有很 大的关系。
3.2 Pm耐药性分析
分离到的猪多杀性巴氏杆菌对先锋Ⅵ,环丙沙星,氯霉素敏感性较强,其耐药率分别为83.3%、75%、75%,而该菌对其他的抗生素耐药性较强,其中四环素对该细菌的耐药率达到了66.7%。由于氯霉素目前为国家禁用的药物,所以建议临床上选择其他两种药物,对其他红霉素等9种药物不敏感。由此可以证明猪多杀性巴氏杆菌极易产生耐药而且以多重耐药为主,这可能与不科学的药物使用有很大的关系,同时现在抗生素品种不断更新,使分离的菌株耐药性不断上升,因此,对动物的治疗应根据致病菌株的特性,药敏试验,科学合理的使用抗生素。
3.3 Pm致病力分析
从病猪分离出其中4株猪多杀性巴氏杆菌XNC01、XNC02、XNC03、XNC04四株菌的致死率分别为25%、100%、100%、75%,从结果可以看出4株之间差异明显,表明各个猪场猪多杀性巴氏杆菌的血清型有一定的差异,也可能与小鼠体质有关,所以对该病的防治应从跟治疗,找到导致本病发生的直接根源,加强环境的消毒,提高猪群的抵抗力,控制好猪瘟、口蹄疫、猪繁殖与呼吸综合征、圆环等病毒性疾病防止本病的继发感染。
[1]魏世安.猪多杀性巴氏杆菌的诊断技术[J].兽医导刊, 2011(51).
[2]徐引第.猪多杀性巴氏杆菌的分离鉴定和药敏试验[J].中国兽药杂志,2011(5): 5-7.
[3]李浩,刘阳.多杀性巴氏杆菌病研究进展[J].畜牧兽医杂志,2011(2): 31-32.
[4]扎西才旦.猪多杀性巴氏杆菌病的诊断与防治[J].中国兽医药杂志,2005(5): 52-53.
[5]桂文龙,胡新岗.苏中地区猪源多杀性巴氏杆菌的分子流行病学调查[J].湖北畜牧兽医,2013(4): 23-24.
[6]朱凤琼,孟志宏.猪多杀性巴氏杆菌病的诊治[J].云南畜牧兽医,2004(2): 43.
[7]谢波.多杀性巴氏杆菌抗原的研究进展[J].韶关学院学报.自然科学,2010(3): 91-93.
