慢性阻塞性肺疾病合并意识障碍患者血清IFN-γ、IL-1β、NO水平变化的临床意义
2014-03-18洪原城黄鑫城范洪涛黄种杰
洪原城,黄鑫城,范洪涛,黄种杰
(中国人民解放军第180医院呼吸内科,福建医科大学第180教学医院,福建 泉州 362000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者由于出现严重的呼吸困难,会引起焦虑、低氧血症和高碳酸血症等,常常会并发意识障碍,其病因较为复杂[1],肺性脑病、低渗性脑病及外源性药物的影响都可以诱发该病[2],其发病与各种细胞因子及炎症介质介导的气道及肺部炎症反应有关。作为炎症因子,干扰素-γ(Interferon-gamma,IFN-γ)主要可以介导细胞免疫,促进T细胞分化,调节细胞免疫;白介素-1β(Interleukin 1β,IL-1β)则是重要的促炎细胞因子,参与机体的炎症、免疫调节过程。一氧化氮(nitric oxide,NO)是神经系统重要的信号分子,具有很强的氧化还原特性,与氧相互作用可以形成活性更强的氧化剂,从而造成细胞的氧化性损伤。本研究通过检测COPD并发意识障碍患者血清IFN-γ、IL-1β、NO水平,探讨细胞因子IFN-γ、IL-1β及NO在COPD合并意识障碍中水平变化的临床意义。
1 资料与方法
1.1 一般资料
选取我院呼吸内科2008年8月至2011年11月收治的COPD合并意识障碍患者60例,COPD及意识障碍诊断标准分别参考《慢性阻塞性肺疾病诊治指南》[3]和《常见症状·诊断学》[4]。60例患者作为治疗组,其中男性14例,女性16例,年龄50~68岁,平均(58.6±3.5)岁。以30例门诊健康体检者作为正常对照,其中男性16例,女性14例,年龄55~70岁,平均(59.3±3.8)岁,各组间性别、年龄差异无统计学意义(P>0.05),具有可比性。两组受试者均签署知情同意书。
1.2 治疗方法
治疗组患者予以抗感染、止咳祛痰平喘、雾化、扩张支气管、短期糖皮质激素及控制性氧疗等综合治疗,同时维持患者水盐电解质平衡。对照组不予任何处理。
1.3 观察指标
1.3.1 血清IFN-γ、IL-1β 的水平 于实验首日清晨空腹抽取各组受试对象静脉血,-20℃保存备用血清,采用ELISA方法检测血清IFN-γ、IL-1β 的水平,试剂盒由美国R&D公司提供,操作方法按照说明书进行。
1.3.2 血清NO水平 取备用血清,以硝酸还原酶法检测NO水平,试剂盒由武汉御和生物有限公司提供,操作方法严格按照说明书进行。结果以光电比色计比色,540 nm波长读取测定管与校准管消光值。计算得标本NO水平(μmol/L)。
1.3.3 动脉血气指标 测定所有研究对象动脉血气指标PaO2、PaCO2、pH值等变化。
1.3.4 格拉斯哥评分 所有受试者进行格拉斯哥评分(Glasgow Coma Scale,GCS),以观察患者神志状况的变化。
1.4 统计学分析
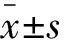
2 结果
2.1 治疗组患者治疗前后临床症状、神志情况比较
经过综合治疗后,治疗组60例患者,58例呼吸逐渐平稳,气促得到明显缓解;共27例神志转清,30例患者意识障碍也得到不同程度的改善;3例无显著改变。
2.2 各组受试者IFN-γ、IL-1β水平,见表1。

表1 各组受试者IFN-γ、IL-1β水平的比较
*P<0.01,与对照组比较;#P<0.01,与治疗前比较。
2.3 各组受试者动脉血气分析,见表2

表2 各组受试者动脉血气的比较
*P<0.01,与对照组比较;#P<0.01,与治疗前比较。
2.4 各组受试者的GCS评分比较,见表3。

表3 各组受试者GCS评分比较
*P<0.01,与对照组比较;#P<0.01,与治疗前比较。
3 讨论
慢性阻塞性肺疾病(COPD)属慢性气道炎症性疾病,气道、肺实质异常炎症反应和肺血管重塑与COPD的发生发展密切相关[5],其炎症发生与体内细胞因子的调控失衡密不可分。气道炎性特征是气道壁大量淋巴细胞浸润,管腔内以嗜中性粒细胞和肺泡巨噬细胞作用为主[6]。IFN-γ是由Th1细胞所分泌的特征性细胞因子[7],可以刺激单核、巨噬细胞分泌细胞因子,激活中性粒细胞,促进它们释放炎症蛋白和炎症介质,参与 COPD的气道炎症[8]。IL-1β能激活巨噬细胞释放炎症介质,在肺内可引起以粒细胞、巨噬细胞浸润为特征的肺部炎症[9],另外还能促进T细胞分泌IFN-γ[10],从而与IFN-γ相互作用调控着COPD的发生发展。
我们的研究显示,治疗组治疗前IFN-γ、IL-1β水平显著低于对照组(P<0.05),说明COPD患者的血清IFN-γ、IL-1β水平呈异常升高,与文献报道一致。Marjanovic等[11]报道,COPD患者经治疗后IL-1β和IFN-γ等因子表达均显著减少。表1也显示,经过治疗后,治疗组患者的血清IFN-γ、IL-1β水平均降低,与治疗前相比有显著差异(P<0.05),虽高于对照组但无显著差异(P>0.05)。实验再次证实了IFN-γ、IL-1β与COPD的发病密切相关。有研究表明,IFN-γ、IL-1β可诱导产生NO,NO与O2结合产生过氧化亚硝基 ONOO—,可使多种酶失活,引发脂质过氧化反应,损伤脑神经元[12]。通过实验,我们发现治疗组患者治疗前NO水平显著高于对照组水平(P<0.05),治疗后其NO水平明显降低接近于正常水平(P>0.05)。由此我们推测,高水平的IFN-γ、IL-1β使NO水平异常升高,对脑神经元产生了氧化损伤,导致了意识障碍的发生。
另外,由于血清IFN-γ、IL-1β水平的异常升高,诱发COPD,导致患者呼吸困难,引起焦虑、低氧血症和高碳酸血症等,低氧血症可直接损伤血管内皮细胞,导致脑间质水肿引起认知功能障碍与意识障碍,高碳酸血症会引起头痛、淡漠、健忘甚至昏迷[13]。从表2可以看出,治疗组治疗前pH值及PaO2均低于对照组,PaCO2显著高于对照组,PaCO2过高,使脑细胞内pH值下降,脑细胞酸中毒达到一定程度就会产生意识改变,导致意识障碍的发生。图1显示治疗组治疗前的GCS评分仅为10.1,显著低于对照组及治疗后组(P<0.05);我们观察,治疗组57例患者的神志都有显著的改善,其GCS评分略低于对照组,但无显著差异(P>0.05)。从这一方面说明血清IFN-γ、IL-1β水平升高可能参了与COPD合并意识障碍的发病。
综上,IFN-γ、IL-1β作为细胞炎症因子可能参与了COPD合并意识障碍的发生发展,降低IFN-γ、IL-1β水平可以下调NO水平,缓解患者的病情,为该病的治疗提供了重要的理论依据。
【参考文献】
[1] 董意波.慢性肺心病合并意识障碍的原因及预防护理对策[J].临床肺科杂志,2007,12(2):208-209.
[2] 李晓丽.慢性阻塞性肺病患者意识障碍的原因分析[J].中国实用医药,2008,3(34):82.
[3] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南[J].中华结核和呼吸杂志,2007,30(1):8-17.
[4] 陈文彬,潘祥林,主编.常见症状·诊断学[M].第7版,北京:人民卫生出版社,2008:67-69.
[5] 王昌明,蒋明,吕倩,等.内皮抑制素对慢性阻塞性肺疾病肺血管重塑的影响[M].中国老年学杂志,2011,31(23):4600-4603.
[6] 杨燕,王建平.老年慢性阻塞性肺疾病气道炎症及其治疗前景[J].中国老年学杂志,2010,30(1):139-141.
[7] 顾薇,张志峰,邓星奇.白细胞介素32和慢性阻塞性肺疾病免疫炎性反应的关系[J].医学综述,2010,3(16):826-828.
[8] 庄晓秋,田莉莉.COPD急性发作期及缓解期患者血清中细胞因子的浓度变化及临床意义[J].中外医疗,2008,33:1-2.
[9] 刘仁杰,万毅新.Th17及IL-17在慢性阻塞性肺疾病中的研究[J].实用医学杂志,2011,27(1):152-153.
[10] Dongli W,Senyan Z,Liang L,et al.Structural insights into the assembly and activation of IL-1β with its receptor[J].Nature Immunology,2010,10(1038):1925-1932.
[11] Marjanovic N,Bosnar M,Michielin F,et al.Macrolide antibiotics broadly and distinctively inhibit cytokine and chemokine production by COPD sputum cells in vitro[J].Pharmacol Res,2011,63(5):389-397.
[12] 黄其龙,林斌.纤维蛋白原对神经系统作用研究进展[J].中华神经外科疾病研究杂志,2012,11(1):88-90.
[13] 陈宝华,左志通,史建平,等.呼吸兴奋剂联合无创正压通气治疗慢性阻塞性肺疾病并肺性脑病[J].实用医学杂志,2010,26(2):289-290.
