黑曲霉嗜热β-甘露聚糖酶在毕赤酵母中的克隆表达及其魔芋降解产物分析
2014-03-17倪玉佳周旻昱欧阳嘉3郑兆娟勇强
倪玉佳周旻昱欧阳嘉,3郑兆娟勇强
(1.南京林业大学化学工程学院,南京 210037;2.南京林业大学森林资源与环境学院,南京 210037;3.江苏省生物质绿色燃料与化学品重点实验室,南京 210037)
黑曲霉嗜热β-甘露聚糖酶在毕赤酵母中的克隆表达及其魔芋降解产物分析
倪玉佳1周旻昱2欧阳嘉1,3郑兆娟1勇强1
(1.南京林业大学化学工程学院,南京 210037;2.南京林业大学森林资源与环境学院,南京 210037;3.江苏省生物质绿色燃料与化学品重点实验室,南京 210037)
根据毕赤酵母密码子偏好性优化设计合成一段来自黑曲霉BK01的嗜热β-甘露聚糖酶基因,通过构建表达载体pPICZαA-man线性化后电转化入不同的毕赤酵母宿主,获得最佳重组菌KM71-MAN,其发酵罐发酵酶活最高达2 318.85 IU/mL。表达产物纯化后的分子量约为40 kD,最适反应温度为80℃,最适pH为5.0。该酶在70℃(pH5.0)保温44 h仍能保留43%的酶活力且在pH3.0-7.0范围内保温70 h(50℃)酶活力仍能保留85%以上。利用发酵罐所产重组酶酶解魔芋胶制备甘露低聚糖,产物以甘露二糖和甘露六糖为主,甘露低聚糖得率为55.6%。该重组β-甘露聚糖酶具有良好的热稳定性和pH稳定性,在魔芋制备甘露低聚糖中具有较好的应用潜能。
β-甘露聚糖酶 密码子偏好性 毕赤酵母 酶学性质 低聚甘露糖
β-甘露聚糖酶是一类半纤维素水解酶,能够水解含有甘露糖苷键的甘露聚糖(包括异甘露聚糖)[1],广泛存在于动植物和微生物中,在造纸、纺织印染、洗涤、食品、饲料、医药和石油开采等工业中有着广阔的应用前景[2]。该酶水解获得的产物甘露低聚糖具有促进人和动物肠道内以双歧杆菌为代表的有
益菌的增殖、改善肠道内菌群结构等功能性低聚糖共同的理化特性[3],同时也有清除自由基、增强机体抗氧化性的能力[4],若将甘露低聚糖作为功能性食品添加剂应用于工业开发,应用前景十分广阔。
我国魔芋资源丰富,主要分布在我国西南部山区,目前主要作为一种粗纤维粮食或食品添加剂使用,附加值比较低[5],魔芋胶酶法降解为高附加值的甘露低聚糖可获得较大的经济效益,对于魔芋资源下游产业的拓宽和提高魔芋附加价值具有重要意义。基于此,本研究旨在开发制备可应用于低聚甘露聚糖生产的嗜热性甘露聚糖酶,优化设计合成黑曲霉嗜热β-甘露聚糖酶基因,并在毕赤酵母中实现高效表达,研究分析重组酶的酶学性质,为甘露聚糖酶在酶法制备甘露低聚糖奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 含有man基因片段的重组质粒载体pGH购自上海捷瑞生物工程有限公司;大肠杆菌感受态细胞DH5α购自南京天为生物科技有限公司;毕赤酵母表达载体pPICZαA购自Invitrogen公司;毕赤酵母GS115、KM71H、SMD1168、X-33为本实验室保存。
1.1.2 工具酶和生化试剂 质粒提取试剂盒购自上海捷瑞生物工程有限公司;限制性内切酶EcoRⅠ和XbaⅠ、T4连接酶、DNA 相对分子质量标准、凝胶回收试盒购自宝生物工程有限公司(大连);线性化酶SacⅠ购自Fermentas公司;博来霉素购自Invitrogen公司;洋槐豆胶、牛血清蛋白、考马斯亮蓝R-250 购自Sigma公司;Yeast extract、Peptone、Tryptone购自Oxoid公司。魔芋购自云南市场。其他生化试剂为国产分析纯。
1.1.3 培养基 LB、LLB培养基用于大肠杆菌的培养,YPD、YDPS、BMGY和BMMY用于毕赤酵母增殖培养、筛选和表达,发酵基础培养基BMS用于高密度发酵,具体配方见 Invitrogen公司的毕赤酵母操作手册。
1.2 方法
1.2.1 重组毕赤酵母表达载体的构建 将含有目的基因的pGH-man质粒模板经EcoR I和XbaI双酶切后获得目的基因片段man,继而构建到带有高效甲醇诱导启动子AOX 的毕赤酵母表达载体pPICZαA上,命名为pPICZαA-man。
1.2.2 毕赤酵母的转化 重组质粒pPICZαA-man经SacI线性化后,分别电转化入GS115、KM71H、SMD1168、X-33酵母感受态细胞。电转化参数为:1 500 V,25 μF,200 Ω。电转化后取 200 μL涂布于含有100 μg/mL博来霉素的YPDS平板上,30℃条件下培养直至转化子出现。同时取200 μL的感受态细胞作为参照。
1.2.3 重组毕赤酵母工程菌株的诱导表达 将阳性转化子接种于含 25 mL BMGY 培养基中的 250 mL的摇瓶中,30℃下 220 r/min摇床培养至OD600=2-6。室温离心收集菌体,轻轻倒出上清液,用BMMY液体培养基将细胞重悬至OD600为1.0以诱导表达(加入约100-200 mL液体培养基)。28℃,220 r/min继续培养,每 24 h补加适量100%甲醇至终浓度为 1%。每 12 h取样,离心收集上清液,即为粗酶液。
1.2.4 重组毕赤酵母高密度发酵 整个发酵过程分为初始甘油生长阶段,甘油流加阶段及甲醇诱导培养3个阶段。种子液于30℃下 220 r/min摇床培养至OD600=2-6,以体积分数10%的接种量接种于甘油含量为40 g/L的BMS(4.35 mL PTM1 /L)培养基的3 L发酵罐中,初始装液量1.5 L。全程采用NBS Bioflo110 3 L发酵罐自动调控温度为30℃、pH为5.0(28%的氨水调控)下培养。重组酵母在发酵罐培养24 h左右后,当甘油耗尽(表现为溶氧 DO 突然反弹),湿重在90-150 g/L后,继而以18.15 mL(h·L)的速度流加甘油4 h。停止流加甘油至DO再次反弹后饥饿培养1 h,当细胞湿量达到180-220 g/L后,开始流加甲醇诱导培养基。
1.2.5 重组β-甘露聚糖酶的纯化 将发酵罐所产β-甘露聚糖酶粗酶液采用快速蛋白液相层析系统(ÄKTA Explorer,GE 公司)进行凝胶过滤纯化。层析柱:柱长30 cm,直径1 cm;层析介质:Superdex 75 PrepGrade 凝胶过滤填料,购于GE 公司;流动压力:0.3 MPa;流速:0.3 mL/min;流动相:100 mmol/L pH 5.0的柠檬酸-磷酸氢二钠缓冲液;上样量为0.5 mL,系统采用Unicorn 5.0 控制软件。
1.2.6 重组毕赤酵母表达产物酶活测定 采用 DNS
定糖法测定甘露聚糖酶的活性[6]。将0.9 mL 5.0 g/L洋槐豆胶底物溶液(pH5.0 柠檬酸-磷酸氢二钠缓冲液),加入0.1 mL经适当稀释的酶液80℃反应10 min。立即在试管中加入3.0 mL DNS试剂,煮沸7 min,冷却后定容至25 mL,摇匀。在540 nm处以蒸馏水空白测定样液吸光度。甘露聚糖酶活力单位定义为每分钟水解底物产生1 μmol的甘露糖所需的酶量定义为一个活力单位(1 IU)。
1.2.7 重组毕赤酵母表达产物蛋白浓度测定及SDSPAGE 利用Bradford 法测定蛋白含量,以牛血清蛋白作为标准蛋白绘制标准曲线;分别取不含重组质粒和含重组质粒的酵母发酵上清液10 μL,进行10%的SDS-PAGE电泳,分析重组蛋白的表达情况。
1.2.8 重组β-甘露聚糖酶酶解魔芋制备甘露低聚糖 以50 g/L魔芋精粉(葡甘聚糖含量为:74%)为底物(pH5.0 柠檬酸-磷酸氢二钠缓冲液),30 mL体系中包括50 U/g粗酶液,80℃下于恒温水浴锅振荡酶解2 h。反应结束后100℃下10 min灭酶活。混合液12 000 r/min离心10 min,收集上清,利用离子色谱对产物组分进行分析。仪器:DIONEX ICS 3000;分析柱:CarboPacTMPA 200;流速:0.25 mL/min;柱温:30℃;流动相:100 mmol/L NaOH;检测器:标准四电化学检测器;进样量:10 μL;时间:40 min。
低聚糖得率(%)=C2、C3、C4、C5、C6/C×74%× 100%
其中,C2、C3、C4、C5:酶解液中甘露二、三、四、五、六糖的浓度(g/L);C:魔芋精粉浓度(g/L);74%:葡甘聚糖含量。
2 结果
2.1 毕赤酵母重组表达载体的构建
按照毕赤酵母密码子偏好性优化合成设计一段来自黑曲霉BK01 β-甘露聚糖酶的基因(FJ268574),优化密码子修改率达37.5%。优化后的基因长为1 035 bp,编码345个氨基酸。将此含有目的基因的pGH-man质粒模板经EcoR I和XbaI酶切后获得目的基因片段man,与pPICZαA 载体经限制性内切酶切得到的约 3.5 kb载体片段连接,得到重组表达载体pPICZαA-man。其中目的基因大小为1 035 bp,EcoR I和XbaI双酶切片段长度为1 035 bp,双酶切后条带在图1中1 000 bp左右相符。重组质粒大小约为4.5 kb,经过SacI线性化后,电泳结果与理论值相符。

图1 重组质粒pPICZαA-man的酶切验证
2.2 重组β-甘露聚糖酶的诱导表达及其纯化
2.2.1 毕赤酵母宿主优化 将得到的线性化pPICZαA-man质粒导入不同的巴斯德毕赤酵母宿主(GS115、KM71H、SMD1168、X-33),在Zeocin 100 μg/mL的YPDS平板上得到转化子。经过摇瓶筛选,如图2所示,宿主为GS115和SMD1168时,菌株发酵活力偏低;而KM71H和X-33作为宿主发酵能力较佳,甲醇缓慢利用型的KM71H宿主更为突出。本试验得到的重组酵母KM71-MAN在摇瓶中甲醇诱导96 h后菌株发酵活力达到251.45 IU/mL,因此最佳宿主为KM71H。

图2 不同毕赤酵母宿主对重组β-甘露聚糖酶生产的影响
2.2.2 重组毕赤酵母KM71-MAN高密度发酵 将筛选到最佳重组酵母菌KM71-MAN在3 L发酵罐中放大培养,培养条件为装液量1.5 L、接种量10%、
30℃、pH5.0。如图3所示,随着时间的推移,菌株所产酶量稳步增加,两者近似呈现出线性关系。甲醇诱导96 h后菌株发酵活力达到2 318.85 IU/mL,蛋白浓度达2.82 g/L,在国内处于较高的水平。

图3 重组β-甘露聚糖酶3L发酵罐发酵产酶历程
2.2.3 重组β-甘露聚糖酶的纯化 用发酵所得粗酶液经一步Superdex 75 PrepGrade凝胶过滤,得到电泳纯β-甘露聚糖酶(图4)。纯化后酶活力回收率为93.3%,酶比活由822.29 IU/mg 提高到了1 167.65 IU/mg,纯化倍数为1.42。而本试验电泳分析结果表明,表达的产物分子量约为40 kD,与理论值相符。

图4 重组蛋白的SDS-PAGE电泳图
2.3 重组β-甘露聚糖酶的酶学性质
进一步考察pH对酶活力的影响,结果如图5-A所示,重组甘露聚糖酶最适pH值为5.0,当pH处于4-6之间时,该酶均有大于95%的相对酶活。pH稳定性结果如图5-B,pH 在3-7之间时,酶液在50℃下是非常稳定的,在70 h内酶活力能保存在85%以上,说明该酶在较宽的pH范围内具有较好的pH稳定性,而且酸耐受性非常好。
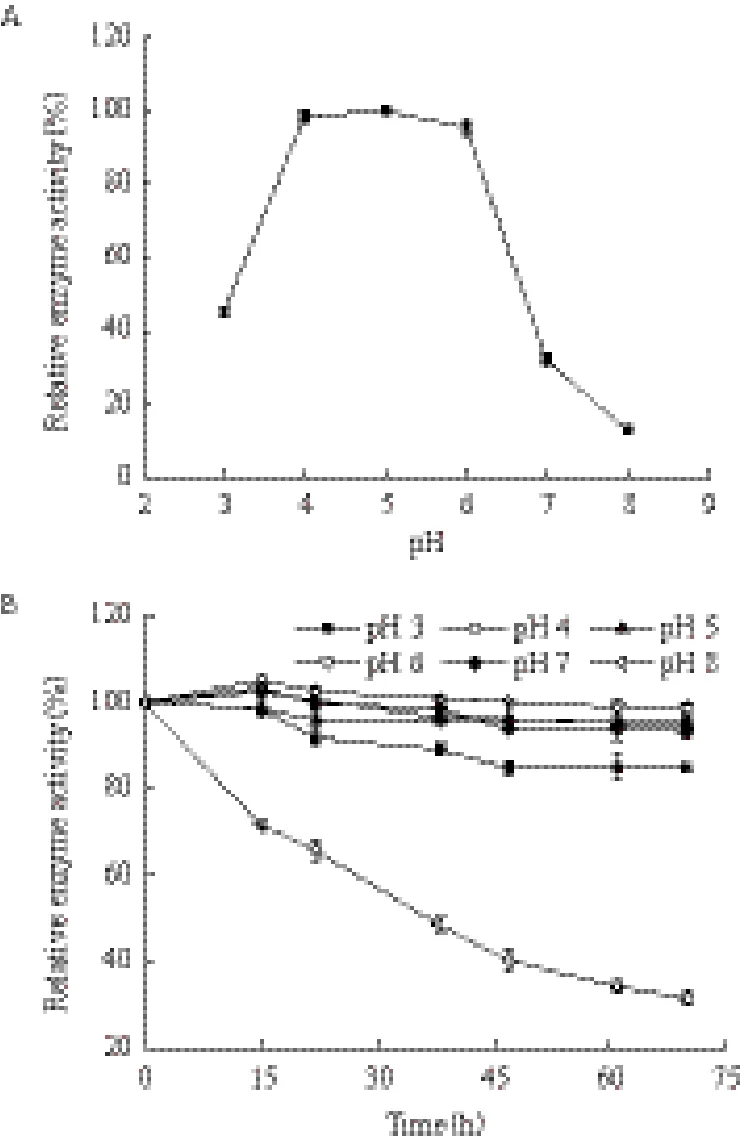
图5 重组β-甘露聚糖酶的最适pH(80℃)(A)和pH稳定性(50℃)(B)
温度对酶活力的影响结果如图6-A所示,酶的最适反应温度为80℃,70℃时的酶活力还保持在87.27%的相对酶活,90℃时仍然具有高达76.78%的相对酶活,甚至在100℃下仍然没有失去活力,可见该酶是一种耐高温的酶。温度稳定性结果如图6-B,在温度为50℃时稳定性最佳,70 h内保持了95%以上的相对稳定性,且60℃时70 h内仍然保持89%以上的酶活力,在70℃下44 h时也保持43%相对活力,说明该酶具有较高的温度稳定性,而且耐受性非常好。
2.4 重组β-甘露聚糖酶的降解产物分析
本试验以50 g/L的魔芋精粉为底物,在pH 5.0下80℃酶解2 h,其甘露低聚糖得率为55.6%。魔芋精粉降解后产物成分含量如图7所示,其中以甘露二糖最多含量为45.5%;甘露六糖次之,达到了34.3%;而甘露一糖、三糖、四糖含量分别为7.5%,8.8%,3.4%;甘露五糖极少。本试验获得了大量的甘露低聚糖,而单糖很少,在后续制备低聚糖成品中极具优势。

图6 重组β-甘露聚糖酶的最适温度(pH5.0)(A)和温度稳定性(pH5.0)(B)

图7 甘露聚糖酶酶解魔芋降解产物的离子色谱图
3 讨论
随着功能性食品在实际生产生活中越来越受欢迎,低聚糖的生产应用研究也随之持续升温。近年来关于利用β-甘露聚糖酶酶法制备甘露低聚糖的研究较多,到目前为止已经有多种不同生物来源的β-甘露聚糖酶基因得到克隆和表达。
毕赤酵母是目前应用最为广泛和成功的外源蛋白表达系统,有研究发现,不同基因型的毕赤酵母作为宿主有时会显著影响基因的表达量[7,8]。本试验在不同的巴斯德毕赤酵母宿主(GS115、KM71H、SMD1168、X-33)中成功获得β-甘露聚糖酶的分泌表达,同时也确定了KM71H为最佳宿主。在某些情况下,菌株缓慢生长更有利于蛋白质的折叠[9],如Cos等[10]利用甲醇缓慢利用型和快速利用型分别表达米根霉脂肪酶,发现在外源表达时缓慢利用型拥有更高的效率,其发酵酶比活是快速利用型的1.4倍。
高密度发酵能够在线调控某些参数,使得菌体在最佳条件下生长,获得高的表达量,如来源于里氏木霉RUT-C30的内切β-甘露聚糖酶在5 L发酵罐中诱导120 h酶活力达470 IU/mL,蛋白浓度达1.5 g/L[11]。本试验通过3 L发酵罐放大培养筛选得到的最佳重组菌KM71-MAN,甲醇诱导96 h后菌株发酵活力达到2 318.85 IU/mL,蛋白浓度达2.82 g/L,在国内处于较高的水平。毕赤酵母含有许多翻译后修饰功能,如蛋白质折叠,糖基化等,但不同的毕赤酵母在分泌重组蛋白时糖基化程度不均一,本试验在毕赤酵母KM71H中分泌的重组β-甘露聚糖酶电泳图表明为非糖基化的形式存在于发酵液中。
尽管一些耐热的甘露聚糖酶已被研究,如来源于黑曲霉WM20-11的β-甘露聚糖酶,其最适温度为70℃,但在70℃下保温1 h后相对酶活就降至50%左右[12];来源于枯草芽孢杆菌SA-22的β-甘露聚糖酶70℃的酶活半衰期仅为3 h[13]。本试验构建所获的重组β-甘露聚糖酶,最适反应温度为80℃,最适pH5.0,且该酶在70℃(pH5.0)保温44 h仍能保留43%的酶活力,在pH 3.0-7.0范围内保温70 h(50℃)酶活力仍能保留85%以上,展现了良好的热稳定性和pH稳定性,具有较好的未来发展前景。
不同来源的β-甘露聚糖酶作用于不同的底物,其降解产物分布不同。乔宇等[14]以洋槐豆胶为底物进行酶水解,其主要产物为甘露一糖和甘露二糖。本试验以魔芋为底物,产物以甘露二糖和甘露六糖为主,酶解魔芋胶制备甘露低聚糖得率为55.6%,非常适合于魔芋甘露低聚糖的制备工艺,未来发展前景不容小觑。
4 结论
首次将黑曲霉第5家族β-甘露聚糖酶基因
(FJ268574)进行密码子优化后成功在毕赤酵母中表达。筛选获得的重组菌KM71-MAN在摇瓶和3 L发酵罐中诱导96 h后发酵活力分别为251.45 IU/mL和2 318.85 IU/mL,在国内处于较高水平。酶学性质研究发现,该酶蛋白分子量大小与理论值相符,未发生糖基化现象,反应最适温度为80℃,最适pH为5.0,具有优良的耐热性和宽的pH稳定性,酶解产物以甘露二糖和甘露六糖为主,酶解魔芋胶制备甘露低聚糖得率为55.6%,非常适合于魔芋甘露低聚糖的制备工艺,具有极大的发展前景。
[1] Dhawan S, Kaur J. Microbial mannanases:An overview of production and applications[J]. Critical Reviews in Biotechnology, 2008, 27(4):197-216.
[2] 张婕, 赵敏.β-甘露聚糖酶的研究进展[J]. 黑龙江医药, 2011, 24(2):248-250.
[3] 王爱华, 陶宁. 浅谈甘露低聚糖的保健功能及应用[J]. 安徽农业科学, 2006, 34(13):3249-3250.
[4] 杨艳燕, 李小明, 李顺意, 等. 魔芋低聚糖对小鼠血糖含量和抗氧化能力的影响[J]. 中草药, 2001, 32(2):142-144.
[5] 徐春梅, 邬敏辰, 李剑芳, 等. 魔芋葡甘露聚糖的酶水解工艺条件[J]. 食品与生物技术学, 2008, 27(3):121-124.
[6] Ghose TK. Measurement of cellulase activities[J]. Pure and Appl Chem, 1987, 59(2):257-268.
[7] 赵翔, 霍克克, 李育阳.毕赤酵母的密码子用法分析[J]. 生物工程学报, 2000, 16(3):308-311.
[8] 王玮, 文湘华. 木质素过氧化物酶LiPH2合成基因在毕赤酵母中的表达[J]. 环境科学学报, 2009, 29(9):1793-1799.
[9] 章如安, 杨晟, 邱荣德, 等. 巴斯德毕赤酵母表达体系研究及进展[J]. 微生物学通报, 2000, 27(5):371-373.
[10] Cos O, Serrano A, Montesinos JL, et al. Combined effect of the methanol utilization(Mut)phenotype and gene dosage on recombinant protein production inPichia pastorisfed-batch cultures[J]. Journal of Biotechnology, 2005, 116(4):321-335.
[11] 陈小兵, 乔宇, 丁宏标, 等. 里氏木霉RUT-C30内切β-甘露聚糖酶基因在毕赤酵母中的分泌表达[J]. 农业生物技术学报, 2007, 15(1):142-146.
[12] 朱劼, 邬敏辰. 黑曲霉酸性β-甘露聚糖酶的酶学特性[J].食品与生物技术学报, 2007, 27(3):21-25.
[13] Yu HY, Sun YM, Wang WJ, et al. Purification and properties ofBacillus subtilisSA-22 Endo-1, 4-β-D-mannanase[J]. Chinese Journal of Biotechnology, 2003, 19(3):327-331.
[14] Qiao Y, Chen XB, Ding HB, et al. Heterologous expression and characterization ofmangene fromBacillus subtilisinPichia pastoris[J]. Frontiers of Biology in China, 2008, 3(1):26-31.
(责任编辑 李楠)
Cloning,Expression of Thermostable β-mannanase and the Preparation of Mannooligosaccharide
Ni Yujia1Zhou Minyu2Ouyang Jia1,3Zheng Zhaojuan1Yong Qiang1
(1. College of Chemical Engineering,Nanjing Forestry University,Nanjing 210037;2. College of Forest Resource & Environment,Nanjing Forestry University,Nanjing 210037;3. Jiangsu Key Lab of Biomass-based Green Fuels and Chemicals,Nanjing 210037)
According to the Pichia pastoris’s codon preference, a DNA sequence encoding Aspergillus niger BK01 thermophilic β-mannanase gene was designed and synthesized. Firstly, it was inserted into pPICZαA and resulted in recombinant expression vector pPICZαA-man. Then, pPICZαA-man was linearized and transformed into different hosts by electrotransformation. An optimal recombinant stain KM71-MAN was obtained by screening activity. Using recombinant strain KM71-MAN, recombinant mannanase was overexpressed and its activity in the culture medium reached 2 318.85 IU/mL in a 3 L fermentor. Recombinant enzyme had an apparent molecular size of about 40 kD by SDSPAGE, and optimal activity at pH 5.0 and 80℃. It was highly thermostable, retaining 43% of enzyme activity after 44 h of exposure at 70℃and pH 5.0. Moreover, it remained over 85% activity from pH 3.0 to pH 7.0 after treating at 50℃ for 70 h. Using this crude enzyme, the main hydrolysis products yielded from konjak gum were mannobiose and mannohexaose and the yield of mannooligosaccharides was 55.6%. The recombinant enzyme exhibited good thermal and pH stability, which indicated that the recombinant yeast has potential value in preparation of konjac gum mannooligosaccharides.
β-mannanase Codon preference Pichia pastoris Enzymatic properties Mannooligosaccharide
2013-11-20
国家林业公益性行业科研专项(201404615),教育部新世纪优秀人才支持计划(NCET-11-0988),江苏省杰出青年基金(BK2012038),江苏省高校优势学科建设工程资助项目(PAPD)
倪玉佳,女,硕士研究生,研究方向:生物化工;E-mail:523869088@qq.com
欧阳嘉,女,教授,研究方向:植物纤维资源利用,基因工程和酶工程;E-mail:hgouyj@njfu.edu.cn
