拟南芥NDR1基因介导的广谱抗病性研究进展
2014-03-17龚前园张超李为民张永强
龚前园 张超 李为民 张永强
(中国农业科学院生物技术研究所,北京 100081)
拟南芥NDR1基因介导的广谱抗病性研究进展
龚前园 张超 李为民 张永强
(中国农业科学院生物技术研究所,北京 100081)
抗病基因的研究是抗病育种及防治植物病害的基础。拟南芥NDR1(Non-race-specific disease resistance 1)基因,编码一个质膜定位蛋白,在R基因介导的抗性中具有重要作用。NDR1能与CC-NB-LRR(卷曲螺旋核酸结合或富亮氨酸重复)类抗病蛋白相互作用。以拟南芥抗病基因NDR1及其蛋白结构的研究进展为基础,综述了NDR1的广谱抗病性和抗病分子机理。
抗病基因 NDR1 CC-NB/LRR
植物在生长发育过程中会经常受到细菌、真菌和病毒等病原体的侵袭,其结果表现为抗病或感病。在与病原体长期的相互作用与进化过程中,植物逐渐形成了复杂的防御机制。一般认为,植物通过抗性(R)基因与病原体无毒基因(Avr基因)的互作,激活植物的防御反应[1,2]。大多数植物的R蛋白具有核苷酸结合位点(Nucleotide-binding site,NBS)和富亮氨酸重复序列(Leucine-rich repeat,LRR)的结构特点。NBS具有ATP或GTP结合活性,LRR结构域调节蛋白质-蛋白质相互作用,起着确定基因对基因间互作的直接特异性[3]。NBS-LRR类R基因,根据其N端的结构域特点,可进一步分为卷曲螺旋结构域(CC)NBS-LRR类与果蝇Toll蛋白和哺乳动物白细胞介素I受体同源域(TIR)NBS-LRR类[4]。
虽然R蛋白在感知病原体后的激活抗性过程中发挥着核心作用,但单靠 R蛋白启动抗性是不够的。因此,作为抗性共激活因子的众多辅助蛋白和伴侣蛋白也已被确定。例如,Enhanced disease susceptibility 1(EDS1)通过激活R蛋白的TIR结构域调控防御信号,而Non-race-specific disease resistance 1(NDR1)是含有CC结构域的R蛋白激活所必需的[5-9]。但也有例外,几个CC-NB-LRR 类R蛋白对卵菌纲病原菌Hyaloperonospora arabidopsidis的特异抗性独立于NDR1之外起作用[10,11]。因此,虽然EDS1和NDR1依靠R蛋白的结构特异性、功能和激活信号似乎是保守的,但这些途径相关的完整机制仍不清楚。
激活R蛋白介导的抗性所需的两个主要信号元件中,EDS1研究的比较清楚。EDS1作为涉及生物和氧化应激信号的核心调控蛋白[12]。细菌感染植
物后,EDS1通过与植保素缺陷蛋白4(Phytoalexindeficient 4)和衰老相关基因101(Senescence-associated gene101)的互作,诱发超敏反应(HR)[13,14]。EDS1也被证明在阻止非致病真菌侵入增长以及运作氧化应激信号中起作用[12]。相反,NDR1在CC-NBLRR类的信号转导通路中的功能尚不清楚。故笔者着重对近年来对NDR1基因的研究进展进行综述。
1 NDR1基因的结构
Century等[6]在研究拟南芥与丁香假单胞菌(Pst)之间的互作时,发现了一个可能涉及拟南芥抗病途径的基因,由于其具有非小种专化抗病性,故命名为NDR1。NDR1基因位于拟南芥第3条染色体上,限制性片段长度多态性(RFLP)标记出其位于g6220与g4711之间的8.5厘摩(cM)[6]。NDR1蛋白是一个质膜蛋白,它经历了几个翻译后修饰,包括羧基末端处理和氨基端糖基化[7,8]。基因组DNA序列分析显示,NDR1含有一个单一的660个碱基对的开放阅读框(ORF)[7]。
2 NDR1蛋白的结构
Coppinger等[8]通过序列分析预测NDR1是一个C末端糖基肌醇(GPI)锚定蛋白,并通过选择离子监测质谱法(SIM-MS)得到验证。NDR1蛋白的结构如图1所示,其中ω位点、断裂位点和疏水尾巴为GPI锚定蛋白的基本特点。Knepper等[16]通过与整合素蛋白LEA14进行同源建模,预测了NDR1蛋白的高级结构(图2)。对预测结果进行进一步分析发现该蛋白与涉及信号感知和先天免疫反应的哺乳动物整合素蛋白具有几个惊人的相似之处。例如,大量的β折叠的圆环(图2-A 蓝色箭头)类似于Ⅲ型纤连蛋白的核心结构。进一步的模拟表明NDR1的主要核心结构与膜结合亚单位(即纤连蛋白域)FNIII具有很强的相似性,NDR1和整合的假定跨膜结构域都连接到一个大的单一β片上[17]。根据相邻的3个氨基酸的α-螺旋结构(图2-B),他们确定了在溶剂中暴露的氨基酸178-180位置存在的一个类似整合素蛋白Arg-Gly-Asp(RGD)的NGD结构域(Asn-Gly-Asp)。在宿主-真菌互作中,防御信号中的NGD域是一个潜在的配体结合位点,该位点涉及胞壁质膜黏附[18,19]。此外,据推测NGD位点也是病原菌效应蛋白和分泌系统的靶标,大概是为了通过破坏细胞壁质膜黏着斑而方便病原体进入[20]。
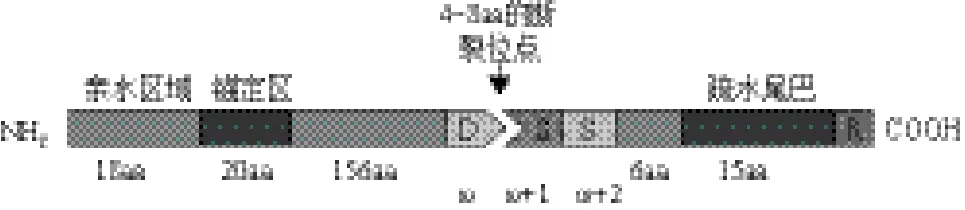
图1 NDR1的结构[8]

图2 NDR1蛋白的高级结构[16]
3 NDR1在抗病信号转导中的作用方式
通过突变体删除试验表明,NDR1是一个重要的诱导防御反应的抗性基因,并具有非小种专化抗病性[6]。在过去的10多年中,通过阐明NDR1参与的遗传相互作用,发现NDR1参与了植物防御信号,并作为防御信号激活所需的核心元件,激活CC-NB-LRR 类R蛋白[9]。拟南芥突变体ndr1-1植株中,由细菌引起的水杨酸(Salicylic acid,SA)或通过UV-C光或缺氧产生的活性氧(Reactive oxygen species,ROS)都被减弱了,并且在由细菌或ROS诱导的SAR也受损,但BTH诱导的SAR不受影响。从而表明,NDR1在ROS的下游和SA的上游发挥功能[21]。 结合以上分析,Shapiro等[21]总结了抗病信号转导模型,明确了NDR1在抗病信号转导中的作用位置,如图3所示。
4 NDR1基因的抗病性
4.1 拟南芥NDR1的抗病性
通过突变体ndr1-1的感病性检测,NDR1对携带无毒基因avrB、avrRpm1、avrRpt2和avrPph3中任何一个的丁香假单胞菌具有抗性[6]。同时,NDR1
的突变严重削弱了拟南芥在响应携带无毒基因avrRpt2的丁香假单胞菌时HR和SAR的诱导能力,也降低了突变体植株PR1基因的表达水平[21]。
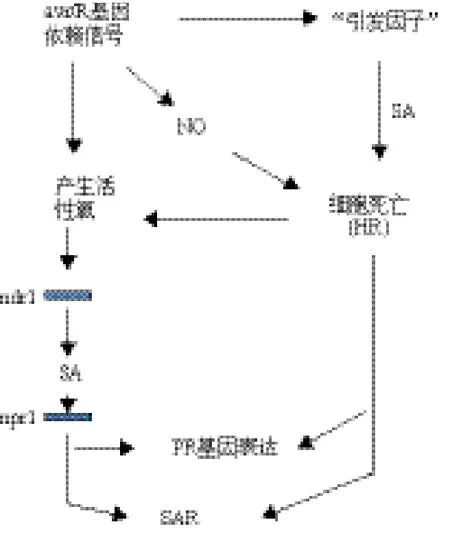
图3 抗病信号转导模型[21]
Coppinger等[8]研究转基因拟南芥的ndr1-1补充突变体发现,该基因开放读码框上游的一个1.3 kb区域,足以驱动NDR1基因的表达。在这个1.3 kb‘NDR1本地启动子’的启动下,能稳定地在转基因拟南芥ndr1-1突变体中表达NDR1,从而实现在拟南芥中过量表达NDR1。其结果是,可以增强拟南芥对一些细菌的抗病能力,如番茄丁香假单胞菌,但对非细菌性病原菌的抗性增强不明显,如芜菁皱缩病毒和白粉病。通过抗病基因工程研究NDR1的功能也有报道。窦道龙等[22]利用农杆菌介导法,将从拟南芥Wassilewskija生态型中克隆到的NDR1基因转到烟草中发现,部分转基因苗(约30%)对赤星病和晚疫病的抗性明显增强。人们在拟南芥中发现了45个与NDR1和HIN1(烟草中与NDR1序列相似的抗病基因)相关的基因,它们属于NHL(似NDR1/HIN1)大家族[23,24]。这些基因不同程度地参与了植物防御途径,如NHL10在黄瓜花叶病毒引起的过敏反应中被诱导表达[24]。
因此,NDR1基因确实参与了植物的抗病反应,而且与NDR1序列相似的基因也可能具有抗病性,这为广泛克隆并研究植物抗病基因奠定了基础。
4.2 其他植物NDR1基因的抗病性
近年来,人们对其他植物中的NDR1同源基因的抗病性也做了一定的研究。例如,Cacas等[25]从咖啡中克隆到了与拟南芥NDR1功能上同源的基因CaNDR1a,它能恢复ndr1-1对丁香假单胞菌的抗性。同时,他们还通过瞬时表达系统,确定CaNDR1a蛋白和拟南芥NDR1蛋白一样也通过C末端处理定位于质膜上,且与类似RIN4的蛋白互作,从而证明了NDR1蛋白在咖啡和拟南芥之间的功能上和生化特性上的保守性。Lu等[26]克隆了柑橘中的NDR1同源基因,即CsNDR1,并证实过表达CsNDR1能弥补拟南芥突变体ndr1-1对丁香假单胞菌的抗性,也能增强对卵菌纲病原体Hyaloperonospora arabidopsidis的抗性。这种过表达与SA产物的增加和防御标记蛋白PATHOGENESIS RELATED 1(PR1)的表达正相关,这说明CsNDR1的过表达可激活SA介导的防御信号,从而导致广谱抗病性的产生。此外,他们还发现,在感染与柑橘火龙病相关的细菌病原体CandidatusLiberibacter的柑橘中,能诱导温和的PR1的表达和SA的积累,从而进一步证实CsNDR1是拟南芥NDR1的一个功能性同源基因。
总之,NDR1基因介导了植物的广谱抗病性,并且它在一些植物的防御途径之间是保守的。因此我们可以通过克隆一些抗病植物的NDR1同源基因,通过基因工程的方法将NDR1基因转化到其他经济植物中,以提高目标植物的抗病性。
4.3 NDR1的抗病分子机理
人们广泛认为,R蛋白介导的植物对细菌抗性的分子遗传基础,涉及直接或间接的识别来源于病原体的毒力效应器,从而诱发植物的抗病性[27,28]。细菌III型效应蛋白通过III型分泌系统进入植物细胞质,识别寄主植物并激活防御信号形成抗性。当效应蛋白被寄主植物识别时,就会产生基因对基因的抗性,从而启动抗病反应。
Coppinger等[8]通过抗原标记NDR1转化到拟南芥ndr1-1中,再利用免疫印迹证实NDR1通过C末端糖基肌醇(GPI)锚定到质膜上,GPI可能在膜的外表面修饰NDR1,从而使NDR1与外源病原体信号直接或间接相互作用。Knepper等[16]通过同源建模,预测NDR1与拟南芥胚胎发育晚期富集蛋白14(与非生物胁迫响应有关的蛋白)的结构高度相似。
特定的蛋白质超二级结构也表明NDR1与哺乳动物整合素具有惊人的相似性,整合素能调节细胞外基质和胁迫信号之间的相互作用。ndr1-1突变体植物感染病原体后,与野生型Col-0相比,表现出较高的电解液泄漏。 此外,还观察到质壁分离的表型改变,这表明NDR1能通过调节在环境压力下发生的细胞液损失,从而保持细胞壁质膜的粘连。
NDR1是一个质膜定位、GPI锚定的蛋白质,能够形成同型二聚体。 NDR1包含一个位于该蛋白质外体的NGD结构域(Asn-Gly-Asp),该结构域能通过直接或间接的相互作用将细胞壁和质膜连接在一起(图4中小标1,2)。通过鉴定NDR1与RIN4的相互作用,人们进一步认识了NDR1在效应器触发免疫(Effector-triggered immunity,ETI)中的作用:NDR1通过与RIN4的互作及随后R蛋白的负调节作用,至少部分地,正向调节了抗性反应[29]。目前尚不清楚介导NDR1与ETI联系的其他细胞元件。RIN4能与R蛋白RPS2互作,并通过RIN4的分开来识别丁香假单胞菌DC3000的效应蛋白AvrRpt2,随后被RPS2识别并激活ETI。最近发现,NDR1能激活丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)途径和PTI。NDR1与PTI上游的具体互作元件仍未确定(图4中小标3)。

图4 NDR1在细胞生理和病原体防御信号中扮演的角色[30]
5 展望
NDR1通过C末端锚定到质膜上,在细胞质内通过与抗病蛋白RPS2及负调节蛋白RIN4的相互作用参与抗病信号转导,从而使抗病信号从细胞外空间转导到细胞内[29]。同时,HR过程中产生的ROS也作用于NDR1[21]。抗病信号进一步传递,产生SA,促进病程相关基因的表达。NDR1基因介导了植物的广谱抗病性,并且它在防御途径中的功能在很多植物之间是保守的。因此可以通过对保守序列的分析,克隆一些抗病植物的NDR1同源基因或与NDR1序列相似的基因,然后通过基因工程的方法将这些基因转移到其他植物中,并实现稳定表达,从而提高目标植物对各种病原菌的广谱抗性。
目前虽然已经确定NDR1参与抗病信号转导,并对拟南芥NDR1的抗病性做了一定的研究。但对NDR1在信号转导通路中的功能及其抗病分子机理的研究不多,而且大多处于推论阶段,需要进一步的试验技术来证明。鉴于NDR1基因的广谱抗病性,其在作物广谱抗病基因工程中具有较大的应用前景。
[1] Flor HH. Current status of the gene-for-gene concept[J]. Annual Review of Phytopathology, 1971, 9(1):275-296.
[2] Angl J, Jones JDG. Plant pathogens and integrated defence responses to infection[J]. Nature, 2001, 41(1):826-833.
[3] 董继新, 董海涛, 李德葆. 植物抗病基因研究进展[J]. 植物病理学报, 2001, 31(1):1-9.
[4] Takken FLW, Tameling WIL. To nibble at plant resistance proteins[J]. Science, 2009, 324(5928):744-746.
[5] Parker JE, Holub EB, Frost LN, et al. Characterization of eds1, a mutation inArabidopsissuppressing resistance toPeronospora parasiticaspecified by several different RPP genes[J]. The Plant Cell Online, 1996, 8(11):2033-2046.
[6] Century KS, Holub EB, Staskawicz BJ.NDR1, a locus ofArabidopsisthaliana that is required for disease resistance to both a bacterial and a fungal pathogen[J]. Proc Nati Acad Sci USA, 1995, 92(14):6597-6601.
[7] Century KS, Shapiro AD, Repetti PP, et al.NDR1, a pathogeninduced component required forArabidopsisdisease resistance[J].
Science, 1997, 278(5345):1963-1965.
[8] Coppinger P, Repetti PP, Day B, et al. Over expression of the plasma membrane-localized NDR1 protein results in enhanced bacterial disease resistance inArabidopsis thaliana[J]. The Plant Journal, 2004, 40(2):225-237.
[9] Aarts N, Metz M, Holub E, et al. Different requirements for EDS1 and NDR1 by disease resistance genes define at least two R genemediated signaling pathways inArabidopsis[J]. Proc Natl Acad Sci USA, 1998, 95(17):10306-10311.
[10] McDowell JM, Cuzick A, Can C, et al. Downy mildew(Peronospora parasitica)resistance genes inArabidopsisvary in functional requirements for NDR1, EDS1, NPR1 and salicylic acid accumulation[J]. The Plant Journal, 2000, 22(6):523-529.
[11] Bittner-Eddy PD, Beynon JL. TheArabidopsisdowny mildew resistance gene, RPP13-Nd, functions independently of NDR1 and EDS1 and does not require the accumulation of salicylic acid[J]. Molecular Plant-Microbe Interactions, 2001, 14(3):416-421.
[12] Wiermer M, Feys BJ, Parker JE. Plant immunity:the EDS1 regulatory node[J]. Curr Opin Plant Biol, 2005, 8:383-389.
[13] Feys BJ, Moisan LJ, Newman MA, et al. Direct interaction between theArabidopsisdisease resistance signaling proteins[J]. EDS1 and PAD4[J]. The EMBO Journal, 2001, 20(19):5400-5411.
[14] Feys BJ, Wiermer M, Bhat RA, et al.ArabidopsisSENESCENCEASSOCIATED GENE101 stabilizes and signals within an ENHANCED DISEASE SUSCEPTIBILITY1 complex in plant innate immunity[J]. Plant Cell, 2005, 17:2601-2613.
[15] Wright CA, Beattie GA.Pseudomonas syringaepv. tomato cells encounter inhibitory levels of water stress during the hypersensitive response ofArabidopsis thaliana[J]. Proc Natl Acad Sci USA, 2004, 101(9):3269-3274.
[16] Knepper C, Savory EA, Day B.ArabidopsisNDR1 is an integrinlike protein with a role in fluid loss and plasma membrane-cell wall adhesion[J]. Plant Physiology, 2011, 156(1):286-300.
[17] Hynes RO. The extracellular matrix:not just pretty fibrils[J]. Science, 2009, 326(5957):1216-1219.
[18] Manning VA, Hamilton SM, et al. The Arg-Gly-Asp-containing, solvent-exposed loop of Ptr ToxA is required for internalization[J]. Mol Plant Microbe Interact, 2008, 21(3):315-325.
[19] Dodds PN, Rafiqi M, Gan PHP, et al. Effectors of biotrophic fungi and oomycetes:pathogenicity factors and triggers of host resistance[J]. New Phytologist, 2009, 183(4):993-1000.
[20] Wang J, Cao Y, Zheng G. Mutation in the RGD motif decreases the esterase activity of Xcc_est[J]. Biotechnology Letters, 2009, 31(9):1445-1449.
[21] Shapiro AD, Zhang C. The role of NDR1 in avirulence genedirected signaling and control of programmed cell death inArabidopsis[J]. Plant Physiology, 2001, 127(3):1089-1101.
[22] 窦道龙, 王冰山, 朱生伟, 等. 转NDR1基因烟草对赤星病和晚疫病的抗性增强[J]. 中国农业科学, 2003, 36(10):1120-1124.
[23] Dörmann P, Gopalan S, Yang He S, et al. A gene family inArabidopsis thalianawith sequence similarity toNDR1andHIN1[J]. Plant Physiol Biochem, 2000, 38(10):789-796.
[24] Chong J, Le Henanff G, Bertsch C, et al. Identification, expression analysis and characterization of defense and signaling genes inVitis vinifera[J]. Plant Physiol Biochem, 2008, 46(4):469-481.
[25] Cacas JL, Petitot AS, Bernier L, et al. Identification and characterization of the Non-race specific Disease Resistance 1(NDR1)orthologous protein in coffee[J]. BMC Plant Biology, 2011, 11(1):144-150.
[26] Lu H, Zhang C, Albrecht U, et al. Over expression of a citrus NDR1 ortholog increases disease resistance inArabidopsis[J]. Frontiers in Plant Science, 2013, 4(157):1-10.
[27] Van der Biezen EA, Jones JD. Plant disease resistance proteins and the“gene-for-gene”concept[J]. Trends Biochem Sci, 1998, 23(1):454-456.
[28] Chisholm ST, Dahlbeck D, Krishnamurthy N, et al. Molecular characterization of proteolytic cleavage sites of the Pseudomonas syringae effector AvrRpt2[J]. Proc Natl Acad Sci USA, 2005, 102(6):2087-2092.
[29] Day B, Dahlbeck D, Staskawicz BJ. NDR1 interaction with RIN4 mediates the differential activation of multiple disease resistance pathways inArabidopsis[J]. Plant Cell, 2006, 18(10):2782-2791.
[30] Knepper C, Savory EA, Day B. The role of NDR1 in pathogen perception and plant defense signaling[J].Plant Signaling & Behavior, 2011(6):1114-1116.
(责任编辑 狄艳红)
Advances of NDR1 Gene Determined Broad-spectrum Disease Resistance in Arabidopsis
Gong Qianyuan Zhang Chao Li Weimin Zhang Yongqiang
(Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081)
The research of resistance genes is the basis of disease resistance breeding and plant diseases controlling. Arabidopsis NDR1(non-race-specific disease resistance 1)gene, encoding a plasma membrane protein, plays an important role in the R gene mediated disease resistance, by interacting with CC-NB-LRR(nucleic acid binding or coiled-coil leucine-rich repeat)class of antiviral proteins. Here, we summarized the latest progresses of Arabidopsis NDR1 gene and the broad-spectrum disease resistance of NDR1.
Disease resistance gene NDR1 CC-NB-LRR
2013-12-03
国家转基因生物新品种培育重大专项(2011ZX08001-002)
龚前园,男,硕士研究生,研究方向:植物分子生物学与基因工程;E-mail:gqyscnc@sina.cn
张永强,男,研究员,研究方向:植物分子生物学;E-mail:zhangyongq@sina.com
