木犀草素对糖尿病脑梗死大鼠神经细胞凋亡及HSP70 mRNA、Fas mRNA表达的影响
2014-03-17张俊会
刘 涛 张俊会 李 娜
1.河北省民政总医院内四科,河北邢台054000;2.邢台医学高等专科学校病理教研室,河北邢台054000
木犀草素对糖尿病脑梗死大鼠神经细胞凋亡及HSP70 mRNA、Fas mRNA表达的影响
刘 涛1张俊会2▲李 娜2
1.河北省民政总医院内四科,河北邢台054000;2.邢台医学高等专科学校病理教研室,河北邢台054000
目的探讨木犀草素对糖尿病脑梗死大鼠神经细胞凋亡及HSP70 mRNA、Fas mRNA表达的影响。方法Wistar大鼠60例,随机分为对照组、模型组及木犀草素高、中、低剂量组。对照组给予常规饲料喂养;模型组及木犀草素高、中、低剂量组采用高脂高糖饮食加腹腔注射小剂量链脲霉素建立糖尿病大鼠模型,造模后,木犀草素高剂量、中剂量、低剂量组每日分别给予木犀草素200、100、50 mg/kg灌胃,模型组每日给予生理盐水2 mL灌胃,连续8周。再以线栓法建立大鼠大脑中动脉永久性缺血模型,术后24 h断头取脑,用TUNEL法和原位杂交法观察大鼠脑细胞凋亡与脑组织HSP70 mRNA及Fas mRNA的表达。结果木犀草素低、中、高剂量组糖尿病脑梗死神经细胞凋亡数分别为(16.42±1.39)、(11.08±2.15)、(9.25±1.98)个/高倍视野低于模型组[(29.75±2.36)个/高倍视野],组间差异有统计学意义(均P<0.01);HSP70 mRNA在模型组表达[(9.75±2.766)个/高倍视野]显著高于对照组[(0个/高倍视野)](P<0.01);低、中、高三个剂量的木犀草素组HSP70 mRNA表达分别为(11.33±2.15)、(13.92± 2.15)、(14.92±1.95)个/高倍视野,均高于模型组[(9.75±2.76)个/高倍视野](均P<0.01);Fas mRNA在模型组大鼠脑组织阳性细胞数[(25.33±3.17)个/高倍视野]显著高于对照组[(2.67±0.95)个/高倍视野](P<0.01);高、中、低剂量木犀草素组大鼠脑组织Fas mRNA阳性细胞数分别为(11.92±2.41)、(12.00±2.50)、(19.75±2.54)个/高倍视野,显著低于模型组[(25.33±3.17)个/高倍视野](均P<0.01)。结论木犀草素可以抑制糖尿病脑梗死大鼠神经细胞凋亡,其机制与木犀草素升高大鼠脑组织HSP70 mRNA表达,同时使Fas mRNA的表达降低有关。
糖尿病;脑梗死;木犀草素;HSP70 mRNA;Fas mRNA
缺血性脑损伤后会出现多种病理改变,坏死是引起梗死中心区神经细胞死亡的主要原因,而凋亡则是导致梗死半暗带区神经细胞死亡的主要因素[1]。凋亡细胞主要存在于半暗带区,因而凋亡能够影响最后脑梗死的面积[2]。HSP70是一种细胞内源性保护蛋白,主要参与机体耐受的形成[3-4],有抑制细胞凋亡的作用,而Fas基因是促进细胞凋亡的重要基因[5-6]。木犀草素(Luteolin)最初是从草本植物木犀草的叶、茎、枝中被分离出而得名,其具有抗炎、抗氧化、抑制凋亡、抗过敏、抗肿瘤等多种生物学作用。为此,本实验在于观察木犀草素对糖尿病脑梗死大鼠神经细胞凋亡及HSP70 mRNA、Fas mRNA表达的影响,以探讨木犀草素对糖尿病脑梗死大鼠脑损伤的保护机制。
1 材料与方法
1.1 实验动物、试剂和药品
雄性Wistar大鼠60只,体重180~230 g。来源于北京维通利华实验动物技术有限公司,生产许可证:SCXK(京)2009-0003。细胞凋亡检测试剂盒(TUNEL)、HSP70及Fas原位杂交试剂盒均购于武汉博士德生物技术公司;木犀草素(98%)购于陕西慧科植物开发有限公司;链尿菌素(STZ)购于Sigma公司。
1.2 实验方法
1.2.1 动物模型制作各组均先以高脂高糖饲料喂养4周,然后以STZ(30 mg/kg)腹腔注射1次,72 h后尾静脉采血测定血糖,空腹血糖>16.7 mol/L的大鼠判定为造模成功。以线栓法制作大鼠右侧大脑中动脉闭塞(MCAO)模型[7]。大鼠成功麻醉后,颈部正中切口,暴露并钝性游离右侧颈总动脉(CCA)、颈外动脉及颈内动脉,结扎同侧CCA近心端和颈外动脉(ECA)分叉部,距颈总动脉分叉处近心端5 mm处剪口,选用头端烧成光滑杵状的国产尼龙线插入颈内动脉,以颈总动脉分叉处计算进线深度为18 mm左右,至大脑中动脉起始部以完全阻断血供,结扎颈内动脉并固定鱼线。术中,用加热垫和灯泡保持肛温在37.0~37.5℃。
1.2.2 动物分组及处理60只Wistar大鼠,随机分为5组:对照组、模型组及木犀草素高、中、低剂量组,每组各12只。糖尿病性动物模型制备后,开始灌胃给药,木犀草素高剂量、中剂量、低剂量组每日分别给予木犀草素200、100、50 mg/kg灌胃,模型组与对照组每日给予生理盐水2 mL灌胃,连续8周。每组大鼠于MCAO术后24 h断头取脑,用TUNEL法和原位杂交法观察大鼠脑细胞凋亡与脑组织HSP70 mRNA及Fas mRNA的表达。
1.2.3 原位凋亡细胞检测各实验组大鼠断头取脑后,将脑组织置于4%的多聚甲醛溶液固定,石蜡包埋,做连续切片,切片厚度为5 μm。TUNEL染色按试剂盒说明操作,细胞核中有棕褐色颗粒者为TUNEL阳性细胞,细胞计数于高倍镜(40×10)下随机选取5个视野,计数阳性细胞数,取平均值。
1.2.4 HSP70 mRNA及Fas mRNA测定采用原位杂交法,操作步骤严格按照说明书进行,DAB显色苏木素复染。阳性判断标准:HSP70 mRNA及Fas mRNA表达于细胞浆,以棕黄色颗粒为阳性。以高倍镜(40× 10)观察5个视野,计数阳性细胞数。
1.3 统计学方法
采用SPSS 11.5统计软件进行统计分析,计量资料数据以均数±标准差(x±s)表示,各组间比较采用方差分析,组间两两比较,采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠脑组织中凋亡细胞数
TUNEL阳性细胞分布在脑梗死半暗带区,形态学上表现为胞核固缩,呈棕褐色。本实验中对照组无凋亡细胞,模型组凋亡细胞数显著高于对照组(P<0.01);木犀草素高、中、低剂量三组凋亡细胞数均低于模型组,组间差异有统计学意义(均P<0.01);木犀草素三组中随药物剂量加大凋亡细胞数逐渐减少,高、中剂量组及中、低剂量组间差异有统计学意义(均P<0.01)。见表1。
2.2 各组大鼠脑组织中HSP70 mRNA、Fas mRNA的表达
对照组HSP70 mRNA无表达,模型组HSP70 mRNA的表达显著高于对照组(P<0.01);低、中、高三个剂量的木犀草素组HSP70 mRNA表达均高于模型组(均P<0.01)。高、中剂量木犀草素组之间及中、低剂量剂量木犀草素组之间比较差异均有统计学意义(均P<0.01)。Fas mRNA在模型组大鼠脑组织阳性表达高于对照组,组间差异有统计学意义(P<0.01);高、中、低剂量木犀草素组大鼠脑组织Fas mRNA阳性细胞数显著低于模型组(均P<0.01);高、中剂量木犀草素组大鼠脑组织Fas mRNA阳性细胞数显著低于小剂量木犀草素组(均P<0.01)。见表1。
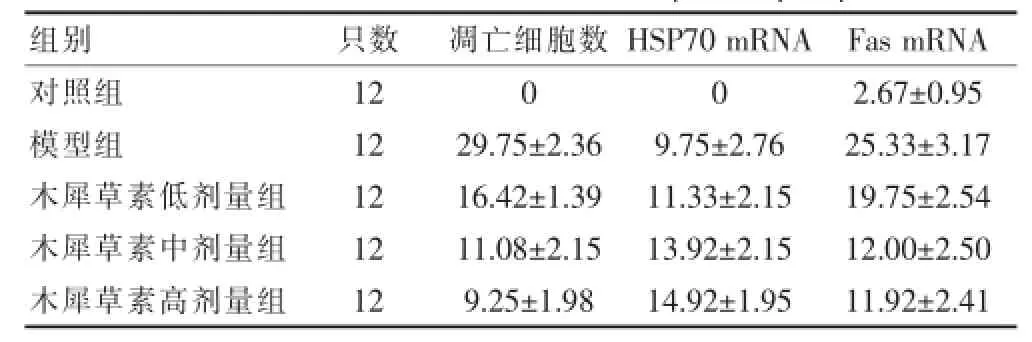
表1 糖尿病大鼠脑梗死后各组凋亡细胞、HSP70 mRNA及Fas mRNA阳性细胞数的比较(个/HD,x±s)
3 讨论
脑梗死后亚急性期和慢性期病变进一步加重的重要原因之一是神经元迟发性死亡,急性脑缺血缺氧损伤后继发的细胞凋亡是迟发性神经元死亡的主要方式[8-9]。细胞凋亡不同于细胞坏死,又称为程序性死亡,是机体清除衰老和损伤的细胞以保持内环境平衡的一种自我调节机制。脑缺血后,缺血中心区神经元细胞因为完全缺血而发生不可逆转地死亡,缺血周边区尤其是缺血半暗带内因多种病理因素而激活凋亡通路,使细胞呈现凋亡的形态学改变。因此挽救半暗带内受损的神经元,对治疗缺血性脑血管疾病就显得尤为重要。细胞凋亡受一系列基因的调控,HSP70与Fas基因是与细胞凋亡有关的两个重要基因。HSP70在正常大鼠脑内并不存在,但在脑缺血、缺氧等诱导下其表达增加,HSP70的高表达是脑受到保护的标志[10]。而Fas基因是重要的促凋亡因子。本实验发现对照组大鼠脑内无HSP70 mRNA阳性细胞,表明在正常情况下脑内无HSP70 mRNA的表达。在糖尿病脑梗死模型组大鼠脑组织中HSP70 mRNA表达增强,与对照组比较差异有统计学意义;对照组大鼠脑内有少数Fas mRNA阳性细胞,在模型组大鼠脑组织中Fas mRNA表达增强,与对照组比较差异有统计学意义。
神经细胞凋亡是一迟发性病变,因而寻求抑制脑缺血后神经元过度凋亡的有效药物是实现脑缺血后脑保护的一条重要途径。木犀草素是存在于多种植物中的天然黄酮类化合物,具有包括抗凋亡在内的多种生物作用。已有研究证明,木犀草素对大鼠早期糖尿病心肌病及实验性糖尿病大鼠的肾脏有保护作用[11-14]。本实验结果显示低、中、高剂量木犀草素组HSP70 mRNA阳性细胞数明显高于模型组;而三种剂量的木犀草素组大鼠脑组织Fas mRNA阳性细胞数显著低于模型组;同时该实验凋亡细胞数检测显示,模型组凋亡细胞数显著高于对照组;木犀草素高、中、低剂量三组凋亡细胞数均低于模型组,组间差异有统计学意义;木犀草素三组中随药物剂量加大凋亡细胞数逐渐减少,显示有剂量依赖性。此结果提示木犀草素可增强HSP70 mRNA的表达,同时使Fas mRNA的表达减少,从而抑制脑缺血后神经细胞凋亡,达到对糖尿病脑梗死的脑组织的保护作用。
[1]BenchouaA,GueganC,CouriaudC,etal.Specificcaspasepathways are activated in two stages of cerebral infarction[J].J Neurosci,2001,21(18):7127-7134.
[2]Guegan C,Boutin H,Boudry C,et al.Apoptotic death in cortical neurons of mice subjected to focal ischemia[J].C R Acad SciⅢ,1996,319(10):879-885.
[3]Brodsky JL,Chiosis G.HSP70 molecular chaperones:emerging roles in human disease and identification of small mole cule modulatots[J].Curr Top Med Chem,2006,6:1215-25
[4]Schoelzke,Marion N,Schwaninger.Markus transcriptional regulation of neurogenesis:potential mechanisms in cerebral ischemia[J].Journal of Molecular Medicine(Berlin),2007,85(6):577-588.
[5]Lee P,Sata M,Lefer DJ,et al.Fas pathway is a critical mediator of cardiac myocyte death and MI during ischemia-reperfusion in vivo[J].Am J Physiol Heart Circ Physiol,2003,284(2):456-463.
[6]Li HZ,Han LP,Jiang CM,et al.Effect of dopamine receptor-1 on apoptosis of cultured neonatal rat cardiomyocytes in simulated ischemia/reperfusion[J].Basic Clini Pharmacol Toxicol,2008,102(3):329-336.
[7]贾玉洁,闵连秋,季占胜,等.原花青素对脑缺血后抑凋亡基因蛋白Bcl-2和促凋亡基因蛋白Bax的影响[J].中国临床康复,2006,10(23):65-72.
[8]Culmsee C,Plesnila N.Targeting Bid to prevent programmed cell death in neurons[J].Biochem Soc Trans,2006,34(6):1334-1340.
[9]Plesnila N,Zhu C,Culmsee C.Nuclear translocation of apoptosis-inducing factor after focal cerebral ischemia[J].J Cereb Blood Flow Metab,2004,24(4):458-466.
[10]林艳婷,余涓,潘燕霞.大鼠脑缺血再灌注损伤与杏仁核基质金属蛋白酶29、水通道蛋白4、热休克蛋白70的表达[J].福建医科大学学报,2007,41(3):21-23.
[11]陈小萍,徐丽,陈海英.木犀草素对早期糖尿病大鼠心肌组织中醛糖还原酶、NOS系统及Na+-K+-ATPase的影响[J].山西医科大学学报,2007,38(8):689-692.
[12]裘儿杰.木犀草素对实验性糖尿病大鼠肾脏的保护作用[J].海峡药学2012,24(6):18-20.
[13]丁婧,王辉,余诗灏,等.肥胖大鼠模型的建立及其脂代谢相关分子机制研究[J].中国实验动物学报,2012,20(5):20-24.
[14]李格宾,山本一郎,新井敏郎,等.肥胖犬白细胞中相关基因及血浆生化指标的变化[J].中国实验动物学报,2013,21(4):75-80.
Effects of Luteolin on nerve cell apoptosis and expression of HSP70 mRNA and fas mRNA in diabetes complicating with stroke rats
LIU Tao1ZHANG Junhui2▲LI Na2
1.Fourth Internal Medicine,General Hospital of Hebei Provincal Civil Administration,Hebei Province,Xingtai 054000,China;2.Department of Pathology,Xingtai Medical College,Hebei Province,Xingtai054000,China
Objective To investigate the effect of Luteolin on nerve cell apoptosis and expression of HSP70 mRNA and Fas mRNA in diabetes complicating with stroke rats.Methods Sixty Wistar rats were randomly divided into normal control,diabetic model,low-dose Luteolin,mid-dose Luteolin and high-dose Luteolin group.Rats of control group were given conventional feed.Rat models of diabetes mellitus of diabetic model group and low-dose Luteolin,middose Luteolin and high-dose Luteolin group were made by high sucrose,fat diet and streptozotion injection.After modeling,rats in high-dose Luteolin,mid-dose Luteolin and low-dose Luteolin group were administed daily with gastric perfusion of 200,100 and 50 mg/kg Luteolin separately for 8 weeks,at the same time,model group was given saline daily 2 mL.Models of focal cerebral infarction of rats were established by the Longa′s technique.All of the rats were killed after 24 hours,TUNEL and in situ hybridization were used to detect nerve cell apoptosis and expression of HSP70 mRNA and Fas mRNA in brain tissue of rats.Results The amount of nerve cell apoptosis in low,medium and high dose of Luteolin group of(16.42±1.39),(11.08±2.15),(9.25±1.98)/HD were lower than those of model group of (29.75±2.36)/HD,the difference was statistically significant(all P<0.01).Compared with control group of(0/HD),the expression of HSP70 mRNA in model group of(9.75±2.76)/HD significant increased.The level of HSP70 mRNA expression in low,medium and high dose of Luteolin group of(11.33±2.15),(13.92±2.15),(14.92±1.95)/HD were significant higher than those of model group of(9.75±2.76)/HD(P<0.01).The amount of Fas mRNA positive cells in model group of(25.33±3.17)/HD was higher than that of control group of(2.67±0.95)/HD(P<0.01);in high,medium and low dose of Luteolin group,the amount of Fas mRNA positivecells of(11.92±2.41),(12.00±2.50),(19.75±2.54)/HD were lower than those of model group of(25.33±3.17)/HD(P<0.01).Conclusion Luteolin can inhibit nerve cell apoptosis of diabetic cerebral infarction rats,its mechanism may be related to increasing the expression of HSP70 mRNA and decreasing the expression of Fas mRNA,thereby reducing the apoptosis of nerve cells.
Diabetes;Infarction;Luteolin;HSP70 mRNA;Fas mRNA
R743.32
A
1673-7210(2014)01(a)-0021-03
2013-10-17本文编辑:卫轲)
▲通讯作者
