瑞芬太尼痛觉过敏大鼠Delta阿片受体mRNA的表达水平
2014-03-16王海云于泳浩王国林
苑 方,王海云,于泳浩,王国林
瑞芬太尼痛觉过敏大鼠Delta阿片受体mRNA的表达水平
苑 方,王海云,于泳浩,王国林
目的:探讨切口痛-瑞芬太尼痛觉过敏大鼠背根神经节及海马Delta阿片受体mRNA表达水平的变化。方法:健康雄性SD大鼠32只,尾静脉置管后随机分为4组,瑞芬太尼组(R组)输注瑞芬太尼1μg·kg-1·min-1,切口痛组(I组)输注等体积生理盐水,甘氨酸组(G组)输注甘氨酸15μg·kg-1·min-1,对照组(C组)输注等体积生理盐水,最后一次痛阈测定后留取大鼠L4~L6背根神经节及海马标本,应用实时定量PCR方法测定Delta阿片受体mRNA的表达水平。结果:R组、I组、G组均发生痛觉过敏,且R组痛觉过敏的程度高于I组和G组;R组海马Delta阿片受体mRNA表达水平(4.359±1.031)显著高于C组、I组(2.373±1.014)和G组(2.411±0.326)(P<0.05);R组背根神经节Delta阿片受体mRNA表达水平(2.108±0.361)显著高于C组、I组(1.409±0.435)和G组(1.413±0.234)(P<0.05)。结论:瑞芬太尼可在切口痛模型大鼠中引发痛觉过敏,其机制可能与背根神经节及海马Delta阿片受体mRNA表达上调有关。
痛觉过敏;瑞芬太尼;Delta阿片受体;实时定量PCR;大鼠
阿片类药物引发的痛觉过敏现象(opioids induced hyperalgesia,OIH)不仅降低了药物的镇痛效果,还可促进痛觉感知,产生异常疼痛,甚至引发术后慢性疼痛的发生[1-2]。瑞芬太尼为纯粹的μ阿片受体激动剂,起效迅速,镇痛作用消退快,产生的痛觉过敏的发生率明显高于其他阿片类药物[3-4]。采用药物拮抗或基因敲除方法抑制Delta阿片受体,可增强μ阿片受体激动剂的抗伤害性感受作用,同时抑制OIH的发生[5]。本研究通过评价切口痛-瑞芬太尼痛觉过敏大鼠海马及背根神经节Delta阿片受体mRNA表达的变化,探讨Delta阿片受体在瑞芬太尼引发痛觉过敏中的作用机制。
1 材料和方法
1.1 动物 健康雄性SD大鼠32只,体质量250~280 g,由中国人民解放军军事医学科学院实验动物中心提供。
1.2 Brennan切口痛模型制备 腹腔内注入10%水合氯醛0.3 mL/kg,手术区域备皮消毒,于右后足底用11号刀片行1 cm长纵行切口,从足跟近端0.5 cm延伸至足趾方向,切开足底皮肤和筋膜,显露跖肌。纵行切开跖肌,保持其起止端的完整。轻压止血,5-0丝线缝合切口,伤口处涂抹红霉素软膏。
1.3 分组及给药方式 随机分为4组(n=8)。R组(瑞芬太尼)麻醉后尾静脉置管,建立切口痛模型,持续输注瑞芬太尼1μg·kg-1·min-1(宜昌人福药业有限责任公司,批号6131214)。C组(对照组)输注等体积生理盐水。I组(切口痛组)输注等体积生理盐水。G组(甘氨酸组)输注甘氨酸(商品化瑞芬太尼赋形剂,中国药品生物制品检定所,批号735-200102)15μg·kg-1·min-1。各组输注时间均为60min。
1.4 机械刺激PWT和热刺激PWL测定 分别于术前24 h(T0)、术后24 h(T1)、48 h(T2)在室温[(20± 2)℃]安静环境中测定机械刺激PWT和热刺激PWL。将大鼠放置于20 cm×20 cm×20 cm金属笼,适应2 h,用电子von Frey丝(Harvard Apparatus公司,美国)透过金属笼底垂直刺激左后肢足底中部,逐渐加压,出现快速缩足反应、舔舐右足或嘶叫动作为阳性反应。停止加压,记录其压力值(g),即为大鼠PWT。每只大鼠测定3次,间隔15 s,取其平均值。压力值大于25 g时,记为25 g。应用YLS-6B智能热板仪(安徽省淮北正华生物仪器设备有限公司)测定大鼠PWL,记录从大鼠左后足接触热板致出现回缩、踮脚、挣扎、嘶叫、舐足任一反应的时间作为PWL。每只大鼠测定3次,间隔10min,取其平均值。为防止大鼠烫伤,将PWL上限值定为30 s。
1.5 背根神经节及海马Delta阿片受体mRNA表达检测 术后48 h测定各组大鼠的机械性PWT及热板PWL,用手术剪断头处死大鼠,眼科剪从椎管纵向剪开颅骨,沿中线分开两个大脑半球,分离皮层组织,取出海马。取背中线切口逐层解剖暴露脊椎,小心剪开椎板,取出L4~L6 DRG。将组织迅速置于液氮中冷冻,-80℃冰箱保存。将标本放入加有2~3倍体积Trizol(Invitrogen公司,美国)的匀浆器中,在冰浴中充分匀浆。按步骤提取总RNA。对总RNA的浓度、纯度及完整性进行检测,使用高效cDNA逆转录试剂盒(ABI公司,美国)将2μg总RNA定量逆转录为cDNA。应用Taqman®基因表达探针(ABI公司,美国)通过实时定量PCR检测Delta阿片受体mRNA的表达。选择GAPDH作为内源性对照。在96孔板上设置PCR反应,20μL反应体系中包括Taqman®基因表达预混液、Taqman®基因表达探针、cDNA模板及去RNA酶水。PCR程序设置为UP酶激活95℃10 min;变性95℃15 s;延伸60°C 1 min。程序2和3为40个循环。通过比较阈值法计算目的基因的相对表达量,即用2-△Ct将原始数据(△Ct值)转化成线性形式,再以2-△△CT方法计算mRNA的相对表达量。
1.6 统计学处理 采用SPSS 16.0统计软件进行分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,组内两两比较采用LSD法,P<0.05认为差异有统计学意义。
2 结果
32只SD大鼠尾静脉穿刺置管100%成功,术后均无感染、无死亡,全部顺利完成实验要求。与术前24 h相比较,术后(24 h、48 h)I组、G组及R组机械缩爪阈值及热板缩爪潜伏期降低(P<0.05)。与C组相比较,I组、G组及R组机械缩爪阈值及热板缩爪潜伏期降低(P<0.05)。与I组和G组相比较,R组机械缩爪阈值及热板缩爪潜伏期降低(P<0.05)。见图1、图2。

图1 各组大鼠不同时间点机械性PWT的比较
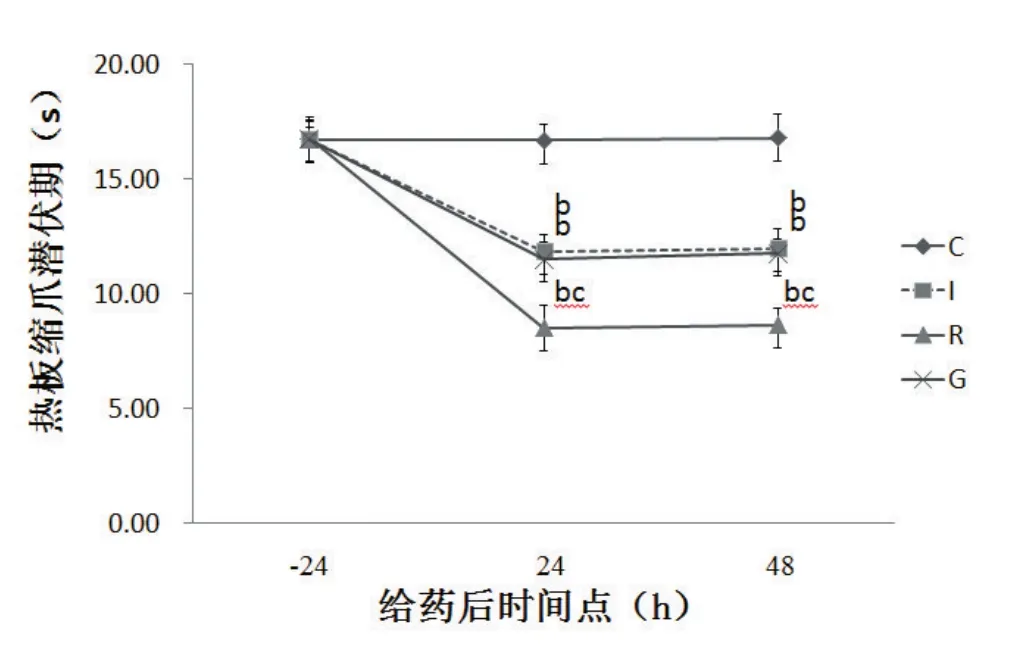
图2 各组大鼠不同时间点热板PWL的比较
与C组相比较,I组、G组及R组海马及背根神经节Delta阿片受体mRNA表达上调。与I组及G组相比较,R组海马及背根神经节Delta阿片受体mRNA表达上调(P<0.05)。见表1、表2。
表1 各组大鼠海马DOR mRNA表达水平比较(±s)

表1 各组大鼠海马DOR mRNA表达水平比较(±s)
注:与C组相比,aP<0.05;与I组和G组相比,bP<0.05
2-△Ct 2-△△CT C组I组G组R组△Ct 11.591±0.365 10.469±0.404 10.485±0.281 9.503±0.157 0.000 33±0.000 08 0.000 73±0.000 20 0.000 71±0.000 14 0.001 39±0.000 16△△Ct 0 -1.122±0.481 -1.260±0.189 -2.088±0.362 1 2.373±1.014a2.411±0.326a4.359±1.031a、b
表2 各组大鼠DRG中DOR mRNA表达水平比较(±s)
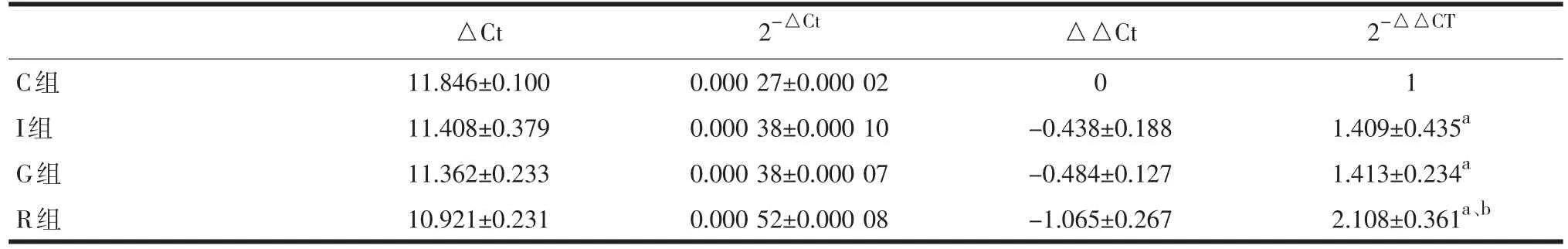
表2 各组大鼠DRG中DOR mRNA表达水平比较(±s)
注:与C组相比,aP<0.05;与I组和G组相比,bP<0.05
2-△Ct 2-△△CT C组I组G组R组△Ct 11.846±0.100 11.408±0.379 11.362±0.233 10.921±0.231 0.000 27±0.000 02 0.000 38±0.000 10 0.000 38±0.000 07 0.000 52±0.000 08△△Ct 0 -0.438±0.188 -0.484±0.127 -1.065±0.267 1 1.409±0.435a1.413±0.234a2.108±0.361a、b
3 讨论
大鼠足底切口痛模型是痛觉过敏研究中广泛应用的经典模型。参照Brennan法建立的大鼠切口疼痛模型的疼痛行为以及其持续时间,与临床上外科手术和术后状态一致,为研究术后疼痛机制较理想的动物模型。高剂量瑞芬太尼可诱发术后痛觉过敏。Joly等[6]在一项临床调查中发现,当瑞芬太尼以0.05~0.3μg·kg-1·min-1的速度输注60~90min,就会造成患者术后吗啡镇痛剂量的增加,引发痛觉过敏现象。大鼠与人的等效剂量比值为6.3,即相同给药途径,大鼠的给药剂量=6.3×人的给药剂量。有研究[7]表明,接受致敏剂量瑞芬太尼的切口痛模型,大鼠痛觉过敏现象始于术后24 h,术后24~48 h达到高峰。本实验将研究时间点确定为术前24 h(基础值)及术后24 h、48 h,根据结果,与C组相比较,术后(24 h、48 h)I组、G组及R组机械缩爪阈值和热板缩爪潜伏期显著降低。表明大鼠出现痛觉过敏现象,足底切口痛模型建立成功。
Delta阿片受体是3种主要的阿片受体之一,它分散的分布在中枢神经系统中,其分布呈一定的梯度性,前脑水平较高,而后脑部相对较低。在脊髓背角部位也有其分布,可介导Delta阿片受体激动剂的镇痛作用[8]。本研究结果显示,与C组、I组和G组相比较,R组大鼠术后(24 h、48 h)机械缩爪阈值和热板缩爪潜伏期显著降低,出现明显的痛觉过敏现象,且海马及背根神经节Delta阿片受体mRNA表达上调,表明瑞芬太尼所诱发的痛觉过敏与海马及背根神经节Delta阿片受体mRNA表达上调有关。其可能机制为,瑞芬太尼通过上调Delta阿片受体mRNA的表达激活Delta阿片受体,强化NMDA受体中内向电流,快速而持久的增加NMDA受体的反应性[9]。NMDA受体的激活可以放大神经细胞中的钙信号,使伤害性感受信号传入增加,导致痛觉过敏现象的发生。
瑞芬太尼可在切口痛模型大鼠中引发痛觉过敏,其机制可能与海马及背根神经节Delta阿片受体mRNA表达上调有关,从而为临床治疗瑞芬太尼所引发的痛觉过敏提供了新的方向。
[1]Silverman SM.Opioid induced hyperalgesia:clinical implications for the pain practitioner[J].Pain Physician,2009,12(3):679-684.
[2]Joo DT.Mechanisms of opioid tolerance:emerging evidence and therapeutic implications[J].Can J Anesth,2007,54(12):969-976.
[3]Cabañero D,Campillo A,Célérier E,et al.Pronociceptive Effects of Remifentanil in a Mouse Model of Postsurgical Pain[J].Anesthesiology,2009,111(6):1334-1345.
[4]Cabañero D,Célérier E,García-Nogales P,et al.The pro-nociceptive effects of remifentanil or surgical injury in mice are associated with a decrease in delta-opioid receptor mRNA levels:Prevention of the nociceptive response by on-site delivery of enkephalins[J]. Pain,2009,141(1-2):88-96.
[5]Zhang X,Bao L,Guan JS.Role of delivery and trafficking of delta-opioid peptide receptors in opioid analgesia and tolerance[J]. Trends Pharmacol Sci,2006,27(6):324-329.
[6]Joly V,Richebe P,Guignard B,et al.Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamine [J].Anesthesiology,2005,103(1):147-155.
[7]Celerier E,Gonzalez JR,Maldonado R,et al.Opioid-induced hyperalgesia in a murine model of postoperative pain[J].Anesthesiology,2006,104(3):546-555.
[8]李依泽,王海云,郭东勇,等.δ受体在瑞芬太尼诱发大鼠脊髓背角神经元NMDA受体微小兴奋性突触后膜电流中的作用[J].中华麻醉学杂志,2011,31(11):1344-1346.
[9]Zhao M,Joo D T.Enhancement of spinal N-methyl-D-aspartate receptor function by remifentanil action at delta2opioid receptors as a mechanism for acute opioid2induced hyperalgesia or tolerance [J].Anesthesiology,2008,109(2):308-317.
(收稿:2014-03-26 修回:2014-06-26)
(责任编辑 余剑波)
·作者须知·
研究涉及基金项目的标识
论文所涉及的基金项目,应在文章首页左下角以“基金项目”作为标识注明基金项目名称,并在圆括号内注明其项目编号。基金项目名称应按国家有关部门规定的正式名称填写,多项基金应依次列出,其间以分号(;)隔开。如“基金项目:国家自然科学基金(30271269);‘十五’国家高技术研究发展计划(2003AA205005)”,作为脚注的第1项。
Expression of Delta-opioid Receptor in Rats with Remifentanil-induced Hyperalgesia
YUAN Fang, WANG Hai-yun,YU Yong-hao,et al.
Department of Anesthesiology,Tianjin Medical University General Hospital,Tianjin(300052),China
Objective To investigate the changes in the expression of delta-opioid receptor in dorsal root ganglion and hippocampus in rats with incisional pain(IP)-remifentanil-induced hyperalgesia.MethodsThirty-two SD male rats(250~280 g)were random ly divided into 4 groups:group R,remifentanil 1μg·kg-1·min-1was infused intravenously;group I,the same volume of saline was infused intravenously;group G,glycine 15μg· kg-1·min-1was infused intravenously;group C,the same volume of saline was infused intravenously.Each animal was sacrificed after the last behavioral measurement.The dorsal root ganglion and hippocampus were removed for the evaluation of the expression of delta-opioid receptor mRNA by quantitative RT-PCR.ResultsRemifentanil-induced hyperalgesia developed in group R,I and G.Comparing with group C,I(2.373±1.014)and G (2.411±0.326),the expression of delta-opioid receptor mRNA in hippocampus was significantly up-regulated in group R(4.359±1.031)(P<0.05).Comparing with group C,I(1.409±0.435)and G(1.413±0.234),the expression of delta-opioid receptor mRNA in dorsal root ganglion was significantly up-regulated in group R(2.108± 0.361)(P<0.05).ConclusionThese data indicate that the increased expression of delta-opioid receptor mRNA in dorsal root ganglion and hippocampus is involved in remifentanil-induced-hyperalgesia.
Hyperalgesia;remifentanil;delta-opioid receptor;qRT-PCR;rats
Q95-33;R971+.1
A
1007-6948(2014)05-0507-04
10.3969/j.issn.1007-6948.2014.05.013
国家自然科学基金(30972847)
天津医科大学总医院麻醉科(天津 300052)
于泳浩,E-mail:yuyonghao@126.com
