南京地区肉鸽大肠杆菌分离与鉴定
2014-03-15方光远季凤娟胡志华陈俊红顾亚凤蒋加进
方光远,季凤娟,胡志华,陈俊红,顾亚凤,蒋加进
(1.金陵科技学院动物科学与技术学院,江苏 南京 210038;2.江苏省南通市通州区二甲镇农业服务中心,江苏 南通 226321)
肉鸽大肠杆菌病是由各种不同血清型大肠杆菌引起的病鸽出现以腹泻为主要症状的一类疫病,临床上患病肉鸽症状多呈呼吸困难、羽毛杂乱、精神萎靡、排出黄白色稀粪、呆立、闭眼、腿爪干燥,发病后死亡率较高[1]。本病一年四季均可发生,尤以冬季和夏季最为常见,病鸽是造成该病最主要的传染源。本试验从南京地区7只发病刚死亡的20日龄病乳鸽(美国王鸽)肝脏中分离到7株细菌,对这些分离细菌进行分离培养、形态染色、生化试验、16SrDNA基因片段序列测定。通过药敏试验获得了分离菌敏感药物和耐药性数据,为临床预防和治疗肉鸽大肠杆菌病提供了参考。现将试验过程和鉴定结果报告如下。
1 试验材料与方法
1.1 试验材料
1.1.1 培养基 S.S琼脂平板、普通营养琼脂平板、普通营养肉汤和三糖铁琼脂斜面,自行配制。
1.1.2 微量鉴定管 肠杆菌科细菌GYZ-15e生化编码鉴定管,购自杭州天和微生物试剂有限公司。
1.1.3 药敏纸片 所用14种药敏纸片有:氨苄西林(20 μg/片)、头孢哌酮(30 μg/片)、头孢呋辛(30 μg/片)、头孢曲松(30 μg/片)、头孢噻肟(30 μg/片)、链霉素(10 μg/片)、庆大霉素(10 μg/片)、丁胺卡那(30 μg/片)、妥布霉素(10 μg/片)、多粘菌素B(30 μg/片)、诺氟沙星(5 μg/片)、环丙沙星(5 μg/片)、左氧氟沙星(5 μg/片)、呋喃妥因(300 μg/片)。均购自杭州天和微生物试剂有限公司。
1.1.4 标准大肠杆菌O抗原因子定型血清 标准大肠杆菌O1、O2、O4、O5、O6、O8、O9、O15、O20、O21、O26、O35、O36、O78、O81、O86、O101、O103、O111、O115、O117、O137“O”抗原定型血清22种,此22种大肠杆菌“O”抗原血清型为畜禽常见致病性大肠杆菌血清型,均购自中国兽医药品监察所。
1.1.5 细菌16 SrDNA基因片段PCR检测试验试剂 2×Taq PCR Master Mix、DL 2 000 Marker、超纯水,购自宝生物工程(大连)有限公司。
1.2 试验方法
1.2.1 细菌分离培养 无菌采集南京地区7只发病刚死亡的20日龄病乳鸽(美国王鸽)肝脏病料分别接种于SS琼脂平板上,做上标签,37 ℃培养24 h。取生长典型的单个菌落再分区划线接种于SS琼脂平板和普通营养琼脂平板、穿刺接种于三糖铁琼脂斜面和营养肉汤中,37 ℃培养24 h后,观察菌落形态和在三糖铁琼脂斜面及营养肉汤中生长情况。
1.2.2 细菌染色镜检 取纯培养物在洁净载玻片上抹片,干燥,火焰固定后,进行革兰氏染色,然后在普通光学显微镜油镜下进行观察。
1.2.3 细菌的生化特性鉴定 取分离细菌纯培养物分别接种肠杆菌科细菌GYZ-15e生化编码鉴定管,置37 ℃培养24 h后进行观察结果。
1.2.4 血清型鉴定 将分离到的上述7种细菌纯培养物用生理盐水洗涤,收集于2 mL塑料试管中,8 000 r/min离心15 min洗涤2次,稀释成100亿/mL菌液,用电热高压蒸汽灭菌锅15磅121 ℃高压2 h,破坏其菌毛抗原,用下面22种标准大肠杆菌O1、O2、O4、O5、O6、O8、O9、O15、O20、O21、O26、O35、O36、O78、O81、O86、O101、O103、O111、O115、O117、O137“O”抗原定型血清分别与上述菌液作玻片凝集试验,鉴定“O”抗原种类。
1.2.5 药敏试验 应用纸片琼脂扩散法(K-B 法)测定7株分离菌对临床常用14种抗菌药物的敏感性。药敏试验结果的判定标准,根据临床和实验室标准协会CLSI文件M02-A11(抗菌药物敏感试验纸片法执行标准,批准标准-第十一版)判定分离细菌的敏感(高敏)、中介(中敏)与耐药百分率。
1.2.6 分离细菌16SrDNA基因片段序列测定 根据文献,设计了1对引物,对7株分离菌16SrDNA 439 bp基因片段进行PCR 扩增,上下游引物序列分别为:上游引物F:5′-GGG AGC AAA CAG GAT TAG A-3′;下游引物R:5′-AGG GCC ATG ATG ACT TGA-3′。引物由宝生生物工程(大连)有限公司合成。PCR扩增过程及测序如下:①DNA模板制备: 取37 ℃培养24 h的7株分离菌肉汤培养物2 mL,4 ℃、10 000 r/min离心2 min,倾去上清液,加入无菌水2 mL,混匀4 ℃、10 000 r/min离心2 min,倾去上清液,加入无菌水2 mL混匀4 ℃保存备用;②目的基因片段的扩增及测序:采用25 μL体系: 2×Taq PCR Master Mix 12.5 μL,上下游引物各0.5 μL,DNA模板0.5 μL,双蒸水11 μL。PCR反应程序为:94 ℃预变性8 min;94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸1 min ,30个循环;72 ℃延伸10 min。扩增后取5 μL PCR产物于1%琼脂糖凝胶中进行电泳,电泳后在可见紫外光检测仪中观察,若条带清晰,随机选取1株分离菌PCR扩增产物送至宝生生物工程(大连)有限公司进行测序。
2 结果与分析
2.1 细菌分离培养结果
将无菌采集的发病刚死亡7份鸽病料接种于S.S琼脂平板上,分离到7株细菌。7株细菌分别分区划线接种于S.S平板和普通营养琼脂平板上,37 ℃培养24 h结果如下:接种于S.S琼脂平板上的菌落为圆形、隆起、湿润、边缘整齐、表面光滑、菌落呈红色、菌落直径为2 mm左右;接种于普通营养琼脂平板上菌落呈圆形、隆起、湿润、边缘整齐、表面光滑、无色半透明、菌落直径为2 mm左右。7株细菌于三糖铁琼脂中斜面均呈黄色,底部有大量气泡产生,不产生H2S。7株细菌于营养肉汤中呈均匀浑浊状态。
2.2 细菌染色镜检结果
7株分离菌均为革兰氏阴性中等大小的杆菌,菌体两端钝圆,单个存在,菌体大小1~3 μm×0.4~0.7 μm,无芽孢和荚膜。
2.3 细菌生化特性鉴定结果
7株分离菌纯培养物分别接种于肠杆菌科细菌GYZ-15e生化编码鉴定管,置37 ℃恒温培养箱中,培养18~24 h,根据生化反应结果,按照肠杆菌科细菌GYZ-15e生化鉴定编码册介绍的计算鉴定总值方法,计算每株细菌鉴定总值,7株分离菌鉴定总值分别为06311、06335、06365、06335、46365、06375、06375,然后查肠杆菌科细菌GYZ-15e生化鉴定编码册检索表,7株分离菌鉴定结果表明均为大肠杆菌。
2.4 血清型鉴定结果
经玻片凝集试验鉴定结果表明,7株鸽大肠杆菌血清型其中5株为O2型,2株为O78型。
2.5 药敏试验结果
将7株分离细菌应用纸片琼脂扩散法(K-B 法)测定对14种临床常用抗菌药物的敏感性。试验结果表明,7株分离菌对头孢呋辛、头孢曲松、头孢噻肟、多粘菌素B 4种药物100%敏感,对头孢哌酮敏感率为85.7%,对庆大霉素、呋喃妥因敏感率均为71.4%。对临床常见的药物氨苄西林、链霉素、丁胺卡那耐药率分别高达85.7%、71.4%和85.7%。对氟喹诺酮类诺氟沙星、环丙沙星、左氧氟沙星耐药率也都较高,分别为71.4%、57.1%和71.4%。
2.6 细菌16SrDNA测序结果
7株分离菌16SrDNA 439 bp基因片段进行PCR 扩增电泳结果见图1。7株分离菌均扩增出16SrDNA 439 bp基因片段。
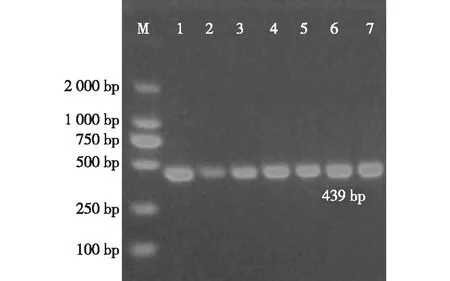
注:M代表DL2 000 DNA marker;1-7代表7株分离菌样品图1 7株分离菌16SrDNA 439 bp基因片段PCR电泳图Fig.1 The PCR electrophoresis of 16SrDNA 439 bp gene of 7 bacteria
随机选取1株分离菌16SrDNA 439 bp基因片段PCR产物送宝生生物工程(大连)有限公司测序,结果获得407 bp序列,将此407 bp核苷酸片段测序结果在NCBI网进行blast,结果表明,此分离菌407 bp核苷酸片段与GenBank中已知8株大肠杆菌(序列号分别为:KJ477007、CP007136、CP006027、CP006784、KF768068、KF771032、CP007133、CP006262)对应核苷酸片段同源性均高达99%以上。
3 结论与讨论
1)7株病鸽分离菌根据生化反应鉴定结果表明,该7株病鸽分离菌均为大肠杆菌。7株分离菌的菌落和形态染色特性也均与大肠杆菌相符合。
2)通过对7株分离菌进行“O”因子抗原血清型鉴定,7株肉鸽分离菌血清型其中5株为O2型,2株为O78型。这也与赵宝华[2]报道的肉鸽大肠杆菌血清型基本相符合。
3)本试验分离到的7株肉鸽大肠杆菌对头孢呋辛、头孢曲松、头孢噻肟、多粘菌素B 4种药物100%敏感,对头孢哌酮敏感率为85.7%,对庆大霉素、呋喃妥因敏感率均为71.4%,这可能由于上述7种药物没有或很少用于鸽病的临床治疗。对临床常见的药物氨苄西林、链霉素、丁胺卡那耐药率分别高达85.7%、71.4%和85.7%,对氟喹诺酮类药物诺氟沙星、环丙沙星、左氧氟沙星耐药率也都较高,分别为71.4%、57.1%和71.4%,这可能由于上述药物较多用于鸽病的临床治疗。由于鸽大肠杆菌耐药性的广泛存在,因此在鸽大肠杆菌病临床治疗中,通过药敏试验筛选高敏药物对发病鸽进行治疗,避免耐药性的产生具有较大的意义[3]。
4)本试验从7株分离菌中随机选取1株分离菌进行16SrDNA 439 bp基因片段PCR扩增及序列分析,结果表明,该株分离菌16SrDNA 407 bp核苷酸片段与GenBank中已知8株大肠杆菌对应核苷酸片段同源性均高达99%以上,进一步证实了所分离菌为鸽大肠杆菌[4]。
5)通过对7株分离细菌的一系列试验研究,探明了南京市肉乳鸽发病死亡的原因,针对发病情况对肉鸽养殖场提出了实行全进全出饲养、彻底消毒消灭病原的建议,并根据药敏试验结果选取有效药物用于治疗和预防,通过采取上述措施控制了肉乳鸽的发病死亡,取得了满意的治疗和预防效果。
[1] 邵慧君,张彬彬,王彦红,等.肉鸽大肠杆菌病的诊断[J].上海畜牧兽医通讯,2011(2):112
[2] 赵宝华,卜柱,徐步,等.肉鸽大肠杆菌的分离与鉴定[J].经济动物学报,2010,14(4):225-227
[3] 徐斌,张夏兰,何琴,等.乳鸽大肠杆菌的分离鉴定与药敏试验[J].畜牧与兽医,2013,45(9):123-124
[4] 钱琨,张永志,金文杰,等.致鹅卵黄性腹膜炎大肠杆菌的分离与16SrDNA的鉴定[J].中国家禽,2011,33(14):29-31
