非霍奇金淋巴瘤患者外周血单核细胞hepcidin可能导致慢性病贫血
2014-03-15周道斌段明辉赵永强武永吉
韩 潇,周道斌,段明辉,汪 玄,赵永强,沈 悌,武永吉
(中国医学科学院北京协和医学院北京协和医院血液内科,北京100730)
非霍奇金淋巴瘤(non-Hodkin lymphoma,NHL)常并发贫血,总体发生率约30%[1],贫血原因复杂,其中慢性病贫血(anemia of chronic disease,ACD)最常见,突出特点为铁利用障碍[2]。Hepcidin 是调节铁代谢的核心激素,其不恰当升高可导致铁利用障碍[2]。以往认为hepcidin 主要由肝脏分泌,但最近研究显示单核/巨噬细胞受到刺激后hepcidin 明显升高[3-4],对铁代谢发挥调节作用,可能参与ACD的发病[5]。多发性骨髓瘤(multiple myloma,MM)患者血清和尿中hepcidin 浓度均升高,可能导致MM相关ACD 的发生[6-7],而对于NHL 则缺乏此类报道。
本研究探讨NHL 患者外周血单核细胞表达的hepcidin 在肿瘤相关ACD 中可能发挥的作用以及其升高的机制。
1 实验方法
1.1 患者
患者签署知情同意书声明同意采取血标本用于科学研究,征得中国医学科学院北京协和医学院伦理委员会的同意。
本实验组中NHL 患者共61 人。中位年龄56岁(18 ~80 岁),初治者36 例,复治者25 例,Ⅲ/Ⅳ期患者占68.9%(42/61 例)。NHL 组患者贫血的总体发生率为57.4%(35/61 例),初治者38.9%(14/36 例),复治者72%(18/25 例)。总体血红蛋白浓度(113 ±21.7)g/L,贫血患者血红蛋白浓度(97.0 ±14.6)g/L(表1,2)。
入选标准:根据WHO 2008 非霍奇金淋巴瘤诊断标准,均在北京协和医院确诊。年龄≥18 岁,包括初治和复治患者。初治患者:明确诊断后尚未接受化疗。复治患者:确诊后已经接受至少2 程化疗。贫血定义:血红蛋白男性<120 g/L,女性<110 g/L。除外标准:近1 周内无活动性感染的证据,肾脏受累,肾功能不全(Cr >132 μmol/L),骨髓受累,胃肠道受累,胃肠道失血,溶血,脾功能亢进,淋巴瘤白血病,化疗后的骨髓抑制期(WBC<2 ×109/L),缺铁(血清铁蛋白<12 ng/mL),血清叶酸<3 ng/mL 或维生素B12<100 pg/mL。

表1 NHL 组与正常对照组特征比较Table 1 NHL patients baseline characteristics

表2 NHL 患者疾病相关特征Table 2 NHL patients and disease characteristics
正常对照组:共21 人,为健康志愿者。条件符合以下标准:1)年龄≥18 岁;2)无潜在感染,血清C反应蛋白正常;3)无特殊药物治疗史;4),血白细胞、血小板、血红蛋白、血清铁、总铁结合力、血清铁蛋白、转铁蛋白饱和度、血清叶酸、维生素B12、肝肾功能正常。
以上所有患者及健康志愿者均未接受补铁、重组人促红细胞生成素、和/或输血治疗。
收集患者及健康志愿者基础实验室指标(如血白细胞数,血红蛋白,丙氨酸氨基转移酶,血清铁指标),均为早晨空腹测得,采用临床常规检验自动化方法检测。
1.2 血标本的采集和单核细胞分离
早晨空腹状态下采取患者或健康志愿者的外周静脉血。血标本处理在采血后6 h 内进行。无抗凝剂的血标本3 000 ×g 离心5 min,血清-70 ℃保存,用于测定IL-6 和TNF-α,EDTA 抗凝血使用1∶1 0.9%氯化钠注射液稀释后采用Ficoll-Hyaque(Sigma Chemical Co.,St.Louis,MO)密度梯度离心的方法分离外周血单个核细胞(peripheral-blood mononuclear cells,PBMCs)。CD14 + Dynabeads 磁珠(Dynal,Oslo,Norway)从PBMCs 中分选单核细胞。磁珠与CD14 +单核细胞的混合物在磁架(MPC-6,Dynal)上分离得到,用含有0.1%胎牛血清蛋白的PBS 清洗细胞,并用磁架分离。Dynalbeads 系统分离所得的细胞纯度(>95%),免疫表型稳定。将结合在磁珠上的细胞直接加入TRIzol 裂解,用于进行基因表达分析。
1.3 Real-time PCR 实时定量法测定单核细胞mRNA 表达
采用Trizol Reagent(invitrogen,carlsbad,CA)按照操作说明从外周血单核细胞中提取总RNA,总RNA 按照invitrogen superscriptTMⅢfirst-strand synthesis system 进行反转录,得到cDNA。按照Takara Perfect Real time 试剂盒(Takara Biotechnology 公司)操作说明利用ABI PRISM 7900 Sequence Detector system (Applied Biosystems,Foster City,CA)进行实时定量PCR。β-actin 基因用作内对照。相对基因表达量(靶基因的表达量,相对于内对照)采用比较Ct 法的公式2-ΔΔCT计算。特异性引物序列其引物序列及扩增片段见表3。
1.4 ELISA 法测定血清IL-6,TNF-α 浓度
患者血清IL-6 和TNF-α 浓度采用酶联免疫吸附法试剂盒R&D(Quantikine HS ELISA Kit;Minneapolis,MN)。IL-6 灵敏度为0.04 pg/mL,TNF-α 的灵敏度为0.1 pg/mL。
1.5 统计学分析
所有数据处理均采用SPSS 16.0 for windows 软件包,计量资料以均值±标准差(±s)表示,正态分布数据采用独立样本t 检验,双尾(方差齐者用t检验,方差不齐者用校正t 检验),非正态分布者采用非参数检验(Mann-Whitney U 检验);双变量关系采用直线相关性分析,方差分析检验。
2 结果
2.1 患者与正常对照组单核细胞hepcidin 以及血清IL-6、TNF-α,单核细胞IL-6、TNF-α 的比较
NHL 组单核细胞hepcidin mRNA 表达高于正常对照组,单核细胞IL-6 mRNA 表达也升高;单核细胞TNF-α mRNA 表达与血清TNF-α 浓度均高于正常(图1)。
2.2 患者单核细胞hepcidin 与血红蛋白浓度的相关性
NHL 组单核细胞hepcidin mRNA 的表达与血红蛋白浓度似呈负相关的趋势,但无统计学相关性(图2)。

表3 引物序列及扩增片段Table 3 Primer sequences and amplified fragments
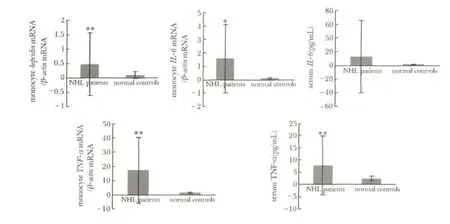
图1 NHL 患者、正常人、IDA 患者单核细胞hepcidin、IL-6、TNF-α mRNA 表达以及血清IL-6、TNF-α 浓度Fig 1 Monocytes hepcidin,IL-6,TNF-α mRNA expression and serum IL-6,TNF-α in NHL patients and normal controls(±s)

图2 NHL 患者单核细胞hepcidin 与血红蛋白浓度(Hb)的相关性Fig 2 Correlation between monocytes hepcidin mRNA and hemoglobin in NHL patients
2.3 初治患者与复治患者单核细胞hepcidin 与血红蛋白浓度的相关性
NHL 初治患者单核细胞hepcidin mRNA 的表达与血红蛋白浓度呈负相关(图3)。
2.4 初治患者贫血者与无贫血者单核细胞hepcidin 的比较
NHL 初治患者共36 例,其中贫血者14 例,无贫血者22 例。NHL 初治患者贫血者血红蛋白浓度为97.0 ±14.6 g/L,无贫血者血红蛋白浓度为130 ±13.1 g/L,初治NHL 贫血者单核细胞hepcidin mRNA 的表达高于无贫血者,同时也高于正常对照(图4)。
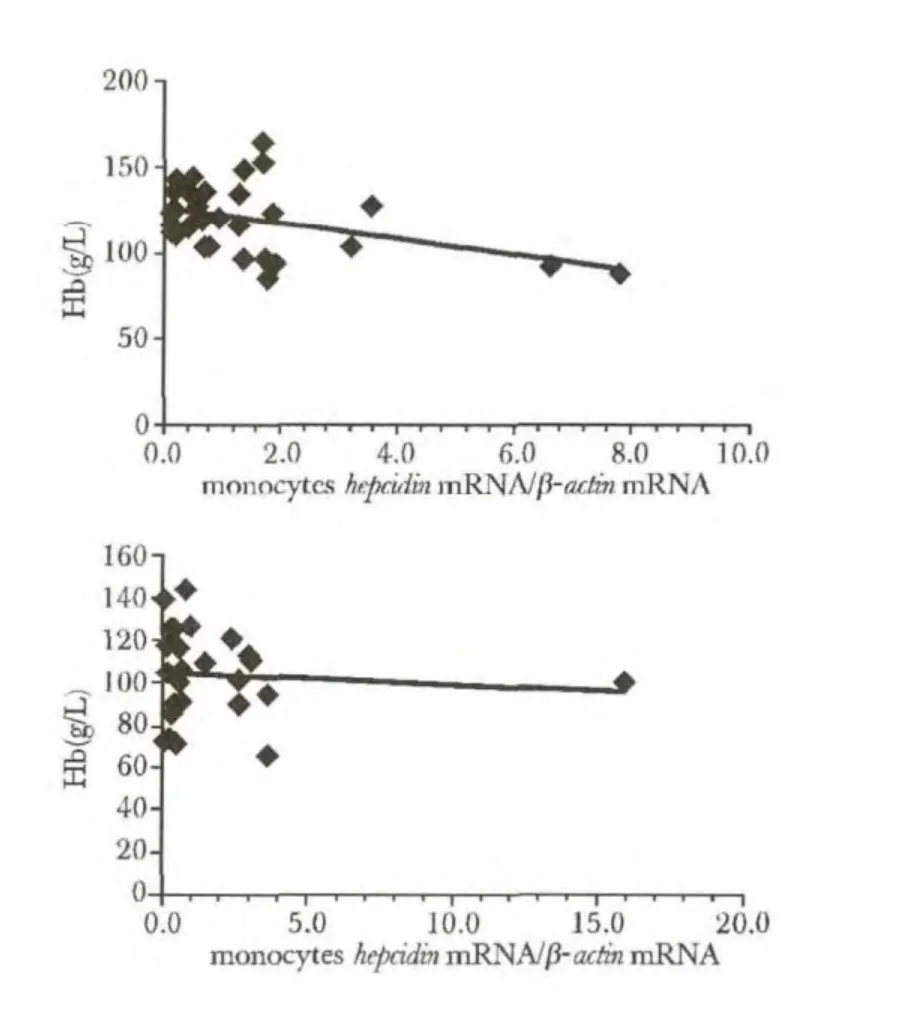
图3 NHL 初治患者与复治患者单核细胞hepcidin与血红蛋白浓度(Hb)的相关性Fig 3 Correlation between monocytes hepcidin mRNA and hemoglobin in untreated and treated NHL patients
2.5 初治患者单核细胞hepcidin 与铁代谢相关指标,血清IL-6、TNF-α 及单核细胞IL-6、TNF-α 的相关性
NHL 初治患者单核细胞hepcidin mRNA 的表达与与血清IL-6 浓度、单核细胞IL-6 mRNA 的表达呈正相关(图5)。

图4 初治NHL 贫血者、无贫血者及正常对照单核细胞hepcidin 的比较Fig 4 Monocytes hepcidin in untreated NHL patients with anemia and without animia and normal controls
2.6 初治患者单核细胞IL-6、TNF-α 与血清IL-6、TNF-α 的相关性
NHL 初治患者单核细胞IL-6 mRNA 的表达与血清IL-6 浓度呈正相关,单核细胞TNF-α mRNA 的表达与血清TNF-α 浓度呈正相关(图6)。
2.7 初治患者单核细胞hepcidin 与CRP 及LDH的相关性
初治NHL 患者单核细胞hepcidin mRNA 的表达与血清CRP 及LDH 均呈正相关(图7)。
3 讨论
ACD 尚无统一的诊断标准,主要依靠铁代谢指标及除外其他疾病诊断[2]。本研究NHL 患者中发生贫血者,主要为轻到中度正细胞正色素性贫血,铁蛋白升高,SI 和TIBC 下降,同时入组时已除外如骨髓受累,脾亢等其他原因导致的贫血,大致符合ACD 的诊断。
hepcidin 主要由肝脏合成和分泌[8],但最近发现单核/巨噬细胞在炎性反应刺激下也可高表达hepcidin[4-5]。慢性感染或自身免疫病相关的ACD患者外周血单核细胞hepcidin mRNA 的表达升高,可能参与铁代谢调节[9]。NHL 患者外周血单核细胞hepcidin 是否升高,是否与Hb 水平、铁代谢相关蛋白、体内炎性因子等有关,尚不清楚。

图5 NHL 初治患者单核细胞hepcidin 与SF、TSAT%、血清及单核细胞IL-6、血清及单核细胞TNF-α 的相关性Fig 5 Correlation between monocytes hepcidin mRNA and SF,TSAT%,serum/monocytes IL-6,serum/monocytes TNF-α in untreated NHL patients
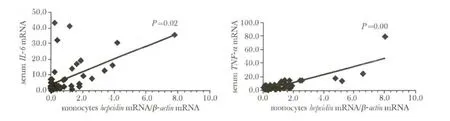
图6 NHL 初治患者单核细胞IL-6、TNF-α 与血清IL-6、TNF-α 的相关性Fig 6 Correlation between monocytes IL-6 mRNA and serum IL-6,monocytes TNF-α and serum TNF-α in untreated NHL patients

图7 NHL 初治患者单核细胞hepcidin mRNA 与血清CRP、LDH 的相关性Fig 7 Correlation between monocytes hepcidin mRNA and serum CRP/LDH in untreated NHL patients
本研究发现外周血单核细胞hepcidin 在NHL患者中明显升高,且在初治患者中与Hb 负相关,初治患者中贫血者高于无贫血者,可见NHL 初治患者Hb 水平可能受hepcidin 的影响。但复治患者外周血单核细胞hepcidin 与Hb 水平无关联,研究显示NHL 患者贫血累计发生率随化疗次数增加而升高[9],此外一些细胞毒药物可直接抑制红系干/祖细胞,缩短红细胞寿命[10],由此推测复治患者发生贫血的主要因素是化疗药物而非hepcidin。
hepcidin 是调节铁在不同铁池中分布的核心激素,可引起铁在网状内皮系统的储留和低铁血症[11],本组初治患者中发生贫血者单核细胞hepcidin mRNA 的表达高于无贫血者,同时铁代谢指标提示铁相对缺乏,提示NHL 相关ACD 的发病机制可能与体内hepcidin 升高引起铁利用障碍有关。
IL-6 是诱导hepcidin 升高的主要炎性细胞因子[12-13],TNF-α 对hepcidin 的诱导作用微弱[14]。MM 初治患者尿hepcidin 与血清IL-6 浓度正相关而与TNF-α 无关[7],本研究中NHL 初治患者单核细胞hepcidin 与血清IL-6 浓度正相关而与TNF-α 无关,由此看来,淋巴瘤患者体内的hepcidin 可能也主要受IL-6 影响,而非TNF-α。此外,本研究还显示单核细胞IL-6 与自身hepcidin 正相关,因此推测单核细胞分泌的IL-6 可能对自身hepcidin 有上调作用。
最后,本研究还显示NHL 初治患者单核细胞hepcidin 与LDH 及CRP 明显相关,由于血清及尿hepcidin 检测未常规开展,LDH 和CRP 均为常规检测指标,可能协助判断体内hepcidin 水平。
本实验虽然显示NHL 患者体内单核细胞hepcidin 与贫血、铁蛋白、IL-6 等相关,但未能证实其在ACD 中的具体机制,未测定单核细胞hepcidin 蛋白,此外正常对照选择青年可能低估正常人群单核细胞hepcidin 水平[15]。
[1]Moullet I,Salles G,Ketterer N,et al.Frequency and significance of anemia in non-Hodgkin's lymphoma patients[J].Ann Oncol,1998,9:1109-1115.
[2]Weiss G,Goodnough LT.Anemia of chronic disease[J].N Engl J Med,2005,352:1011-1023.
[3]Liu X,Xie W,Liu P,et al.Mechanism of the cardioprotection of rhEPO pretreatment on suppressing the inflammatory response in ischemia-reperfusion[J].Life Sci,2006,78:2255-2264.
[4]Peyssonnaux C,Zinkernagel AS,Datta V,et al.TLR4-dependent hepcidin expression by myeloid cells in response to bacterial pathogens[J].Blood,2006,107:3727-3732.
[5]Theurl I,Theurl M,Seifert M,et al.Autocrine formation of hepcidin induces iron retention in human monocytes[J].Blood,2008,111:2392-2399.
[6]Ganz T,Olbina G,Girelli D,et al.Immunoassay for human serum hepcidin[J].Blood 2008,112:4292-4297.
[7]Sharma S,Nemeth E,Chen YH,et al.Involvement of hepcidin in the anemia of multiple myeloma[J].Clin Cancer Res,2008,14:3262-3267.
[8]Park CH,Valore EV,Waring AJ,et al.Hepcidin,a urinary antimicrobial peptide synthesized in the liver[J].J Biol Chem,2001,276:7806-7810.
[9]Birgegard G,Gascon P,Ludwig H.Evaluation of anaemia in patients with multiple myeloma and lymphoma:findings of the European CANCER ANAEMIA SURVEY[J].Eur J Haematol,2006,77:378-386.
[10]Volpe DA,Warren MK.Myeloid clonogenic assays for comparison of the in vitro toxicity of alkylating agents[J].Toxicol in vitro,2003,17:271-277.
[11]Domenico ID,Ward DM,Langelier C,et al.The molecular mechanism of hepcidin-mediated ferroportin down-regulation[J].Mol Biol Cell,2007,18:2569-2578.
[12]Nemeth E,Rivera S,Gabayan V,et al.IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin[J].J Clin Invest,2004,113:1271-1276.
[13]Liu XB,Nguyen NB,Marquess KD,et al.Regulation of hepcidin and ferroportin expression by lipopolysaccharide in splenic macrophages[J].Blood Cells Mol Dis,2005,35:47-56.
[14]Nemeth E,Valore EV,Territo M,et al.Hepcidin,a putative mediator of anemia of inflammation,is a type II acute-phase protein[J].Blood,2003,101:2461-2463.
[15]Eisenstaedt R,Penninx BW,Woodman RC.Anemia in the elderly:current understanding and emerging concepts[J].Blood Rev,2006,20:213-226.
