1例高胰岛素高血氨综合征诊断与治疗随访
2014-03-15肖新华童安莉邱正庆
陈 适,肖新华*,童安莉,王 鸥,于 康,邱正庆
(中国医学科学院北京协和医学院北京协和医院
1.卫生部内分泌重点实验室内分泌科;2.营养科;3.儿科,北京100730)
高胰岛素/高血氨综合征(hyperinsulinism/hyperammonaemia syndrome,HI/HA)是一种罕见的先天性低血糖的原因,临床表现为进食含亮氨酸食物后的高胰岛素、低血糖以及持续性高氨血症等,1996年首次报道[1],发病与谷氨酸脱氢酶(glutamate dehydrogenase,GDH)基因突变有关,本文报道1 例高胰岛素/高血氨综合征,利用蛋白质负荷实验辅助诊断,采用蛋白质剂量选择实验指导治疗,在饮食治疗基础上,加用二氮嗪治疗,并随访5年,观察疗效,并复习相关文献,以期提高临床医师对高胰岛素/高血氨综合征这种罕见病例的诊断和治疗认识。
1 材料与方法
1.1 研究对象
2007年12月北京协和医院诊治的高胰岛素/高血氨综合征1 例。患者来自美国,8 岁7 个月男童,1999-05-20 足月顺产。出生体质量3 kg,生后6个月始规律添加辅食,1 岁后常于下午3 ~4 点出现哭闹不止,伴四肢肌束颤动,意识丧失,予静脉点滴含葡萄糖液体10 min 后症状可缓解。2000 ~2001年每日均出现类似症状。2001 ~2004年,每日加喂糖水200 ~400 mL,每年仅发作1 ~2 次。患儿曾于食用鸡蛋羹,比萨饼或进食大量鲑鱼后出现上述症状。否认家族类似疾病史。入院查体:血压:90/50 mmHg(1 mmHg=0.133 KPa),体质量:25 kg(为同年龄男童体质量第10 百分位),身高:123 cm(为同年龄男童身高第25 百分位),体形消瘦,全身浅表淋巴结未触及肿大。甲状腺无肿大,心肺腹查体无异常,双下肢不肿。入院后仍有类似发作,详细记录患者发作和未发作日食谱。
1.2 方法
1.2.1 实验室检查:肝肾功能、血电解质、血氨、血糖等均用全自动生化分析仪测量。血胰岛素,血三碘甲状腺原氨酸(T3)、甲状腺素(T4)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺素激素(TSH),促肾上腺皮质激素(ACTH)均采用化学发光法测定,食物热量和成分计算源自北京大学医学出版社出版的《中国食物成分表2002》。
1.2.2 蛋白质、碳水化合物和脂肪负荷实验:分别设计3 种营养素的负荷实验,蛋白质负荷实验选用红皮鸡蛋50 g、干酪10 g、酱牛肉50 g 混合为实验餐,其热量为233.8 kcal,亮氨酸含量为90 mg/千克体质量(kg·body·weight,kg·BW);碳水化合物负荷实验选用馒头100 g 为实验餐,其热量为233 kcal;脂肪负荷实验选用人造黄油26 g 为实验餐,其热量为234 kcal。患者夜间休息后,于上午8点空腹取血,测血葡萄糖,血胰岛素和血氨,后进食实验餐,于进餐后0.5、1、2 和3 h 分别抽取血糖,血胰岛素和血氨,出现低血糖症状提前中止实验。
1.3 蛋白质剂量选择实验
分别设计不同含量的亮氨酸含量下的蛋白质负荷实验,以期寻找到对患儿最适的蛋白质摄入剂量,指导下一步治疗。分别以果料酸奶250 mL+酱牛肉10 g(热量为192.1 kcal,亮氨酸含量为35.0 mg/kg BW),果料酸奶125 mL + 酱牛肉5 g(热量为96.1 kcal,亮氨酸含量为17.5 mg/kg BW)和果料酸奶125 mL+酱牛肉5 g +50 g 馒头(热量为212.6 kcal,亮氨酸含量为17.5 mg/kg BW)为试餐。患者夜间休息后,于上午8 点空腹取血,测血葡萄糖,血胰岛素和血氨,后进食实验餐,于进餐后0.5、1、2 和3 h 分别留取指血血糖,出现低血糖症状提前中止实验。
1.4 基因测序
取得患者家属知情同意后,分离患者全血DNA,采用PCR 方法扩增患儿谷氨酸脱氢酶基因13个外显子,并直接测序,同正常基因序列进行比对。
1.5 随访
出院后通过网络、电话等方式联系,随访观察患者饮食、运动、药物使用情况和症状发作情况。
2 结果
2.1 常规检查结果
血、尿、便常规、肝肾功能及血电解质均正常。垂体前叶功能检查:ACTH:12.4(<46)pg/mL。血甲状腺功能:T3:1.77(0.66 ~1.92)ng/mL,T4:7.98(4.3 ~12.5)μg/dl,FT3:3.51(1.8 ~4.1)pg/mL,FT4:1.41(0.81 ~1.89)ng/dl,TSH:2.846(0.38 ~4.34)μIU/mL。抗胰岛细胞抗体、抗谷氨酸脱羧酶抗体、胰岛自身抗体,均阴性。胰腺动脉灌注CT:未见占位。
2.2 症状发作时的血糖、血胰岛素和血氨情况
入院后发作两次低血糖症状,表现为餐后2 h,嘴角抽动,精神萎靡,无呼吸困难,无恶心、呕吐及腹泻。查体:双手出汗。发作时留取患儿血糖、血胰岛素和血氨标本;于未发作时留取患儿血糖、血胰岛素和血氨标本作为对照,观察到该患儿存在高氨血症,其低血糖与胰岛素异常释放有关(表1)。
2.3 蛋白质、碳水化合物、脂肪负荷实验结果
蛋白质负荷实验结果(表2),患儿于服蛋白质试餐75 min 时出现口唇抽动,查血糖1.8 mmol/L,终止实验。进食2 两馒头和50 mL 果汁,30 min 后症状未消失,查血糖2.1 mmol/L,予静脉推50%葡萄糖2 0mL 后症状缓解。碳水化合物负荷实验和脂肪负荷实验时服试餐3 h 内均未出现上述症状,碳水化合物负荷实验时血糖波动在3.4 ~5.3 mmol/L,血氨波动在101.6 ~126 μmol/L;脂肪负荷实验时血糖波动在3.2 ~3.6 mmol/L,血氨波动在69.5 ~136.5 μmol/L。
2.4 蛋白质剂量选择实验结果
蛋白质剂量选择实验结果(表3),观察到单纯服用含亮氨酸食物可引起患者低血糖发作,但随亮氨酸摄入减少,发作症状略减轻。当蛋白质和碳水化合物的热量比例约为1∶1(96 kcal∶117 kcal)且低亮氨酸饮食时可以防止低血糖症状的出现。
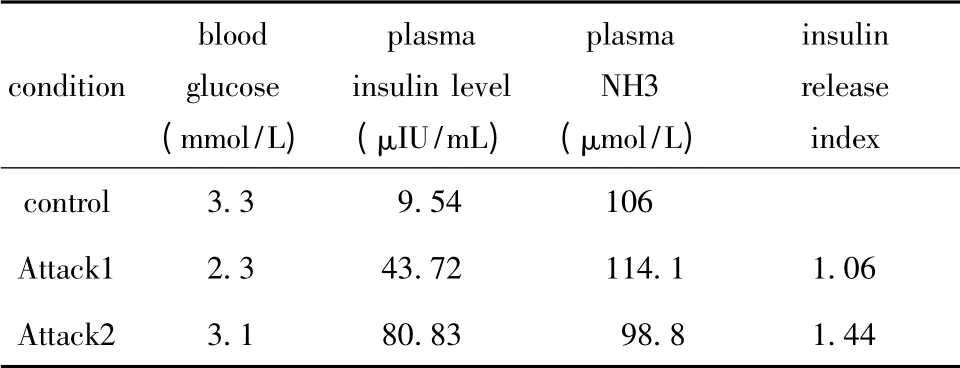
表1 患儿发作时的胰岛素、血糖和血氨情况Table 1 The plasma insulin,glucose and NH3 in the episode of the patient

表2 口服蛋白质负荷实验Table 2 Oral protein tolerance test

表3 蛋白质剂量选择实验结果Table 3 Oral protein dose choice test (blood glucose mmol/L)
2.5 基因测序结果
对文献报道的正常基因序列相比,直接DNA 测序提示患者谷氨酸脱氢酶基因第7 外显子978 位G >A 杂合突变,该突变2001年曾报道,能导致谷氨酸脱氢酶组成中第269 位精氨酸被组氨酸取代,引起谷氨酸脱氢酶激活性突变[2](图1)。
2.6 治疗和随诊
2007年12月出院后随诊至今。出院后1年患者食用低亮氨酸含量的蛋白质和碳水化合物混合食物,1年内偶有2 ~3 次口角抽动出现,但很快即可恢复正常,无意识丧失。2010年,在饮食治疗的基础上,加用二氮嗪(PROGLYCEM® suspension)1 mL,50 mg 每日二次治疗,服药后再未出现上述症状发作,多次测空腹血糖在5 ~6 mmol/L。2012年7月末次随访,患者13 岁,身高151 cm(为同年龄同性别儿童第19 百分位),37 kg(为同年龄同性别儿童第10 百分位),2011 至2012年身高增长12 cm。

图1 患者GDH 基因第7 外显子存在杂合突变c.978G >A(R269H)Fig 1 The molecular genetic analysis of this patient revealed the heterozygous mutation c.978G >A(R269H)in exon 7 of GDH gene compared to the control
3 讨论
本例患儿表现为交感神经兴奋症状和中枢神经受抑制表现,且发作时血糖低于2.8 mmol/L,可诊断低血糖症。收入我院后,观察到本例患儿血糖水平降低时血胰岛素水平明显升高,提示高胰岛素血症是低血糖症的原因。对病史的进一步了解提示,该患儿常于进食蛋白质类食物后发作类似症状,故设计了三大营养素蛋白质、脂肪和碳水化合物对照实验,观察到蛋白质类型食物可诱发低血糖症状。此外,还观察到该患者无论发作低血糖与否,其血氨水平持续较高,基因测序结果提示谷氨酸脱氢酶基因突变,结合上述临床表现、实验室检查结果和基因测序结果,故考虑诊断高胰岛素/高血氨综合征。
高胰岛素/高血氨综合征是一种罕见的先天性低血糖的原因,1996年首次为报道。1998年进一步的研究观察到该疾病和谷氨酸脱氢酶基因激活性突变有关[3],本病为常染色体显性遗传,常于进食含亮氨酸后蛋白质出现中度低血糖和高血氨。其病理生理机制(图2)[4]。
曾有研究用含每100 mg/kg BW 的亮氨酸的鸡蛋和奶酪作为试餐,观察了进食试餐后3 h 内高胰岛素/高血氨综合征患者的胰岛素分泌情况。他观察到在进食试餐30 min 后,患者血胰岛素水平明显增高,血糖明显降低[5]。本研究进一步对比了该患者对蛋白质、碳水化合物、脂肪的反应,观察到该患者进食含每千克体质量90mg 亮氨酸的蛋白质后,血胰岛素水平明显增高,血糖水平明显降低,且出现低血糖反应,而进食相同热量的碳水化合物和脂肪后,该患者的血糖和胰岛素水平却未见上述变化,说明含亮氨酸的蛋白质能诱发患者低血糖发作。进一步的蛋白质剂量选择实验观察到当患者摄入的蛋白质中亮氨酸含量递减时,虽然患者仍发作低血糖,但随着剂量的递减,其症状也渐轻,低血糖的程度也渐减轻,说明亮氨酸可能剂量依赖性的刺激了胰岛素分泌。

图2 高胰岛素高血氨综合征的病理生理学机制Fig 2 The physiopathologic mechanism of hyperinsulinism/hyperammonaemia syndrome
曾有研究报道GTP 结合位点(第6 和第7 外显子)突变的高胰岛素/高血氨综合征患者存在癫痫的现象[6],该患者基因突变位于第7 外显子,这可能是其被误诊为癫痫的原因之一。
本例患者观察到蛋白质和碳水化合物的混合配餐即可避免该患者低血糖发作,提示对高胰岛素/高血氨综合征的治疗可以选择蛋白质和碳水化合物的合理混合配餐。1年的单纯饮食治疗观察,患者仅偶出现低血糖发作,说明合理的饮食治疗可减少低血糖症状出现。二氮嗪能激活ATP 敏感的钾通道,抑制胰岛β 细胞分泌胰岛素。因为高胰岛素/高血氨综合征为GDH 基因激活性突变导致胰岛β 细胞内ATP 增加,故二氮嗪能有效治疗[7]。该患者在饮食+二氮嗪治疗后,低血糖即不再出现,且生长发育可,提示饮食+二氮嗪治疗是本病的较好治疗方法。
综上所述,高胰岛素/高血氨综合征是一种罕见的先天性低血糖的原因,蛋白质负荷实验可作为其诊断的方法之一。蛋白质和碳水化合物的混合配餐可以作为其治疗的基础,并有效的避免其低血糖发作。
[1]Zammarchi E,Filippi L,Novembre E,et al.Biochemical eval-uation of a patient with a familial form of leucine-sensitive hypoglycemia and concomitant hyperammonemia[J].Metabolism,1996,45:957-960.
[2]Santer R,Kinner M,Passarge M.Novel missense mutations outside the allosteric domain of glutamate dehydrogenase are prevalent in European patients with the congenital hyperinsulinism-hyperammonemia syndrome[J].Hum Genet,2001,108:66-71.
[3]Stanley CA,Lieu YK,Hsu BY,et al.Hyperinsulinism and hyperammonemia in infants with regulatory mutations of the glutamate dehydrogenase gene[J].N Engl J Med,1998,338:1352-1357.
[4]Balasubramaniam S,Kapoor R,Yeow JH J.Biochemical evaluation of an infant with hypoglycemia resulting from a novel de novo mutation of the GLUD1 gene and hyperinsulinism-hyperammonemia syndrome[J].Pediatr Endocrinol Metab,2011,24:573-577.
[5]Toriumi Y,Murata K,Taketani T,et al.A case of hyperinsulinism/ hyperammonaemia syndrome:usefulness of the oral protein tolerance for the evaluation of treatment[J].Eur J Pediatr,2005,164:182-183
[6]Bahi-Buisson N,Roze E,Dionisi C,et al.Neurological aspects of hyperinsulinism-hyperammonaemia syndrome[J].Dev Med Child Neurol,2008,50:945-949.
[7]Palladino AA,Stanley CA.The hyperinsulinism/hyperammonemia syndrome[J].Rev Endocr Metab Disord,2010,11:171-178.
