敲低Txnip抑制高糖诱导的人肾小管细胞系凋亡
2014-03-15韦金英史永红任韫卓侯延娟杜春阳张连珊段惠军
韦金英,史永红,任韫卓,侯延娟,杜春阳,张连珊,段惠军
(河北医科大学病理学教研室,河北石家庄050017)
研究表明,高糖诱导的肾小管上皮细胞凋亡是导致糖尿病肾病(diabetic nephropathy,DN)的一个主要机制。高血糖引起的活性氧(reactive oxygen species,ROS)产生对DN 的发展具有至关重要的作用[1],ROS产生的主要部位是线粒体,在糖尿病血管并发症中发挥重要作用[2]。以往的研究显示硫氧化蛋白相互作用蛋白(thioredoxin interacting protein,Txnip)参与了高糖(high glucose,HG)诱导胰岛β 细胞凋亡[3]。前期实验研究也发现敲低Txnip表达抑制高糖诱导的小鼠系膜细胞凋亡是通过线粒体途径实现的,且与P38MAPK 信号的活化密切相关[4]。Txnip 可能在氧化应激造成肾损伤过程中发挥关键性调节作用,减少糖尿病肾脏Txnip 的水平可能成为治疗糖尿病肾损伤的有效靶点。因此,本实验旨在观察Txnip 与高糖状态下肾小管细胞凋亡的关系以及相关作用机制。
1 材料与方法
1.1 材料
人肾小管细胞HK-2(美国标准生物品收藏中心)。兔抗Txnip、cleaved caspase-3、P38 MAPK、P-P38 MAPK(Cell signaling 公司)。小鼠抗BAX 单克隆抗体(P-19),兔抗BCL-2、caspase-3 和细胞色素c 多克隆抗体以及pro-light HRP 化学发光检测试剂(Tingen biotech 公司)。TUNEL 试剂盒(Promega 公司)。
1.2 方法
1.2.1 细胞培养和分组刺激实验:常规培养细胞,待HK-2 细胞达75% ~85%汇合后,用无血清培养基同步24 h。分成4 组:正常糖组(5.6 mmol/L 葡萄糖,NG);高糖组(30 mmol/L 葡萄糖,HG),高糖+质粒载体对照组(control shRNA Plasmid,HG+C),高糖+VDUP1 shRNA Plasmid 组(HG +shRNA)。于刺激48 h 后收集细胞观察。
1.2.2 末端脱氧核苷酸转移酶介导dUTP 缺口标记法(TUNEL)检测细胞凋亡:细胞接种于8 孔Lab-Tek® 腔室玻片上,分组刺激48 h。DeadEndTM荧光TUNEL 系统检测细胞凋亡。荧光显微镜下计数每个高倍视野中阳性染色细胞数和总细胞数,计算阳性细胞百分比。
1.2.3 Western 印迹检测:加入细胞裂解液,冰浴2 h,4 ℃、12 000 r/min 离心20 min,Lowry 法测定上清液蛋白浓度。按照Huang 等[5]所述方法分离线粒体和不含线粒体的胞质蛋白,本次实验使用不含线粒体胞质蛋白。经十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳后电转移至PVDF 膜;质量分数0.05 的脱脂奶粉封闭PVDF 膜2 h,分别加入caspase-3、cleaved caspase-3、P38 MAPK、P-P38 MAPK、BAX、BCL-2 以及细胞色素c 抗体,4 ℃过夜,洗膜后加辣根过氧化物酶标记的羊抗小鼠或兔抗体(1∶4 000稀释),37 ℃孵育2 h;洗膜后加ECL试剂,ODYSSEY 远红外双色荧光成像系统显影(LI.COR Gene Company,USA 奥德赛公司)。用美国UVP 公司LabWorks 4.5 分析系统软件对Western 条带进行定量分析。
1.2.4 荧光实时定量PCR 检测Txnip、BAX 和BCL-2 表达变化:Trizol 法提取细胞总RNA,进行反转录。荧光实时定量PCR 采用20 μL 反应体系,
SYBR Premix Ex TaqTMⅡ(2 ×)10 μL,ROX Reference Dye(50 ×)0.4 μL,反转录产物2 μL,上、下游引物(终浓度为1 ng/mL)各0.8 μL,双蒸水6 μL。反应条件为:95 ℃30 s →95 ℃5 s→55 ℃30 s→72 ℃30 s 共40 个循环。根据比较法计算基因表达相对量,采用公式2-ΔΔCt计算基因表达的相对倍数变化。引物序列(表1)。

表1 实时定量PCR 引物列表Table 1 Primer sequences used for RT-PCR and Real-time PCR analysis
1.2.5 流式细胞术(FCM)检测细胞内ROS:使用荧光探针5-(6)-羧基-2,7-二氯荧光素(CM-DCHFDA,Invitrogen)检测细胞内ROS 含量。HK-2 分组刺激48 h,最后加入含10 umol/L DCHF-DA 的染液,37°C 避光孵育30 min,PBS 洗涤,胰蛋白酶消化,悬浮于PBS 中,流式细胞仪检测。
1.3 统计学分析
2 结果
2.1 敲低Txnip 对高糖诱导的肾小管上皮Txnip的影响
与NG 组相比,HK-2 细胞Txnip 显著增加(P<0.01);与HG 组相比,敲低Txnip 能够显著减少高糖诱导的Txnip 表达(P<0.05)(表2)。
2.2 敲低Txnip 对高糖诱导的肾小管上皮细胞凋亡的影响
与NG 组相比,在高糖刺激48 h,HK-2 凋亡细胞数显著增加(P<0.01);与HG 组相比,敲低Txnip能够显著减少高糖诱导的细胞凋亡数(P<0.05)(图1)。

表2 敲低Txnip 对HG 诱导的人肾小管上皮细胞Txnip蛋白表达及Txnip mRNA 的影响Table 2 Effect of Txnip interference on Txnip in HK-2(n=6)
2.3 敲低Txnip 对高糖诱导的小管上皮细胞凋亡相关指标影响
与NG 组相比,HG 糖组cleaved caspase-3 表达和BAX/BCL-2 比率显著增加(P<0.01);敲低Txnip能够显著抑制HG 诱导的cleaved caspase-3 表达和BAX/BCL-2 比率(P<0.05)(图2,表3)。
2.4 敲低Txnip 对HG 诱导的小管上皮线粒体细胞色素c 释放的影响
与正常糖对照组相比,高糖组胞质中的细胞色素c 水平明显增加(P<0.01);与高糖组相比,Txnip敲低组细胞胞质中细胞色素c 水平明显降低(P<0.05)(图3)。质粒载体对照组与正常对照组相比,胞质中细胞色素c 水平无明显差异。
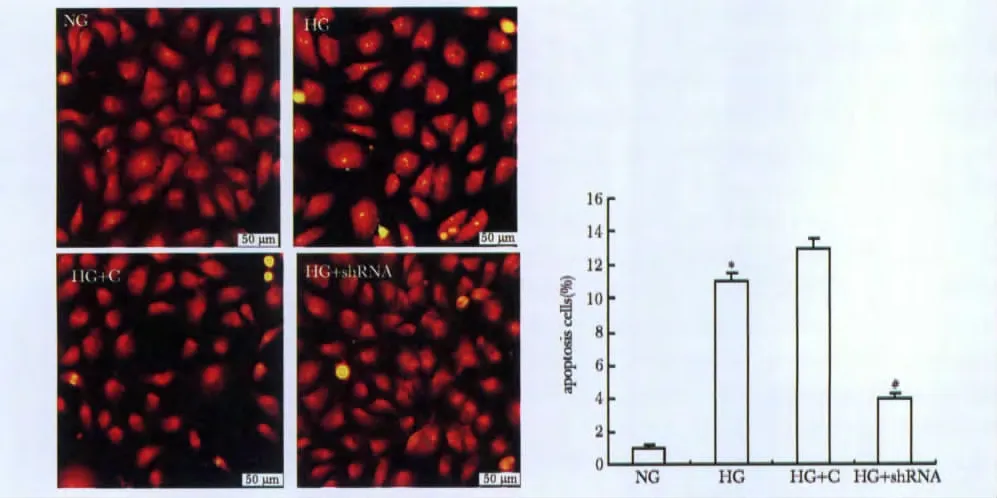
图1 原位缺口末端标记法(TUNEL)检测敲低Txnip 对HG 诱导的人肾小管上皮细胞凋亡的影响Fig 1 Effect of Txnip interference on HG-induced apoptosis of HK-2 is analyzed by TUNEL(n=6)(×200)
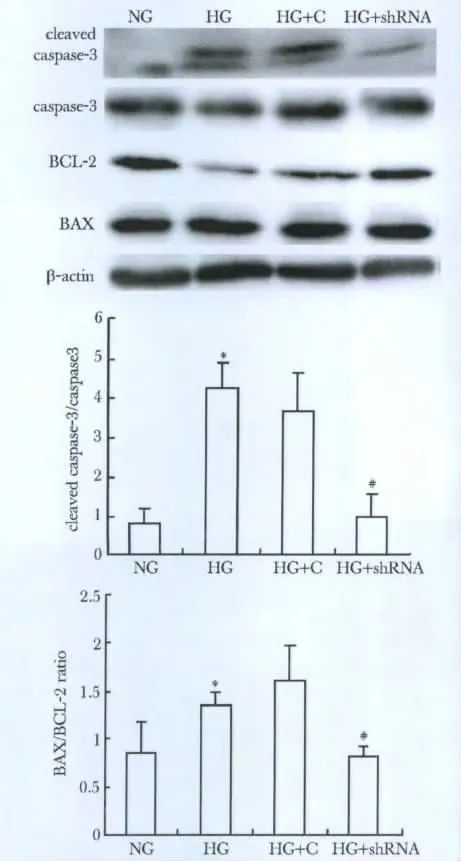
图2 敲低Txnip 对HG 诱导人肾小管上皮细胞cleaved caspase-3、BAX 和BCL-2 蛋白表达影响Fig 2 Effect of Txnip interference on activation of caspase-3 and expression of BAX and BCL-2 in HK-2(n=6)

表3 敲低Txnip 对HG 诱导的人肾小管上皮细胞BCL-2 mRNA、BAX mRNA 表达的影响Table 3 Effect of Txnip interference on BCL-2 and BAX mRNA in HK-2(n=6)

图3 敲低Txnip 对HG 诱导的人肾小管上皮细胞线粒体细胞色素C 释放的影响Fig 3 Effect of Txnip interference on the release of cytochrome c from mitochondria to cytoplasm in HK-2(n=6)
2.5 敲低Txnip 对HG 诱导的小管上皮细胞ROS产生的影响
与正常糖对照组相比,高糖组HK-2 细胞ROS产生显著升高(P<0.01);Txnip 敲低组细胞ROS表达明显低于高糖组(P<0.05)(图4)。质粒载体对照组与正常对照组相比,ROS 水平无明显差别。
2.6 敲低Txnip 对HG 诱导小管上皮细胞P38 MAPK 激活的影响
与NG 组相比,HG 组P38 MAPK 的磷酸化水平明显升高(P<0.01);与高糖组相比,Txnip 敲低组P38 MAPK 磷酸化水平明显降低(P<0.05)(图5)。
3 讨论
既往研究提示ROS 对细胞内级联反应起着调节作用,ROS 的过量生成导致了氧化应激、细胞功能丧失及细胞凋亡。在糖尿病时,肾脏存在大量ROS 的蓄积,破坏了肾脏组织内氧化还原动态平衡,造成肾组织氧化应激状态,参与肾损伤发生与发展。最近研究显示高糖环境会导致肾脏近端小管细胞线粒体超氧化物生成增多,因此,调节糖尿病肾脏氧化应激状态有可能成为有效的治疗糖尿病肾病的靶点。Txnip 又称维生素D3 上调蛋白1(VDUP-1)或Trx结合蛋白2(TBP-2),能够与Trx 的活性位点上的半胱氨酸残基结合而抑制其活性,改变细胞的氧化还原状态,诱导氧化应激。Txnip 缺乏肾小球系膜细胞阻断高糖诱导的氧化应激是通过影响TCA循环与糖酵解葡萄糖流量控制ROS 产生[6]。最近研究也证实,抗氧化剂tempol 以及敲低Txnip 表达均能够抑制高糖诱导的系膜细胞凋亡[4]。本研究结果显示,敲低Txnip 能够抑制HG 诱导的HK-2细胞内ROS 产生,同时抑制细胞凋亡增加,cleaved caspase-3 表达和BAX/BCL-2 比率升高以及促使细胞色素c 从线粒体释放入胞质。这些结果表明,敲低Txnip 抑制HG 诱导的小管上皮细胞凋亡可能是通过减少ROS 和保护线粒体功能实现的。以上提示,高浓度葡萄糖诱导的HK-2 细胞凋亡和ROS 产生密切相关。


P38 蛋白激酶为丝氨酸/苏氨酸激酶家族成员,是一个重要的信号分子。研究表明,P38 MAPK 信号通路可能与DN 有关[7-9]。前期研究也表明,采用SB203580 阻断P38 MAPK 通路能够明显抑制HG诱导的系膜细胞凋亡,cleaved caspase-3 表达和BAX/BCL-2 比率[4]。以上说明,P38 MAPK 信号通路可能与HK-2 细胞凋亡密切相关。本研究中发现,敲低Txnip 能够显著抑制HG 诱导的P38 MAPK的活化,提示敲低Txnip 抑制HG 诱导的HK-2 凋亡可能部分是通过调节P38 MAPK 通路活化实现的。综上所述,敲低Txnip 能够抑制高糖诱导的肾小管上皮细胞HK-2 的凋亡,这种作用可能是通过减少ROS 产生,保护线粒体功能以及抑制P38MAPK 信号通路的活化实现的。因此,推测Txnip 可能是一个潜在的糖尿病肾病治疗靶点。
[1]Devi TS,Hosoya K,Terasaki T,et al.Critical role of TXNIP in oxidative stress,DNA damage and retinal pericyte apoptosis under high glucose:implications for diabetic retinopathy[J].Exp Cell Res,2013,319:1001-1012.
[2]Kanwar YS,Wada J,Sun L,et al.Diabetic nephropathy:mechanisms of renal disease progression[J].Exp Biol Med(Maywood),2008,233:4-11.
[3]Chen J,Saxena G,Mungrue IN,et al.Thioredoxin-interacting protein:a critical link between glucose toxicity and beta-cell apoptosis[J].Diabetes,2008,57:938-944.
[4]Shi Y,Ren Y,Zhao L,et al.Knockdown of thioredoxin interacting protein attenuates high glucose-induced apoptosis and activation of ASK1 in mouse mesangial cells[J].FEBS Lett,2011,585:1789-1795.
[5]Huang JS,Chuang LY,Guh JY,et al.Antioxidants attenuate high glucose-induced hypertrophic growth in renal tubular epithelial cells[J].Am J Physiol Renal Physiol,2007,293:1072-1082.
[6]Shah A,Xia L,Goldberg H,et al.Thioredoxin-interacting protein mediates high glucose-induced reactive oxygen species generation by mitochondria and the NADPH oxidase,Nox4,in mesangia cells[J].J Biol Chem,2013,288:6835-6848.
[7]Fang Y,Tian X,Bai S,et al.Autologous transplantation of adipose-derived mesenchymal stem cells ameliorates streptozotocin-induced diabetic nephropathy in rats by inhibiting oxidative stress,pro-inflammatory cytokines and the P38 MAPK signaling pathway[J].Int J Mol Med,2012,30:85-92.
[8]Lv ZM,Wang Q,Wan Q,et al.The role of the P38 MAPK signaling pathway in high glucose-induced epithelial-mesenchymal transition of cultured human renal tubular epithelial cells[J].PLoS One,2011,6:e22806.doi:10.
[9]王臻,陆利民.糖代谢紊乱致肾小球内皮细胞损伤机制进展[J].基础医学与临床,2012,32:1360-1363.
