敲减水通道蛋白1对小鼠雪旺细胞形态及水转运的影响
2014-03-15刘安堂张文俊芦立轩
章 杰,江 华,刘安堂,朱 鴷,张文俊,芦立轩
(1.南昌大学第一附属医院整形美容科,江西南昌330006;2.第二军医大学上海长征医院整形外科,上海200003)
面神经解剖特殊,损伤后受骨性面神经管压迫,常形成“水肿-缺血-水肿”的恶性循环,如何预防或减轻面神经的水肿在面瘫临床治疗中具有极其重要的意义。
水通道蛋白(AQPs)是存在于细胞膜上,介导不同类型细胞跨膜水转运的膜蛋白家族,与多种组织器官水肿形成和消除密切相关,在水液代谢的调节中起重要作用[1-3]。其中AQP1 是周围神经系统表达最多的水通道蛋白[4-7]。前期研究证实了面神经组织内存在AQP1 的表达,并在小鼠面神经离断伤模型中发现面神经损伤后AQP1 表达增高,与面神经损伤后水肿时相性变化高度一致,提示AQP1 与面神经损伤后继发性水肿密切相关,并进一步研究发现AQP1 定位在雪旺细胞上。但是AQP1 表达增高与面神经水肿的因果关系还未确定,即AQP1 的高表达导致或加剧面神经水肿?还是面神经水肿伴行AQP1 的高表达尚无定论;且AQP1 在雪旺细胞内如何发挥生理和病理作用也不清楚。因此,本研究应用慢病毒介导的RNA 干扰技术下调雪旺细胞AQP1 表达,研究AQP1 表达抑制对雪旺细胞形态和水转运的影响,进而为研究AQP1 对面神经损伤后水肿的基因治疗提供依据。
1 材料与方法
1.1 实验动物
SPF 级,C57BL/6 小鼠,雌雄不限,3 ~5 d[第二军医大学动物实验中心,实验动物许可证号SCXK(沪)-2007-0005]。
1.2 材料
293 T 细胞、大肠杆菌DH5α 由第二军医大学神经生物研究所保存提供;pLKO.1-TRC cloning vector Plasmid、psPAX2、pMD 质粒(Addgene 公司);限制性内切酶AgeⅠ、EcoRⅠ以及T4 DNA 连接酶(New England Biolabs 公司);质粒抽提试剂盒(QIAGEN 公司);寡核苷酸在上海英骏(Invitrogen)生物技术有限公司合成;LipofectamineTM2000(Invitrogen 公司);2 ×Taq PCR MasterMix(含染料)(北京天根生物有限公司);反转录试剂盒(TaKaRa 公司),FastStart Universal SYBR Green Master (Rox)(Roche 公司);Annexin V-FITC 细胞凋亡试剂盒(Biovision 公司);小鼠源AQP1 单克隆抗体(Santa Cruz 公司);小鼠源GAPDH单克隆抗体、山羊抗兔及山羊抗小鼠二抗均(Cell Signaling Technology 公司);[3H]-3-氧-甲基-D-葡萄糖(OMG)(Amersham 公司);根皮素(Sigma 公司)。
1.3 方法
1.3.1 小鼠雪旺细胞原代培养:在解剖显微镜下于小鼠耳前与眼连线之间,用显微镊剥离皮肤及皮下组织显露面神经,可见面神经主干及其分支,取出面神经放入解剖液内(以无机盐和葡萄糖配成的PBS 缓冲液),仔细剥除神经外膜,显微剪反复剪碎组织块,0.25%胰蛋白酶37 ℃消化1 h,含10%胎牛血清的DF12 培养液终止消化,1 000 r/min离心5 min后培养基重悬,37 ℃、5% CO2孵箱内培养,以获得雪旺细胞;24 h 后细胞贴壁,每隔1 天更换培养液,待细胞80% ~90%汇合可传代,每日倒置显微镜观察细胞形态及生长状况。
1.3.2 免疫荧光共标染色鉴定所培养细胞AQP1 和S-100 表达:应用小鼠源AQP1 单克隆抗体和兔抗鼠S-100 抗体(雪旺细胞标志物)对所培养原代雪旺细胞进行免疫荧光共标染色,鉴定AQP1 的表达。具体操作步骤如下:取细胞生长状态良好,密度适中的雪旺细胞爬片放入24 孔板内;4% 多聚甲醛固定15 min,浸入抗原修复液中(0.01 mol/L 柠檬酸钠),置92 ℃水浴锅内2 ~6 min;滴加AQP1 和S-100 一抗共25 μL(1∶50稀释),室温下过夜;避光滴加二抗:山羊抗小鼠IgG-Cy3 和山羊抗兔IgG-FITC 各20 μL(1∶200稀释),室温下静置60 min;加入Hoechst 核抗体(1∶1 000)30 μL 染核,避光,室温下静置10 min;漂洗:0.01 mol/L PBS 洗5 min ×3 次;最后50%甘油PBS 封片,荧光显微镜下观察并拍照。每个操作步骤前用0.01 mol/L PBS 漂洗3 次,每次5 min。
1.3.3 AQP1-shRNA 慢病毒载体感染雪旺细胞:小鼠AQP1-shRNA 慢病毒载体重组质粒pLKOAQP1-SH 由本实验室前期构建并鉴定,并已筛选有效shRNA 进行慢病毒包装[8]。接种目的细胞于6 cm 培养皿中,接种浓度1 ×105/mL,当细胞汇合度达到30% ~45%时,加入3mL 的病毒上清,同时加入2 mL含10%胎牛血清的细胞培养液,加入聚凝胺至终浓度4 ~8 mg/L 以提高病毒感染效率,24 h 后更换为正常培养基。48 h 使用3 mg/L 的PURO 进行稳转筛选,以正常细胞系作为对照,直至正常对照细胞全部死亡,得到慢病毒干扰AQP1 稳定下调的细胞系。72 h 更换为正常培养基。
1.3.4 Real-time PCR 和蛋白质印迹法检测受感染的雪旺细胞中AQP1 mRNA 和蛋白表达:建好慢病毒稳定感染的细胞系后收获细胞,采用Trizol 试剂提取总RNA,使用紫外分光光度计进行RNA 定量,并反转录成cDNA。实时定量PCR 检测AQP1 的表达,反应条件如下:95 ℃预变性2 min,以后每个循环条件为95 ℃,60 ℃1 min,循环40 次。引物:AQP1:正义链为5'-GGAGATGAAGCCCAAATAGAG-3',反义链为5'-GCTCTGAGACCAGGAAACAGA-3';GAPDH 正义链为5'- GTTGTCTCCTGCGACTTCA-3',反义链为 5'-GGTGGTCCAGGGTTTCTTA-3'。GAPDH 作为内参,采用2-ΔΔCt方法计算基因相对表达。用PBS 洗涤受感染和未感染的雪旺细胞,收集并用裂解液裂解,刮下裂解产物,4 ℃12 000 r/min(离心半径r=8 cm)离心15 min,取上清;使用蛋白定量试剂盒测定裂解产物的蛋白浓度为2 g/L;用10%聚丙烯酰胺凝胶电泳后转膜,封闭;加入一抗(小鼠源AQP1 单克隆抗体1∶1 000,小鼠源GAPDH单克隆抗体1∶5 000),40 ℃过夜,TBST 洗膜3 次,每次10 min;加入1∶5 000稀释的羊抗鼠IgG 二抗孵育PVDF 膜2 h,经过多次清洗,用ECL-Plus 试剂盒观察蛋白条带。实验至少重复3 次。
1.3.5 倒置显微镜观察AQP1-shRNA 感染雪旺细胞后形态变化:AQP1-shRNA 感染原代小鼠雪旺细胞后,与CTRL 组(scr-shRNA)比较,每隔24 h 观察细胞形态变化,连续6 d。
1.3.6 AQP1-shRNA 感染雪旺细胞后水含量测定:根据Kletzien 等人的[3H]-3-氧-甲基-D-葡萄糖(OMG)方法测定细胞水含量[9-10]。在慢病毒感染后不同时间点,雪旺细胞内加入1 mmol/L[3H]OMG(1.85 ×109Bq/L)0.05 mL,继续放入二氧化碳培养箱中孵育,30 min 后取出弃去孵育液,用含1 mmol/L根皮素(Phloretin)的冷Earle 氏液快速洗3遍终止反应,加0.2 mol/L NaOH 消化,10 min 后取0.5 mL 用于液体闪烁计数,取0.1 mL 用于蛋白质含量测定(Lowry 氏法),根据Kletzien 的方法换算成细胞内水含量,结果以μL/mg 蛋白表示。
细胞内水含量(μL/mg)=OMG 的μmol 数·g-1/OMG 的mmol 浓度
1.3.7 四唑蓝(MTT)法测细胞生长曲线:取对数生长期细胞,0.25% 胰蛋白酶消化成细胞悬液,以1×104浓度接种于96 孔板内,待细胞贴壁后,加入AQP1-shRNA 感染细胞,设scr-shRNA 为CTRL 组,置37 ℃、5% CO2孵箱内培养,24 h 后吸弃上清,向96孔板中依次加入MTT(终浓度为1 mg/mL)200 μL,继续培养4 h 后弃上清液,加入150 μL/孔二甲基亚砜(DMSO),置摇床上低速振荡10 min 后,以酶标议450 nm 波长检测光密度值(A450)。以时间为横坐标、细胞存活率为纵坐标绘制细胞生长曲线。细胞存活率=实验组细胞(A450)/对照组细胞(A450)。
1.3.8 流式细胞仪检测AQP1 干扰后细胞凋亡:慢病毒感染6 d 后,贴壁细胞用0.25%胰蛋白酶消化,培养液重悬成细胞悬液,将AQP1-shRNA 干扰组和CTRL 组(scr-shRNA)细胞用PBS 洗2 次,加入100 μL结合缓冲液(Binding Buffer)和FITC 标记的磷脂结合蛋白(Annexin-V)(20 mg/L)10 μL,室温避光30 min,再加入碘化丙啶(PI)(50 mg/L)5 μL,避光反应5 min 后,加入400 μL 结合缓冲液,立即采用流式荧光激活细胞分析(FACScan)进行流式细胞术定量检测(一般不超过1 h),同时以不加AnnexinV-FITC 及PI 的一管作为阴性对照。
1.4 统计学分析
2 结果
2.1 成功培养出原代雪旺细胞
胰蛋白酶消化后,细胞悬浮,呈圆形,静置24 h后细胞贴壁,细胞呈两极形态,为梭形,突触逐渐延长,并与周围细胞突触交织呈网状(图1)。
2.2 所培养细胞免疫荧光染色证实表达AQP1
免疫荧光共标法鉴定所培养细胞同时表达AQP1 和S-100(图2)。

图1 原代培养雪旺细胞生长形态Fig 1 Morphology of primary Schwann cells(×100)
2.3 Real-time PCR 和Western blot 鉴定AQP1-shRNA 感染雪旺细胞后AQP1 mRNA 和蛋白表达水平
较Blank 和scr-shRNA,AQP1-sh 能有效下调AQP1 mRNA 表达,下调效率约为65%(P<0.05)(图3A)。空白对照组跟随机序列对照组没有差异,而AQP1-sh 实验组的AQP1 蛋白表达水平明显下调(P<0.05)(图3B)。
2.4 AQP1-shRNA 对雪旺细胞形态的影响
AQP1-shRNA 感染原代雪旺细胞后每隔48 h 观察细胞形态变化,前4 天AQP1-shRNA 组细胞与CTRL 组细胞形态无明显差异,细胞均为梭形,第4天后发现细胞胞体开始皱缩,第6 天细胞胞体皱缩更明显,细胞突触更细长(图4)。

图2 AQP1 和S-100 共标免疫荧光染色Fig 2 Double immunostaining images of AQP1 expression in Schwann cells with anti-AQP1 antibody and anti-S-100 antibody(×400)

图3 有效下调AQP1 基因的慢病毒载体感染雪旺细胞后的real-time 和Western blot 结果Fig 3 The effect of lentiviral-mediated knockdown of AQP1 expression in primary cultured Schwann cells
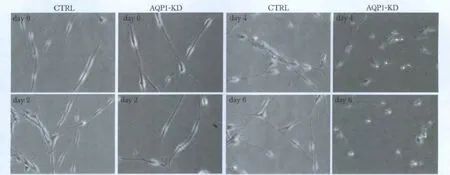
图4 慢病毒感染雪旺细胞后细胞形态变化Fig 4 AQP1 knockdown induces alterations in Schwann cell morphology(×200)
2.5 AQP1-shRNA 对雪旺细胞水转运的影响
AQP1-shRNA 处理4 及6 d 后细胞容积较对照组明显降低(P<0.01)(表1)。
表1 AQP1-shRNA 对体外培养雪旺细胞水含量的影响Table 1 AQP1-shRNA causes cell shrinkage in cultured Schwann cells by 38.9% at day 4 and 43.6%at day 6(±s,μL/mg,n=8)

表1 AQP1-shRNA 对体外培养雪旺细胞水含量的影响Table 1 AQP1-shRNA causes cell shrinkage in cultured Schwann cells by 38.9% at day 4 and 43.6%at day 6(±s,μL/mg,n=8)
Control (treated with scr-shRNA);* P<0.01 compared with control group.
groupcell volume control3.54 ±0.30 AQP1SH(2 d)3.44 ±0.20 AQP1SH(4 d)2.11 ±0.22*AQP1SH(6 d)1.94 ±0.28*
2.6 AQP1-shRNA 对雪旺细胞增殖的影响
以转染无意序列scr-shRNA 作为对照,AQP1-shRNA 转染后雪旺细胞增殖活力降低(P<0.05)(图5)。
2.7 AQP1-shRNA 对雪旺细胞凋亡的影响
以Annexin V-FITC 和PI 双标记对雪旺细胞进行流式细胞仪检测。结果显示,与CTRL 组比较,AQP1-shRNA 干扰组不会引起雪旺细胞明显的早期和中晚期凋亡(图6)。

图5 AQP1-shRNA 对雪旺细胞增殖的影响Fig 5 Effect of AQP1-shRNA on Schwann cells proliferation
3 讨论
临床上周围神经损伤非常多见,牵拉伤、离断伤、压迫伤、感染等均会造成周围神经的水肿。而面神经作为周围神经的一种,由于其解剖特殊,受骨性面神经管压迫,损伤后神经水肿、神经内压升高,致神经缺血、缺氧,神经内膜通透性增加,血-神经屏障功能破坏,神经内膜水肿,神经内压进一步升高,形成水肿-缺血-水肿的恶性循环,进而加重面神经的损伤,引起面瘫症状,严重影响患者心理和生理健康,大大降低患者生存质量。因此,如何预防或减轻面神经的水肿在面瘫早期治疗中显得尤为重要。

图6 流式细胞仪检测AQP1-shRNA 感染后雪旺细胞凋亡情况Fig 6 Apoptosis rates of Schwann cells in AQP1-shRNA group and control group by flow cytometry
AQPs 在中枢神经系统内的研究较多,AQP1、AQP4 和AQP9 已被鉴定在中枢神经系统内表达,认为其对脑水平衡的调节起重要作用,并且证实AQP4 是控制脑星形胶质细胞快速水转运的主要因素,AQP4 改变是缺血诱导脑水肿的主要因素[11-14];但AQPs 在周围神经系统中的功能研究却鲜有报道。已有研究证实AQP1 是周围神经系统表达最多的水通道蛋白[4-7],并发现AQP1 定位在周围神经系统的胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)表达阳性的雪旺细胞内;AQP1 也被发现在周围神经系统的背根神经节、三叉神经节、结节性神经节的胶质细胞内表达。AQP1在周围神经系统胶质细胞的这种特定表达就像AQP4 在中枢神经系统星形胶质细胞内表达一样。因此,本研究设想AQP1 在面神经水肿中的作用类似于AQP4 在脑水肿中的作用。
雪旺细胞是周围神经的胶质细胞,在周围神经的发生及损伤后的再生中发挥重要作用。本研究前期实验证实面神经组织内表达AQP1,并发现AQP1 主要表达在神经膜上,而且通过细胞免疫组化将AQP1 定位在原代培养的雪旺细胞上。因此,此原代培养雪旺细胞可作为理想的细胞模型,为后续研究AQP1 在雪旺细胞及面神经组织内的基因功能奠定了实验基础。因慢病毒具有能感染非分裂细胞和终末分化细胞,病毒的VSVG 外壳使载体病毒颗粒具有较强的稳定性以及介导的RNAi 作用持久,能长期稳定表达外源基因等优点[15]。因此,本研究选择慢病毒作为干扰载体,有效和特异地下调了小鼠原代雪旺细胞AQP1 表达,为研究AQP1 在面神经水肿中的基因功能提供了条件。
本实验发现AQP1-KD 处理的雪旺细胞较对照组细胞明显皱缩,细胞容积显著降低,细胞突出变得更细、更长,胞体也明显缩小;并通过细胞增殖活力检测发现AQP1-KD 会抑制细胞的增殖,但流式细胞仪检测显示AQP1-KD 不会引起雪旺细胞明显的凋亡,而且病毒感染后细胞也未出现凋亡小体,说明细胞形态皱缩、水含量降低不是由于细胞凋亡引起。这些细胞的形态学变化则可能是因为在缺乏AQP1 转运情况下,细胞为了增加水通量而增加细胞表面积和体积比而出现。这些现象表明原代培养的雪旺细胞需要功能性AQP1 表达来维持正常的细胞形态和良好的细胞生长;并且暗示水通道活性和细胞形态与AQP1 的功能密切相关;说明AQP1是控制雪旺细胞快速水转运的主要因素,可为临床治疗面神经水肿提供新的靶点。由于慢病毒可稳定长期表达外源基因,故下一步实验可应用慢病毒转染活体动物,完成体内实验,进一步研究AQP1 对治疗早期面瘫的临床意义,为今后的临床应用提供可能。
[1]King LS,Yasui M.Aquaporins and disease:lessons from mice to humans[J].Trends Endocrinol Metab,2002,13:355-360.
[2]Verkman AS.Physiological importance of aquaporins:lessons from knockout mice[J].Curr Opin Nephrol Hypertens,2000,9:517-522.
[3]章杰,江华,芦立轩,等.水通道蛋白在胶质细胞的表达及其意义[J].基础医学与临床,2013,33:378-381.
[4]Gao H,He C,Fang X,et al.Localization of aquaporin-1 water channel in glial cells of the human peripheral nervous system[J].Glia,2006,53:783-787.
[5]Nandasena BG,Suzuki A,Aita M,et al.Immunolocalization of aquaporin-1 in the mechanoreceptive Ruffini endings in the periodontal ligament[J].Brain Res,2007,1157:32-40.
[6]Oshio K,Watanabe H,Yan D,et al.Impaired pain sensation in mice lacking Aquaporin-1 water channels[J].Biochem Biophys Res Commun,2006,341:1022-1028.
[7]Shields SD,Mazario J,Skinner K,et al.Anatomical and functional analysis of aquaporin 1,a water channel in primary afferent neurons[J].Pain,2007,131:8-20.
[8]章杰,江华,张盈帆,等.小鼠水通道蛋白1 基因shRNA慢病毒载体构建与鉴定[J].细胞与分子免疫学杂志,2013,29:48-53.
[9]Bender AS,Norenberg MD.Effect of benzodiazepines and neurosteroids on ammonia-induced swelling in cultured astrocytes[J].J Neurosci Res,1998,54:673-680.
[10]Kletzien RF,Pariza MW,Becker JE,et al.A method using 3-O-methyl-D-glucose and phloretin for the determination of intracellular water space of cells in monolayer culture[J].Anal Biochem,1975,68:537-544.
[11]Badaut J,Hirt L,Granziera C,et al.Astrocyte-specific expression of aquaporin-9 in mouse brain is increased after transient focal cerebral ischemia[J].J Cereb Blood Flow Metab,2001,21:477-482.
[12]Manley GT,Fujimura M,Ma T,et al.Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke[J].Nat Med,2000,6:159-163.
[13]Nicchia GP,Frigeri A,Liuzzi GM,et al.Inhibition of aquaporin-4 expression in astrocytes by RNAi determines alteration in cell morphology,growth,and water transport and induces changes in ischemia- related genes[J].FASEB J,2003,17:1508-1510.
[14]Oshio K,Watanabe H,Song Y,et al.Reduced cerebrospinal fluid production and intracranial pressure in mice lacking choroid plexus water channel Aquaporin-1[J].FASEB J,2005,19:76-78.
[15]Sakuma,Barry MA,Ikeda Y.Lentiviral vectors:basic to translational[J].Biochem J,2012,443:603-618.
