心肌缺血对大鼠孤束核利钠肽受体表达的影响
2014-03-15牛丽静管振龙宋俊贞苗智慧夏晓红王燕凌王惠娟
牛丽静,白 云,管振龙,宋俊贞,苗智慧,夏晓红,王燕凌,王惠娟
(1.河北省疾病预防控制中心医学研究所,河北石家庄050021;2.唐山职业技术学院基础医学部解剖教研室,河北唐山063000;3.河北师范大学生命科学学院神经生理学教研室,河北石家庄050024;4.河北省血液中心临床输血技术指导办公室,河北石家庄050071)
利钠肽主要通过激活NPR-A(natriuretic peptide receptors A)或NPR-B(natriuretic peptide receptors B)受体,完成利尿、降压、调节神经、促进骨骼发育等功能,特别在调控心肾功能以维持机体稳态过程中起重要作用[1]。另一种受体NPR-C(natriuretic peptide receptors C),被认为是可以从循环中清除利钠肽的受体。利钠肽受体广泛分布于中枢神经系统中,特别在下丘脑、脑干及室周器官有密集表达,在中枢调控心血管稳态过程中亦起着重要的作用[2-4]。孤束核是接受并整合心血管传入冲动的初级中枢,其内的胆碱能和儿茶酚胺能神经元参与了血压调节[5]。现已知孤束核内存在有NPR-A 和NPR-C 阳性神经元,但这些神经元是否为胆碱能或儿茶酚胺能神经元?在心肌缺血后,孤束核区域的NPR-A、NPR-C 的表达量是否随之发生变化?这些均未见报道。本研究拟通过检测NPR-A 和NPR-C 的表达变化和NPR-A/TH(或NPR-C/TH)、NPR-A/ChAT(或NPR-C/ChAT)的双标记情况,来探讨心肌缺血后利钠肽在孤束核内的部分作用机制。
1 材料与方法
1.1 材料和试剂
清洁级3月龄雄性SD 大鼠(体质量280 ~330 g,河北医科大学实验动物中心提供,合格证编号:1006015)63 只。兔抗NPR-A 多克隆抗体和兔抗NPR-C 多克隆抗体(Abcom)、山羊抗ChAT 单克隆抗体(Millpore 公司)、小鼠抗TH 单克隆抗体(Sigma公司)、山羊抗小鼠IgG-FITC 和兔抗山羊IgG-FITC(均中杉金桥有限公司)。
1.2 实验分组及模型复制
大鼠随机分为免疫荧光化学组(3 只),实验组(模型组,43 只),实验对照组(假手术组,sham,8只)、对照组(control,9 只)。
免疫荧光化学反应组大鼠经4%多聚甲醛灌流固定,取脑组织行冰冻切片,免疫化学荧光反应。给实验组大鼠腹腔注射戊巴比妥钠(40 mg/kg)麻醉后,复制心肌缺血动物模型[6]。大鼠手术后进行恢复性饲养。将成活的实验组大鼠随机分为3 d 取材组(9 只),术后7 d 取材组(7 只),术后14 d 取材组(9 只),术后18 d 取材组(9 只)和术后28 d 取材组(9 只)。实验对照组大鼠除了不结扎冠状动脉左前降支外,其他手术与实验组的处理相同。对照组大鼠不做手术处理,正常饲养。
1.3 TTC 染色
从实验组、假手术组和对照组取材过程中摘下的心脏的心尖部注入1 mL 3%伊万氏蓝。数秒后将心脏在4 ℃0.9%氯化钠注射液中冲洗,滤纸吸干水后-20 ℃保存30 min。随后把冷冻后的心脏沿房室沟轴横切成2.0 ~2.5 mm 厚的断面,用0.1%TTC 0.9%氯化钠注射液溶液37 ℃孵育30 min。正常组织被染成蓝色,缺血心肌组织被染成红色,梗死区不着色,以此判定心肌缺血模型是否复制成功[7]。
1.4 蛋白质印迹实验脑组织取材
实验组动物分别在手术后的第3、7、14、18 和28 天深度麻醉(80 mg/kg),剪开胸腔,暴露心脏,经升主动脉插管,先用100 mL 0.9%氯化钠注射液冲洗血液。血液冲洗干净后,迅速摘下心脏,用吸水纸吸干多余水分后称重;取整脑,在闩平面取孤束核组织(约0.015 g)。将取下的脑组织置于低温环境(0 ~4 ℃)备用。实验对照组大鼠、对照组大鼠于实验组术后3 d 按上述方法进行取材处理。
1.5 免疫荧光化学反应
所有切片均采用漂浮染色法:冰冻切片放入漂洗盒,PBS 换洗3 次,然后加入4%牛血清(含0.3%Triton 的PBS 稀释)室温封闭40 min;PBS 换洗3次,加入小鼠抗TH 抗体(1∶10 000)/山羊抗ChAT(1∶1 000)、兔抗NPR-A 抗体(1∶600)/兔抗NPR-C(1∶1 600)(用含0.3% Triton 的PBS 稀释)混合液,振荡后4 ℃冰箱中孵育72 h;取出后PBS 换洗5 次;加入山羊抗小鼠IgG-FITC(1∶500,用含0.3% Triton的PBS 稀释)、山羊抗兔IgG-TRITC(1∶1 000,用含0.3% Triton 的PBS 稀释)混合液,室温下振荡孵育4 h;PBS 换洗5 次,切片裱于挂有3%明胶的载玻片上,置于阴凉处避光晾干后,甘油封片。于荧光显微镜下观察并照相,记录结果。
1.6 蛋白质印迹分析
分别将实验组、实验对照组以及对照组大鼠取下的孤束核组织进行处理。低温下加入RIPA 裂解液研磨成浆液,离心后取上清液,考马斯亮蓝蛋白定量。按照蛋白标准曲线测定组织上清液中的蛋白含量,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(每加样孔中蛋白上样量60 μg)之后,将凝胶进行转膜,并进行NPR-A 和NPR-C 的印迹杂交(抗体稀释浓度为1∶500)以内参肌动蛋白(β-actin)条带吸光度值作为标准,计算NPR-A 和NPR-C 蛋白的相对表达量。
1.7 统计学分析
用Image J 图像分析软件采集吸光度值,并以SPSS13.0 数据处理软件进行数据分析。实验结果以算术平均数±标准差(±s)表示,进行单因素方差分析,Student Newman-Keuls 检验。
2 结果
2.1 TTC 染色的结果
动物心脏呈现深蓝色,在冠脉结扎创口附近可见明显的红色缺血区和白色梗死区(图1)。假手术组动物心肌可见少量红色区域。空白对照组动物心脏未见红色缺血区及白色梗死区域。提示所有大鼠心肌缺血模型复制成功。

图1 TTC 染色结果及大鼠心脏图片Fig 1 Photographs of the heart sections after TTC staining and hearts of coronary artery ligation group and sham group(n=6)
2.2 心肌缺血后大鼠心脏的变化
随心肌缺血时间的延长大鼠心脏明显肥大,心脏重量也有升高的趋势,并在术后14、18 和28 d 比对照组及假手术组有极显著的增加。
2.3 孤束核周区Western blot 的结果
NPR-A 在相对分子质量118 ku 处有明显阳性条带,NPR-C 在相对分子质量65 ku 处有明显的阳性条带(图2)。心肌梗死后NPR-A 在孤束核周区的表达呈现一定的波动性,术后3、7 d 模型组与对照组无显著性差异,但有逐渐升高的趋势,在术后14 d 显著低于对照组(P<0.05),约为其蛋白表达量的1/2,术后14、18、28 d,NPR-A 的表达亦呈逐渐升高的趋势,至术后28 d 显著高于对照组(P<0.01),约为其蛋白表达量的2.4 倍。心肌梗死后NPR-C 在孤束核周区的表达均低于对照组,3、7、14和18 d 有显著性差异(P<0.01)。
2.4 免疫荧光染色的结果
荧光显微镜下,可见孤束核内有密集的FITC 标记的绿色TH 阳性神经元(图3A、4A),其中以中小型为主;以及密集的TRITC 标记红色NPR-A 神经胶质细胞和少量的神经元(图3B)。孤束核中TH/NPR-A 双标记神经元呈黄色,有少量散在分布(图3C)。孤束核内还存在有TRITC 标记的红色NPR-C 神经元和大量神经胶质细胞(图4B)。TH/NPR-C 双标记神经元呈黄色,在孤束核中有密集分布(图4C)。
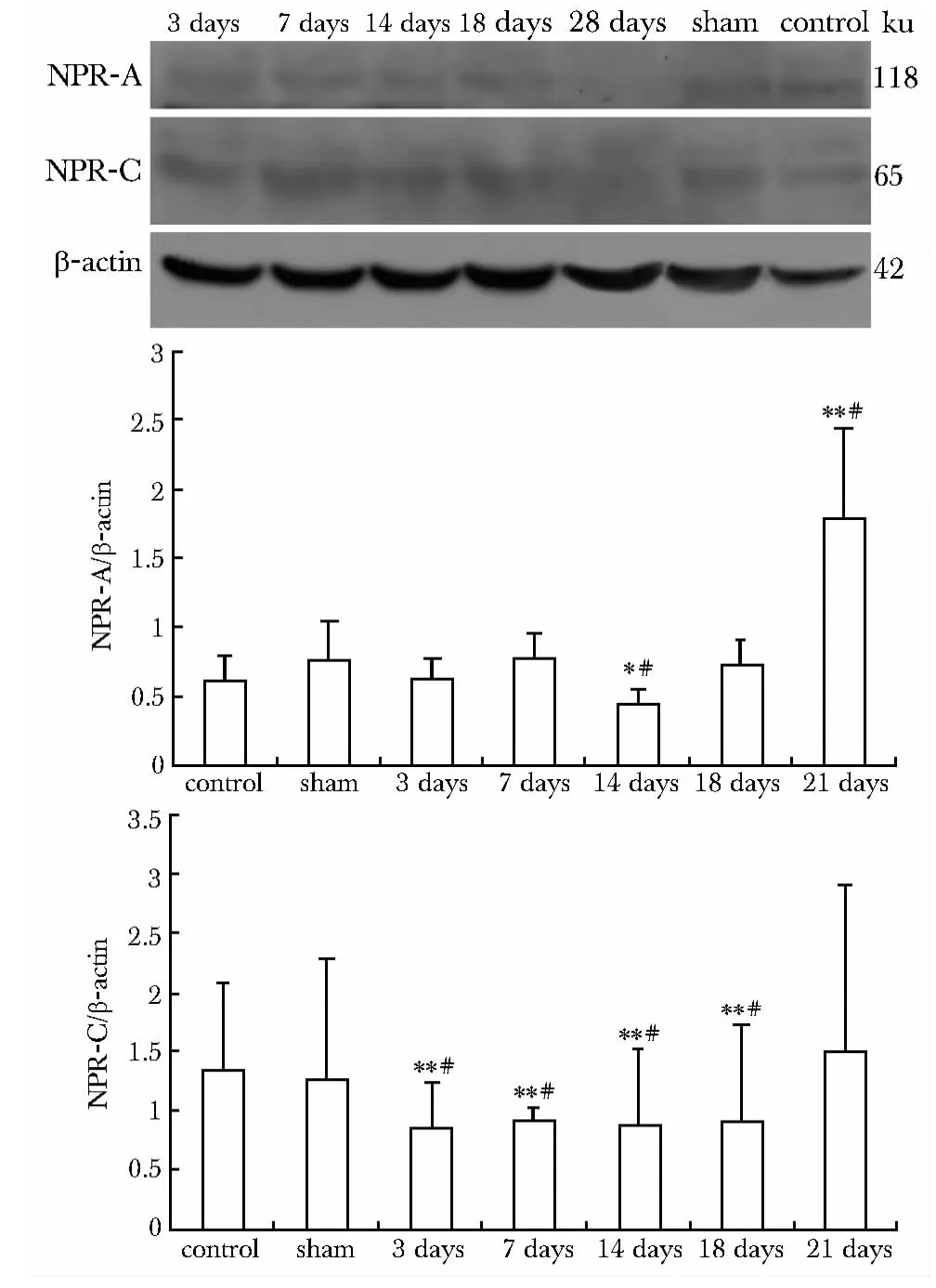
图2 冠脉结扎后大鼠孤束核周区NPR-A 和NPR-C 的表达变化Fig 2 NPR-A,NPR-C expression in the nucleus of the solitary tract of the rats after coronary artery ligation
在ChAT 与NPR-A/NPR-C 的双标记荧光化学实验中,未发现有双标记神经元或神经胶质细胞分布于孤束核群内。
3 讨论
心肌缺血后,心室肌和心房肌细胞增加分泌的利钠肽与心肌病变的程度呈正相关[8]。基础实验研究发现,心肌梗死模型大鼠的血浆脑钠肽浓度在第3 天和第14 天有两次升高[9]。血液中升高的利钠肽一方面通过抑制肾上腺醛固酮的分泌、降低肾小管细胞的代谢活动、促进排钠排水,降低血压和回心血量;另一方面,利钠肽可通过无血-脑脊液屏障的部位入脑,作用于不同中枢部位,通过影响激素的分泌和交感、副交感神经的活动调节心血管的功能。有研究证实,心肌缺血后的心肌组织内,心房肽和脑钠肽的表达均显著升高,其受体NPR-C 的表达也随之增多,但于缺血后的第28 天在肾脏和肺内显著降低[10]。本研究结果孤束核区域内NPR-A 由低到高的表达变化,表明病理条件下利钠肽在孤束核区域的调节功能,可能主要是通过NPR-A 表达变化实现的。NPR-A 表达的增加可以提高利钠肽对中枢的作用。本小组以往的研究显示,心肌缺血后延髓腹侧部NPR-A 的表达显著升高,与心肌缺血后血液中利钠肽含量变化的时间点和趋势一致[11]。提示从无血-脑脊液屏障区进入中枢的利钠肽可能先作用于延髓腹侧部升压区,适应性的升高交感紧张性,增强心肌收缩力,加快心率。孤束核区域缺血14 d 至缺血28 d NPR-A 表达的增加,可能与缺血后期激活此处的神经元来抑制升压区的交感兴奋相关。NPR-A 蛋白在心肌缺血后孤束核与延髓腹侧部表达的差异,可能与这些区域在心血管调控中的作用不同相适应。

图3 TH 阳性神经元与NPR-A 阳性神经元在脑干内的分布Fig 3 Double immunofluorescence for TH and NPR-A positive neurons in brainstem (×100)

图4 TH 阳性神经元与NPR-C 阳性神经元在脑干内的分布Fig 4 Double immunofluorescence for TH and NPR-C positive neurons in brainstem (×100)
孤束核是压力反射的第一级中枢,接受动脉压力感受器投射,并对这些信息进行整合后投射到延髓吻段腹外侧区和延髓尾段腹外侧区,维持血压的相对稳定。儿茶酚胺可以直接调控到孤束核的内脏初级传入[12];而胆碱能神经元则直接参与了压力感受器反射过程[5]。本实验的结果显示,在孤束核内仅有少量、散在的NPR-A/TH 双标记神经元,而有较多的NPR-C/TH 双标记神经元;但未见NPR-A/ChAT 或NPR-C/ChAT 双标记神经元。这提示,心肌缺血后分泌增加的利钠肽在孤束核区域对心血管反射的调节,可能不是直接通过影响胆碱能和儿茶酚胺能神经元的活动实现的,其具体的生理机制尚需进一步研究。
[1]Chopra S,Cherian D,Verghese PP,et al.Physiology and clinical significance of natriuretic hormones[J].Indian J Endocrinol Metab,2013,17:83-90.
[2]Marei HE.Fine structural and immunohistochemical localization of cardiac hormones (ANP)in the right atrium and hypothalamus of the white rat[J].Eur J Morphol,2002,40:37-41.
[3]Tsukada T,Nobata S,Hyodo S,et al.Area postrema,a brain circumventricular organ,is the site of antidipsogenic action of circulating atrial natriuretic peptide in eels[J].J Exp Biol,2007,210:3970-3978.
[4]Abdelalim EM,Osman AH,Takada T,et al.Immunohistochemical mapping of natriuretic peptide receptor-A in the brainstem of Macaca fascicularis[J].Neurosci,2007,145:1087-1096.
[5]Vieira AA,De Luca LA Jr,Colombari E,et al.Commissural NTS lesions enhance the pressor response to central cholinergic and adrenergic activation[J].Neurosci Lett,2012,521:31-36.
[6]吴雪梅,王琛,谢红,等.NF-кB 参与七氟烷预处理所致延迟性抗大鼠心肌缺血再灌注损伤[J].基础医学与临床,2013,33:39-43.
[7]Izumi T,Saito Y,Kishimoto I,et al.Blockade of the natriuretic peptide receptor guanylyl cyclase-A inhibits NF-kappaB activation and alleviates myocardial ischemia/reperfusion injury[J].J Clin Invest,2001,108:203-213.
[8]刘红樱,王蔚,葛均波.B 型利钠肽与急性冠状动脉综合征的研究进展[J].上海医学,2011,34:237-239.
[9]Sawada Y,Inoue M,Kanda T,et al.Co-elevation of brain natriuretic peptide and proprotein-processing endoprotease furin after myocardial infarction in rats[J].FEBS Lett,1997,400:177-182.
[10]Hystad ME,Oie E,Grogaard HK,et al.Gene expression of natriuretic peptides and their receptors type-A and-C after myocardial infarction in rats[J].Scand J Clin Lab Invest,2001,61:139-150.
[11]牛丽静,白云,苗智慧,等.心肌缺血对大鼠延髓利钠肽受体表达的影响[J].中国病理生理杂志,2014,30:220-225.
[12]郭峰,马文领,张文斌,等.孤束核内儿茶酚胺能神经元汇聚内脏传入与口面部躯体伤害性信息并向臂旁核投射[J].神经解剖学杂志,2006,22:173-177.
