MIBG对人肝癌HepG2细胞增殖的影响
2014-03-15刘逢秋管小琴王娅兰
刘逢秋,管小琴,王娅兰,苏 晏
(重庆医科大学基础医学院病理学教研室,分子医学与肿瘤研究中心,重庆400016)
单腺苷二磷酸核糖基化(mono-ADP-ribosylation)是由单腺苷二磷酸核糖基化转移酶(mono-ADP-ribosyltransferases,mono-ARTs)催化的一种蛋白转录后修饰,其将ADP-核糖从NAD +转移到受体蛋白特定的氨基酸位点如精氨酸、半胱氨酸残基上。又可根据接受单腺苷二磷酸核糖基化作用的不同氨基酸种类,将其分为4 种亚型。精氨酸特异性单腺苷二磷酸核基化就是其中重要一种[1]。
MIBG 是一种去甲肾上腺素神经递质胍类似物。放射性131I 标记的MIBG 在临床上作为肿瘤靶放射药物来诊断和治疗肾上腺肿瘤。而未放射标记的MIBG 可以影响多种细胞生物学功能。目前研究发现MIBG 能够特异性抑制精氨酸特异性单腺苷二磷酸核糖基化的功能。因MIBG 其化学结构与精氨酸特异性单腺苷二磷酸核糖基化转移酶催化的底物结构类似,从而可以竞争性抑制精氨酸特异性单腺苷二磷酸核糖基化作用[2]。通过加入MIBG 能引起细胞膜到细胞核的一系列信号的传导的改变最终可抑制平滑肌细胞增殖和迁移[3]。
本实验通过使用MIBG 抑制精氨酸特异性单腺苷二磷酸核糖基化作用,进一步探究其对肝癌HepG2 细胞增殖的影响。
1 材料与方法
1.1 药物与试剂
新生小牛血清(四季青公司);RPMI-1640 培养基、胰蛋白酶(HyClone 公司);PMSF,PIPA 裂解液(Beyotime);MIBG(Sigma 公司);ART1 多克隆抗体(SANTA 公司与Sigma 公司);兔抗山羊IgG/FITC标记抗体(中衫金桥);RhoA,c-myc 多克隆抗体(武汉山鹰公司);cyclin A1 多克隆抗体(博士德生物);辣根过氧化物酶标记羊抗兔IgG(北京博奥森);BCA 试剂盒(碧云天公司)。
1.2 细胞的培养及处理
1.2.1 细胞的培养:人肝癌HepG2 细胞株用含10%新生小牛血清、100 U/mL 青霉素及100 U/mL链霉素的RPMI-1640 培养液于5% CO2、37 ℃培养箱中培养2 d,待细胞汇合至80%左右。PBS 清洗3次加入胰蛋白酶消化离心后传代处理。
1.2.2 细胞免疫荧光实验检测:ART1 在HepG2 中的表达:将灭菌处理后的玻璃爬片放入6 孔板中,HepG2 细胞以1 ×106cells/L 接种于6 孔板,待细胞汇合至玻璃爬片60% 左右,取出爬片PBS 清洗3次。用10%甲醛固定30 min,在用PBS 清洗3 次每次2 min,加入0.5% Triton 处理15 min,PBS 洗2次,每次5 min。然后1%牛血清白蛋白(BSA)封闭30 min,在用1∶100 的ART1 抗体4 ℃孵育过夜,对照组PBS 代替一抗做阴性对照。过夜后PBS 清洗3次,每次5 min,加入浓度为1∶50 的兔抗山羊IgG/FITC 标记抗体,37 ℃避光杂交孵育1 h。孵育完毕后再用PBS 清洗3 次,每次5 min。最后用荧光抗淬灭封片液封片,荧光显微镜下观察并采集图像。
1.2.3 噻咗蓝(MTT)比色实验检测细胞生存:HepG2细胞以1 ×106cells/L 接种于96 孔板,200 μL/孔。在培养箱中培养24 h 后,加入MIBG 至所需的不同浓度,继续培养12 h。每孔加入MTT(5 g/L)20 μL,37 ℃继续孵育4 h,终止培养,弃去上清液,每孔加入150 μL 二甲基亚砜,轻轻振荡10 min,使甲臜溶解。在酶联免疫检测仪上,490 nm 波长测定各孔吸光值。细胞生存率=[(实验组吸光值-空白组吸光值)/(对照组吸光值-空白组吸光值)]×100%。
1.2.4 流式细胞仪测定细胞周期:HepG2 细胞以1 ×106cells/L接种于6 孔板,2 mL/孔。在培养箱中培养24 h 后,加入MIBG 至所需的不同浓度,继续培养12 h。用0.25%胰蛋白酶消化细胞,制成细胞悬液并用PBS 洗涤,离心后弃上清液,重新悬浮于4 ℃预冷的0.9%氯化钠注射液中,缓慢加入-20 ℃预冷的95%乙醇,使其终浓度为70%。固定4 h 后流式细胞周期检测。
1.2.5 Western blot 检测蛋白表达:将各组培养的细胞裂解之后提取蛋白,然后用BCA 试剂盒测定各组蛋白浓度。5∶1 体积与蛋白上样缓冲液混合,沸水中水浴5 min。按每孔相同蛋白总量加入凝胶,ART1、c-myc、cyclinA1 和β-actin 用10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,RhoA 用15%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。然后再电转到0.45 μm聚偏二氟乙烯(PVDF)膜上。封闭1 h。一抗c-myc、cyclinA1 浓度1 ∶300,ART1、RhoA 浓度1∶200,β-actin 浓度1∶500 4 ℃过夜。吐温20/三羟甲氨基甲烷缓冲液(TBST)清洗3 次后用1∶1 000辣根过氧化物酶标记羊抗兔IgG 孵育2 h,加入ECL 化学显影试剂后凝胶图像分析系统拍照,检测蛋白质印迹条带。
1.3 统计学分析
2 结果
2.1 细胞的免疫荧光
荧光显微镜下见HepG2 的胞膜、胞质均有荧光。而用PBS 阴性对照的HepG2 细胞中则没有(图1)。
2.2 MTT
50μmol/L MIBG 开始,呈剂量依赖性抑制细胞存活(P<0.05)(表1)。
2.3 流式细胞仪测定细胞周期
随着MIBG 浓度的增加,处于S 期的细胞比例也随之增加(P<0.05)(图2,3)。
2.4 Werstern bolt
与对照组比较,实验组ART1、RhoA、c-myc 和cyclinA1 蛋白表达水平降低。4 个指标各组间两两比较均有差异(P<0.05)(图4)。

图1 细胞免疫荧光法检测人肝癌细胞HepG2 中ART1 的表达情况Fig 1 The expression of ART1 in hepatoma carcinoma HepG2 cells detected by cellular immunofluore scence method(taken the pictures by fluores cence microscope,×400)
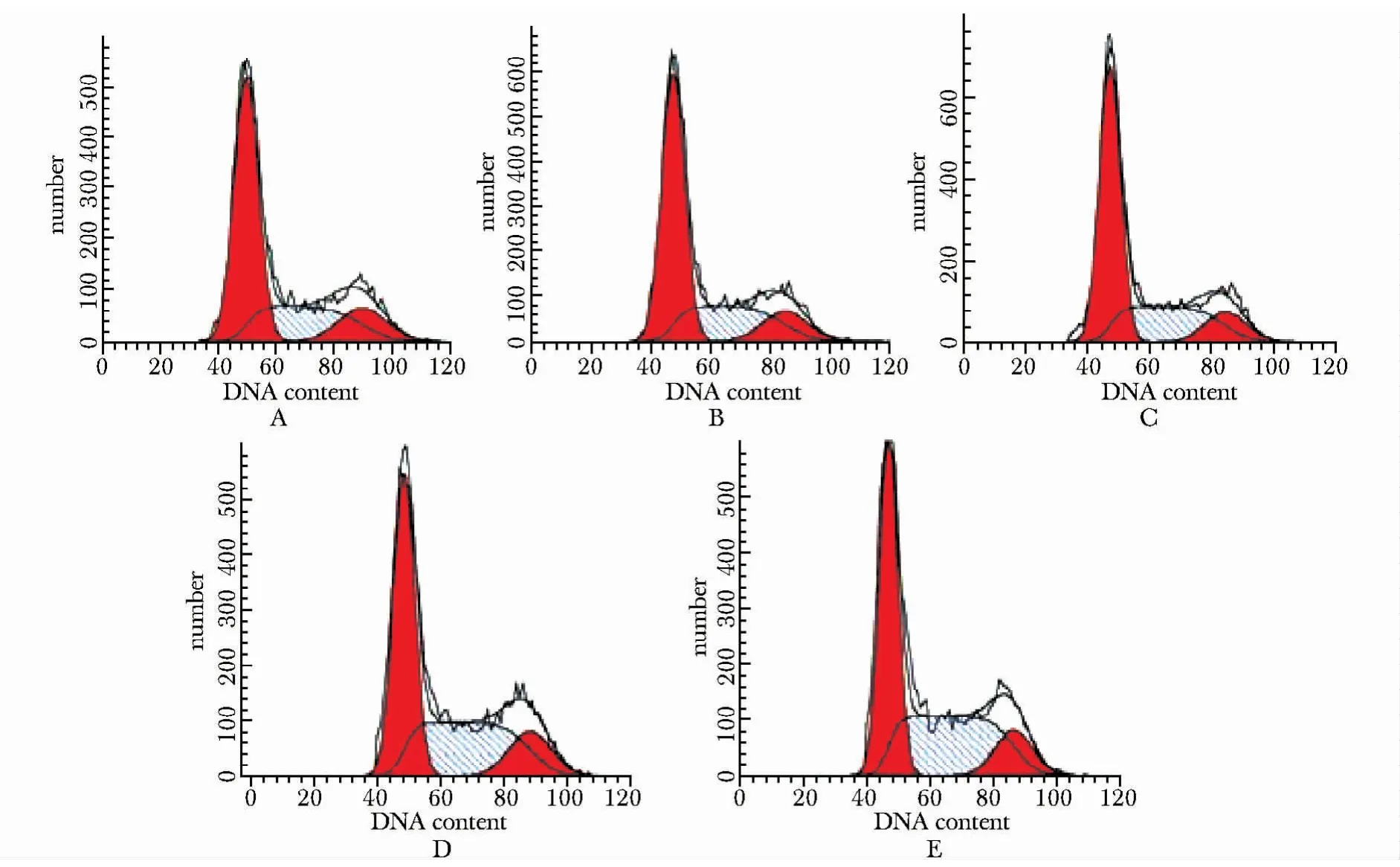
图2 流式细胞术检测不同浓度MIBG 处理后的HepG2 细胞周期Fig 2 HepG2 cell cycle phases treated with different concentration of MIBG analysed by flow cytometry
表1 不同浓度MIBG 处理HepG2 细胞后MTT 法测量A 值以及细胞存活率Table 1 Effects of different concentration of MIBG on cell growth and cell survival rate in human HepG2 detected by MTT(±s,n=3)
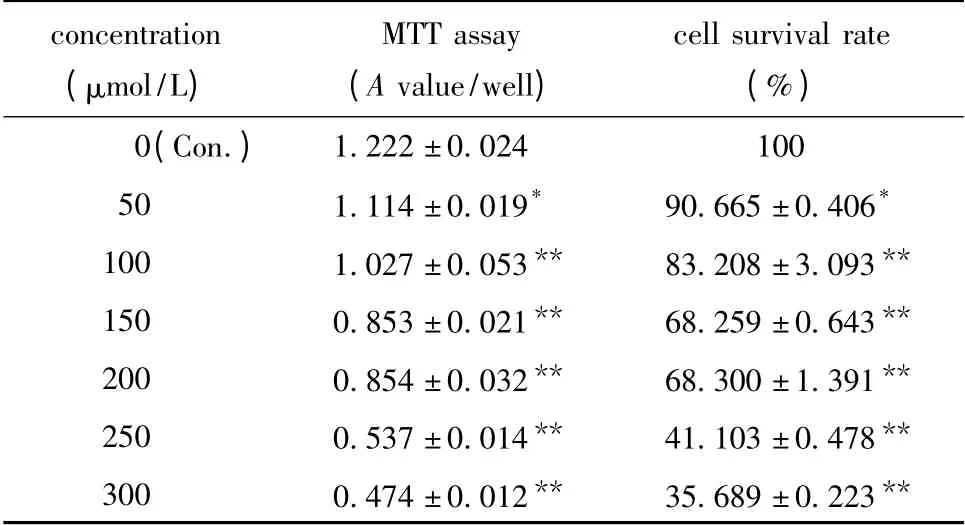
表1 不同浓度MIBG 处理HepG2 细胞后MTT 法测量A 值以及细胞存活率Table 1 Effects of different concentration of MIBG on cell growth and cell survival rate in human HepG2 detected by MTT(±s,n=3)
*P<0.05,**P<0.01 compared with control group.
concentration(μmol/L)MTT assay(A value/well)cell survival rate(%)0(Con.)1.222 ±0.024100 501.114 ±0.019*90.665 ±0.406*1001.027 ±0.053**83.208 ±3.093**1500.853 ±0.021**68.259 ±0.643**2000.854 ±0.032**68.300 ±1.391**2500.537 ±0.014**41.103 ±0.478**3000.474 ±0.012**35.689 ±0.223**
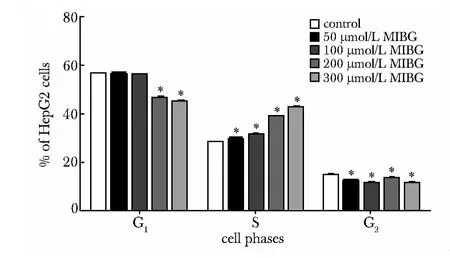
图3 不同浓度MIBG 对HepG2 细胞周期的影响Fig 3 Effects of different concentration of MIBG on HepG2 cell cycle phases(±s,n=3)
3 讨论
单腺苷二磷酸核糖基化有4 种类型,而精氨酸特异性单腺苷二磷酸核糖基化作用是其中最重要的一种[1]。目前,关于精氨酸特异性单腺苷二磷酸核糖基化功能的生物学研究主要在结肠癌以及平滑肌细胞。精氨酸特异性单腺苷核糖基化作用能够影响结肠癌侵袭转移以及参与肿瘤细胞凋亡过程[4-5]。因此,通过使用精氨酸特异性单腺苷核二磷酸糖基化转移酶抑制剂MIBG,来探究其是否具有抑制肿瘤细胞增殖的作用。
催化精氨酸特异性单腺苷二磷酸核糖基化作用的ARTs 目前已发现多种亚型,不同的亚型在不同种属和部位分布各不同。在目前已知的5 种ARTs中,只有ART1,2 和5 具有精氨酸特异性单腺苷核糖基化转移酶的催化位点。因为ART2 在人类体内尚未发现,ART5 主要富集于睾丸中[6]。所以,初步推测在人体内ART1 是催化精氨酸特异性单腺苷二磷酸核糖基化作用的主要酶。

图4 蛋白印记实验检测各组中ART1,RhoA,c-myc,cyclinA1 蛋白表达水平Fig 4 The expressions of ART1,RhoA,c-myc,cyclin A1 proteins in HepG2 cells in different groups were respectively detected by Western blot(±s,n=3)
首先,通过细胞免疫荧光显示ART1 在HepG2细胞具有高表达,该结果提示HepG2 细胞中具有精氨酸特异性单腺苷二磷酸核糖基化这一蛋白质翻译后修饰作用。再通过功能实验MTT 以及流式细胞周期的分析表明,精氨酸特异性单腺苷二磷酸核糖基化抑制剂MIBG 能够抑制肝癌HepG2 细胞增殖,且主要是阻滞在S 期。
RhoA 蛋白是Rho 蛋白中最具代表性的一种,其也属于Ras 家族蛋白中一员。具有激活和失活两种状态,可通过Rho/RhoA 激酶(Rho kinase,ROCK)通路将胞膜信号传导至胞核,从而调节c-myc 基因的表达[7-8]。c-myc 可以激活cyclin A 蛋白的表达[9]。细胞周期的调控主要由细胞周期素cyclins和细胞周期蛋白依赖性激酶(cyclin-dependent protein kinases,CDKs)这两类蛋白家族调控。cyclin A1在细胞周期S 期调节中起着关键作用[10]。
研究证明小鼠结肠癌细胞ART1 基因沉默后,精氨酸单腺苷二磷酸核糖基化作用减弱,RhoA 的表达活化水平降低。从而影响到ROCK 细胞信号通路,引起下游c-myc 的表达降低,可抑制小鼠结肠癌细胞的增殖[11]。
为了探究MIBG 抑制HepG2 细胞增殖的机制,进一步检测了ART1,RhoA、c-myc、cyclinA1 的表达。结果显示,加入MIBG 后的HepG2 细胞ART1、RhoA、c-myc 和cyclinA1 表达水平降低。提示RhoA通路参与调节了肝癌HepG2 细胞增殖过程。通过加入MIBG 后,降低了ART1 表达水平和RhoA 的活化水平,进一步下调细胞核内c-myc 蛋白的表达水平,减低了cyclinA1 的表达。从而使HepG2 细胞发生S 期阻滞,增殖受到抑制。
本实验发现MIBG 对人肝癌HepG2 细胞增殖具有抑制作用,为临床肝癌治疗和药物研究提供了新的靶点。MIBG 对其他肿瘤细胞增殖影响以及在其他生物学行为如凋亡、侵袭转移等的影响以及是如何调控ART1 表达下调的机制还有待进一步研究。
[1]Laing S,Unger M,Koch-Nolte F,et al.ADP-ribosylation of arginine[J].Amino acids,2011,41:257-269.
[2]Loesberg C,Smets L A.Meta-iodobenzylguanidine (MIBG),a novel high-affinity substrate for cholera toxin that interferes with cellular mono (ADP-ribosylation)[J].BBA-Protein Struct M,1990,1037:92-99.
[3]Lorraine Y,Brenda L,Shawn T,et al.Endogenous mono-ADP-ribosylation mediates smooth muscle cell proliferation and migration via protein kinase N-dependent induction of c-fos expression[J].Biochem,2003,270,101-110.
[4]宋光林,唐怡,王娅兰,等.ART1 基因沉默对小鼠结肠癌CT26 细胞转移潜能的影响及作用机制的研究[J].肿瘤,2013,33:490-496.
[5]Xiao M,Tang Y,Wang YL,et al.ART1 silencing enhances apoptosis of mouse CT26 cells via the PI3K/Akt/NF-κB pathway[J].Cell Physiol Biochem,2013,32:1587-1599.
[6]Zolkiewska A.Ecto-ADP-ribose transferases:cell-surface response to local tissue injury[J].Physiol,2005,20:374-381.
[7]Buchsbaum R J.Rho activation at a glance[J].J Cell Sci,2007,120:1149-1152.
[8]Satoh K,Fukumoto Y,Shimokawa H.Rho-kinase:important new therapeutic target in cardiovascular disease[J].Am J Physiol Heart Circ Physiol,2011,301:287-296.
[9]Pidder J,Albrecht M,Philipp S,et al.differential modulation of cyclin gene expression by MYC[J].Cell Biol,1993,90:3685-3689.
[10]Zhang KZ,Zhou XL,Liu JZ,et al.β-diketone-cobalt complexes inhibit DNA synthesis and induce S-phase arrest in rat C6 glioma cells[J].Oncol Lett,2014:881-885.
[11]徐剑侠,王娅兰,唐怡,等.ARN 干扰ART1 表达对小鼠结肠癌细胞增殖的影响及其机制探讨[J].肿瘤,2012,32:949-954.
