P38-2G4蛋白在红系细胞分化过程中的动态表达分析
2014-11-28施鸣铭杨祖立朱晓芳郑雅娟张世馥
施鸣铭,杨祖立,朱晓芳,郑雅娟,张世馥
(浙江理工大学 生命科学学院 蛋白质组学与分子酶学实验室, 浙江 杭州 310018)
研究论文
P38-2G4蛋白在红系细胞分化过程中的动态表达分析
施鸣铭,杨祖立,朱晓芳,郑雅娟,张世馥*
(浙江理工大学 生命科学学院 蛋白质组学与分子酶学实验室, 浙江 杭州 310018)
目的分析小鼠P38-2G4蛋白在红系细胞分化中的表达及功能,初步研究该蛋白是否参与红系分化过程。方法制备E10.5~E16.5胎肝细胞、FVA细胞及诱导剂丁酸钠和六亚甲基二乙酰胺诱导不同时间的小鼠红白血病细胞MEL,用Western blot检测P38-2G4蛋白在上述3种细胞中的表达,同时以联苯胺染色法检测细胞分化的标志蛋白血红蛋白的表达。结果在不同分化期的胎肝细胞中,P38-2G4蛋白的表达先升高后降低;在FVA细胞分化过程中,P38-2G4表达量同样先增加后减少;而在诱导剂诱导MEL细胞分化过程中,P38-2G4表达量呈下降趋势。结论P38-2G4蛋白在不同红系分化组织中的差异性表达提示该蛋白参与了小鼠红系细胞的分化过程。
P38-2G4;胎肝;FVA细胞;诱导分化;红系分化
小鼠P38-2G4蛋白属增殖相关蛋白家族(proliferation-associated protein 2G4, PA2G4),是细胞周期特异性调节的DNA结合蛋白[1],目前对其研究较少。肝脏是胚胎时期主要的造血器官,小鼠E12~E15[2]和人胚胎6周至4月是胎肝造血活跃期。小鼠尾静脉注射小鼠致贫血病毒(anemia-inducing strain of Friend virus, FVA)后,其脾脏中红系细胞发育被同步阻滞在原红细胞时期,称为FVA细胞[3]。该细胞在体外促红细胞生成素(erythropoietin, EPO)存在培养下可进入终末分化。小鼠红白血病细胞(mouse erythroleukemia, MEL)在多种诱导剂作用下可发生恶性逆转并向正常方向分化。
本研究前期发现P38-2G4蛋白在胎肝红系分化过程中存在差异性表达,推测其参与小鼠红系分化过程。本实验拟通过胎肝细胞、FVA细胞及诱导分化细胞中P38-2G4蛋白的表达,探索其是否参与红系细胞分化过程,为进一步研究P38-2G4在红系分化过程中的作用奠定实验基础。
1 材料与方法
1.1 动物和细胞
MEL、K562和HL-60细胞(中国医学科学院基础医学研究所细胞中心)。小鼠致贫血病毒FVA(ATCC)。清洁级,6~8周龄,体质量25 g左右的ICR(Institute of Cancer Research)小鼠和20 g左右的BALB/C小鼠[杭州师范大学实验动物中心,SCXK(浙2011-0048)]。
1.2 试剂
六甲基双乙酰胺(HMBA,Sigma公司),丁酸钠(SB,Sigma公司),IMDM培养基(Gibco公司),胎牛血清(FBS,Hyclone公司),促红细胞生成素(EPO,R&D公司),α-硫代甘油(Sigma公司),L-谷氨酰胺(Sigma公司),牛血清白蛋白(BSA,Sigma公司),联苯胺(中国远航试剂公司),兔抗小鼠P38-2G4抗体(Abcam公司,ab33613),羊抗兔IgG单克隆抗体(Earthox公司),Western bright ECL底物发光试剂盒(Advansta公司)。
1.3 方法
1.3.1 细胞培养及细胞样品的制备:MEL细胞培养于含10%胎牛血清DMEM培养基中,37 ℃,5% CO2饱和湿度下培养,第2~3天传代1次,取对数增殖期细胞用于实验。收集细胞,1 000r/min离心10 min,弃上清,PBS洗3次,1×107细胞加入1 mL细胞裂解液,置冰上30 min。4 ℃,12 000r/min,离心30 min,取上清备用。HL-60,K562细胞同样处理。
1.3.2 小鼠组织样品的制备:ICR小鼠颈椎脱臼处死,取小鼠骨髓、脑、胃、小肠、肾、肺、脾、肝和心脏等组织,用D-Hank’s缓冲液冲洗3次,剪碎后放入微量匀浆器中,按0.1 kg/L加入细胞裂解液,置冰上30 min,4 ℃,12 000r/min,离心45 min,收集上清,备用。
1.3.3 胎肝样品的制备:怀孕E10.5~E16.5 ICR小鼠颈椎脱臼处死,分离胎肝组织于D-Hank’s缓冲液中。制成单细胞悬液,D-Hank’s缓冲液洗2次,室温25 ℃,1 000r/min,离心10 min,重悬于D-Hank’s缓冲液中。
1.3.4 FVA细胞的分离和培养:给BALB/C小鼠尾静脉注射病毒10~14 d左右,颈椎脱臼处死,取脾脏制成单细胞悬液,D-Hank’s缓冲液洗2次,室温,1 000r/min,离心10 min,重悬于含30% 胎牛血清,0.1% 牛血清白蛋白,10-4mol/L α-硫代甘油,2 mmol/L谷氨酰胺的IMDM培养基中。锥虫蓝染色计数,FVA细胞按1×109/L接种于培养瓶中,实验组加入200 IU/L EPO,37 ℃,5% CO2饱和湿度下培养。
1.3.5 细胞的诱导分化:取对数增殖期MEL细胞以3×107/L浓度接种于细胞瓶,加入丁酸钠(1.25 mmol/L)或六甲基双乙酰胺(3 mmol/L)诱导细胞。同时设置不加药的对照组,分别培养1~5 d。
1.3.6 联苯胺染色检测血红蛋白:分别收集培养1~5 d的实验组和对照组细胞,室温,1 000r/min,离心3 min;弃上清,0.85 %氯化钠溶液洗1次,加入预混的联苯胺染液(30% H2O2:0.04%联苯胺染液1∶40, v∶v),滴片镜检、拍照。
1.3.7 Western blot检测P38-2G4表达:收集各组样品,提取细胞总蛋白,采用Bradford法进行蛋白浓度测定。取适量总蛋白,用12%十二烷基磺酸钠-聚丙烯酰胺凝胶进行蛋白电泳,将蛋白样品转移至聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉室温封闭2 h。分别加入抗小鼠P38-2G4多克隆抗体(1∶20 000)和抗小鼠β-actin(1∶10 000),4 ℃孵育过夜,洗涤缓冲液TBST洗膜后加入羊抗兔(1∶20 000)二抗(含辣根过氧化物酶标记),37 ℃孵育2 h,TBST洗膜后化学发光法进行显色反应。对条带进行灰度扫描,以目的蛋白灰度值/内参蛋白灰度值比值计算不同样品的目的蛋白表达量差异。
2 结果
2.1 P38-2G4蛋白的小鼠组织表达谱
取小鼠的脑、胃、小肠、肾、肺、脾、肝和心等组织,检测P38-2G4在小鼠组织中的表达(图1)。

图1 P38-2G4蛋白在小鼠组织表达Fig 1 P38-2G4 expresses in different tissues of mouse
2.2P38-2G4蛋白在不同白血病细胞及正常造血细胞中的表达
收集K562、MEL、HL-60肿瘤细胞样品,小鼠骨髓为正常造血细胞样品,进行Western blot(图2)。K562、HL-60、MEL细胞中P38-2G4的表达量分别是骨髓细胞的3.39、2.65和2.33倍。
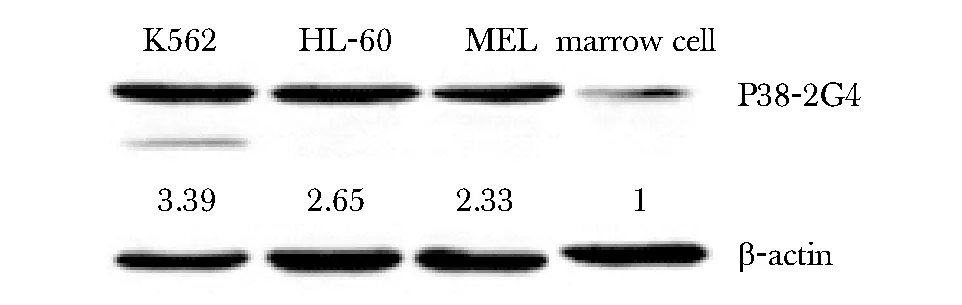
图2 P38-2G4蛋白在白血病细胞和骨髓细胞中的表达Fig 2 P38-2G4 expresses in leukemia cells and marrow cells
2.3不同发育期的胎肝中P38-2G4蛋白的差异性表达
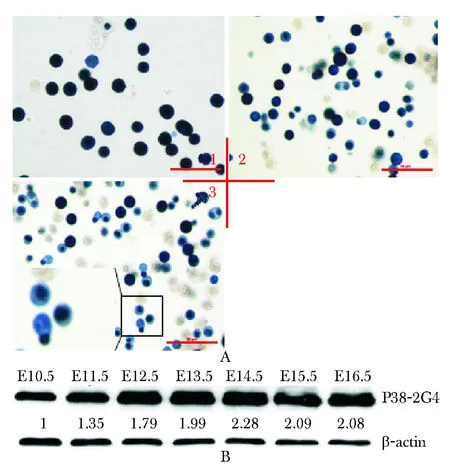
A.the benzidine staining of fetal liver cells in different days; B.the expression of P38-2G4 from E10.5 to E16.5; 1.E10.5 fetal liver; 2.E13.5 fetal liver; 3.E16.5 fetal liver, it shows karyopyknosis and enucleation(×600)图3 不同发育期胎肝细胞的联苯胺染色与Westernblot检测P38-2G4蛋白表达结果Fig 3 The benzidine staining and Western blot result of fetal liver cells at different development stages
对小鼠E10.5,E13.5,E14.5胎肝进行联苯胺染色,胎肝中的红系祖细胞出现体积缩小,细胞核固缩,排核等分化特征(图3A)。取E10.5~E16.5的胎肝总蛋白进行Western blot,检测P38-2G4蛋白在不同发育期的胎肝中的表达情况(图3B)。
2.4FVA细胞红系分化时P38-2G4蛋白的表达差异
在200 IU/L EPO条件下培养FVA细胞,出现红系终末分化特征,如细胞体积减小,细胞核减小,核固缩等(图4A)。Western blot检测发现P38-2G4蛋白在FVA细胞中的表达也存在差异性(图4B)。

A.the benzidine staining of FVA cell differentiating induced by EPO; B.the expression of P38-2G4 during differentiation; 1.the 2nd hour of FVA cells induced by EPO, it shows karyopyknosis; 2.the 12th hour of FVA cells induced by EPO; 3.the 24th hour of FVA cells induced by EPO, it shows enucleation; 4.the 36th hour of FVA cells induced by EPO(×600)图4 EPO诱导FVA细胞分化过程的联苯胺染色和Western blot检测P38-2G4蛋白表达结果Fig 4 The benzidine staining and Western blot result of FVA cells induced by EPO
2.5诱导分化细胞中P38-2G4蛋白的差异性表达
利用丁酸钠(sodium butyrate,SB)和六亚甲基二乙酰胺(N,N′-Hexamethylenebisacetamide,HMBA)诱导MEL细胞向红系方向分化。SB可有效诱导MEL细胞向红系方向发生定向分化,合成血红蛋白,且核质比减小(图5A)。而在SB诱导MEL分化过程中,P38-2G4蛋白表达量呈逐渐递减趋势,120 h细胞P38-2G4表达量为0 h细胞的0.41倍(图5B)。同样, 用HMBA诱导MEL向红系方向分化,Western blot检测分化过程中P38-2G4的表达,结果也呈逐渐递减趋势(图5C)。

A.the benzidine staining of MEL induced by SB; B.the expression of P38-2G4 during differentiation induced by SB; C.the expression of P38-2G4 during differentiation induced by HMBA; 1.the 72th hour of MEL; 2.the 96th hour of MEL; 3.the 72th hour of MEL induced by SB; 4.the 96th hour of MEL induced by SB(×200)
图5诱导剂诱导MEL分化过程的联苯胺染色和Westernblot检测P38-2G4蛋白表达结果
Fig5ThebenzidinestainingandWesternblotresultofMELinducedbyinducer
3 讨论
P38-2G4是一种DNA结合蛋白,属增殖相关蛋白家族,目前对其功能尚不十分清楚。本实验前期利用双向凝胶电泳-质谱分析胎肝红系分化过程时发现P38-2G4蛋白存在差异性表达,由此推测该蛋白可能参与红系分化过程。
结果显示,P38-2G4蛋白在小鼠脑、胃、小肠、肾、肺、肝和心脏等组织中差异性表达,且在肝组织中表达量最高,提示该蛋白可能与造血功能相关;而在K562、HL-60、MEL 3种白血病细胞中,P38-2G4蛋白表达量高于骨髓细胞2~3倍,这表明P38-2G4在正常组织和肿瘤细胞中具有不同功能,并且与细胞的癌变相关。
胎肝细胞的联苯胺染色及形态学观察结果显示,E10.5细胞已有血红蛋白生成,细胞逐渐发生核固缩,并出现排核现象。Western blot结果显示,P38-2G4蛋白从E10.5开始增加,E14.5达到E10.5的2.28倍,至E15.5开始下降(图3B)。小鼠胎肝E12到E15为造血活跃期[2],而P38-2G4蛋白的高表达正处于该时期,因此说明P38-2G4参与胎肝细胞的红系分化过程。
FVA细胞联苯胺染色结果显示,在EPO存在条件下,FVA细胞向红系方向分化,开始表达血红蛋白,细胞核发生固缩、偏位。Western blot结果显示,P38-2G4蛋白在2 h(原幼红细胞)和12 h(早幼红细胞)的表达量是0 h的1.21倍和1.11倍,随后开始下降(图4B),这种差异性表达说明P38-2G4参与了FVA细胞的红系分化过程。
SB作为一种去乙酰化酶抑制剂,能够提高组蛋白乙酰化水平,诱导MEL细胞向红系方向分化。HMBA通过使细胞阻滞于G1期,抑制细胞增殖,诱导细胞分化[4]。本文利用两种诱导剂分别诱导MEL细胞分化,结果显示两种药物诱导过程中,P38-2G4蛋白的表达量均被下调,且SB诱导过程中下调趋势更明显(图5B,C)。这表明,P38-2G4蛋白确实参与了红系分化过程。
据报道,Ebp1是一种人类增殖相关蛋白,与小鼠P38-2G4蛋白同源,两者结构相似,仅存在4个氨基酸残基差异。Ebp1具有p42和p48两种亚型,有不同的组织和功能特异性[5],可通过促进或抑制细胞增殖参与多种细胞的分化过程[6- 9]。因此推测,P38-2G4蛋白可能同样通过增殖参与红系细胞的分化。
综上所述,P38-2G4蛋白在正常组织和癌变细胞中具有不同的功能,且参与多种红系分化过程,但具体机制任有待深入研究。
[1] Nakagawa Y, Watanabe S, Akiyama K,etal. Cdna cloning, sequence analysis and expression of a mouse 44-kda nuclear protein copurified with DNA repair factors for acid-depurinated DNA[J]. Acta Medi Okayama, 1997, 51: 195- 206.
[2] Morrison S J, Hemmati H D, Wandycz A M,etal. The purification and characterization of fetal liver hematopoietic stem cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92: 10302- 10306.
[3] Koury M, Sawyer S, Bondurant M. Splenic erythroblasts in anemia‐inducing friend disease: A source of cells for studies of erythropoietin‐mediated differentiation[J]. J Cell Physiol, 1984, 121: 526- 532.
[4] 王钦红, 范华骅, 陈勤奋等. 六亚甲基二乙酰胺体外诱导HL-60 细胞分化的机制[J]. 复旦学报:医学版, 2004, 1- 4.
[5] Squatrito M, Mancino M, Donzelli M,etal. Ebp1 is a nucleolar growth-regulating protein that is part of pre-ribosomal ribonucleoprotein complexes[J]. Oncogene, 2004, 23: 4454- 4465.
[6] Lessor T J, Yoo J Y, Xia X,etal. Ectopic expression of the erbb-3 binding protein ebp1 inhibits growth and induces differentiation of human breast cancer cell lines[J]. J Cell Physiol, 2000, 183: 321- 329.
[7] Ishimaru D, Ramalingam S, Sengupta T K,etal. Regulation of bcl-2 expression by hur in hl60 leukemia cells and a431 carcinoma cells[J]. Mol Cancer Res: MCR, 2009, 7: 1354- 1366.
[8] Kim C K, Nguyen T L, Joo K M,etal. Negative regulation of p53 by the long isoform of erbb3 binding protein ebp1 in brain tumors[J]. Cancer Res, 2010, 70: 9730- 9741.
[9] Oh S M, Liu Z, Okada M,etal. Ebp1 sumoylation, regulated by tls/fus e3 ligase, is required for its anti-proliferative activity[J]. Oncogene, 2010, 29: 1017- 1030.
Analysis of dynamic expression of P38-2G4 during erythroid cells differentiation
SHI Ming-ming, YANG Zu-li, ZHU Xiao-fang, ZHENG Ya-juan, ZHANG Shi-fu*
(Lab of Proteomics and Molecular Enzymology, College of Life Science, Zhejiang Sci-Tech University, Hangzhou 310018, China)
ObjectiveAnalysis of the expression and function of mouse P38-2G4 protein in the differentiation of erythroid cells, and to find whethere P38-2G4 is involved in the differentiation of erythroid.MethodsThe expressions of P38-2G4 in fetal liver from E10.5 to E16.5, FVA cells and MEL cells induced by SB and HMBA were detected by Western bolt. The hemoglobin as a marker protein of erythroid cell differentiation was detected by benzidine staining.ResultsThe expression of P38-2G4 in fetal liver cells of different differentiating stages increased at first and then decreased; the expression of P38-2G4 during FVA cells differentiating had a same trend; but decreased during inducing.ConclusionsDifferential expression of P38-2G4 in different erythroid differentiation shows that P38-2G4 is involved in mouse erythroid differentiation.
:P38-2G4; Fetal liver; FVA cell; inducing differentiation; erythroid differentiation
2013- 01- 15
2014- 03- 24
*通信作者(correspondingauthor):cklzhan@163.com
1001-6325(2014)09-1245-05
Q 291
A
