L-核糖柱色谱分离提纯工艺优化研究
2014-03-15周俊俊胡景辉曹晓伟李园园
周俊俊胡景辉曹晓伟李园园
1(郑州拓洋实业有限公司郑州450000)
2(惠生工程(中国)有限公司河南化工设计院分公司 郑州 450000)
核糖及其衍生物脱氧核糖是核酸的重要组成部分,也是某些维生素及辅酶的组分。D-核糖及其衍生物以呋喃型广泛存在于天然化合物中,而D-核糖的对映体L-核糖在自然界不存在,一般只能通过合成的方法得到。核糖核苷及脱氧核糖核苷是一类重要的抗病毒剂,近年来L-核糖及衍生物在医药中的应用报道日益增加[1-2]。其原因是L-核糖核苷具有显著的抗病毒活性,而毒性却比D-核糖核苷低。一些L-核糖及衍生物2-脱氧-L-核糖与腺嘌呤等有机碱形成的核苷衍生物在癌症、乙肝等疾病的治疗方面具有极大的应用潜力,许多化合物正处于开发及应用中,L-核糖部分修饰的低聚核苷酸还可以用来设计高效抗过敏药物分子。因此L-核糖及衍生物脱氧核糖的合成,是一个在有机合成中富有挑战性的课题,该方面的开发与研究十分活跃,已报道的L-核糖的合成方法有化学合成法与微生物合成法。化学合成法研究较早,近年来也有较多的报导,微生物合成法近年来也引起人们极大的兴趣。
微生物法是合成L-核糖及其它碳水化合物的新途径,近年来引起人们的广泛兴趣[3-4]。原料葡萄糖在微生物的作用下发酵,转化为核糖醇,含有核糖醇的发酵液,又通过弗式葡萄糖杆菌的作用氧化为L-核酮糖,L-核酮糖溶液再通过凝胶纤维单胞菌的作用下,异构化为L-核糖,粗产品溶液蒸发浓缩,采用阳离子交换树脂处理,再经脱盐,脱色和结晶,得到L-核糖,一般产品纯度可达99%,分离回收率为56%。本文在上述工艺的基础上,添加钙型色谱树脂柱GSPC-106Ca色谱分离工序,对L-核糖进一步分离提纯,重点考察不同的因素及操作条件对L-核糖分离纯化的影响。
一、实验试剂与方法
1.实验试剂
L-核糖超滤溶液(生产制备)、钙型色谱树脂GSPC-106Ca、去离子水、超纯水
2.仪器
岛津LC-10A液相色谱仪、超声波清洗器、超纯水机、有夹层的玻璃柱、电子分析天平、量筒、恒温水浴锅
二、实验方法
本文选择的离子交换柱为一根长2m,内径4cm的带有夹套的玻璃柱,柱内填充新购钙型色谱树脂GSPC-106Ca,L-核糖超滤溶液从柱子上方进入,然后用去离子水洗脱,柱子下方用量筒每隔100mL取样检测其纯度与含量。
树脂体积为2000mL,我们调节不同的柱温(40℃、50℃、60℃、70℃)、不同的进样量(100g、150g、200g、250g),不同的进样浓度(40%、45%、50%、60%),不同的洗脱速度(10mL/min、20mL/min、30mL/min),用去离子水洗涤,收集L-核糖纯度95%以上的糖液。
正交实验设计方案
为了确立最佳分离条件,首先进行几个基本分离条件的实验,确立了对分离回收率影响较大的几个因素,见表1。

表1 正交实验的因子水平表
三、正交实验结果及讨论
1.正交实验结果
通过上述一系列单因素实验结果,我们设计了L9(34)的正交试验,最终根据收率确定最佳工艺条件,其因素水平见表2。
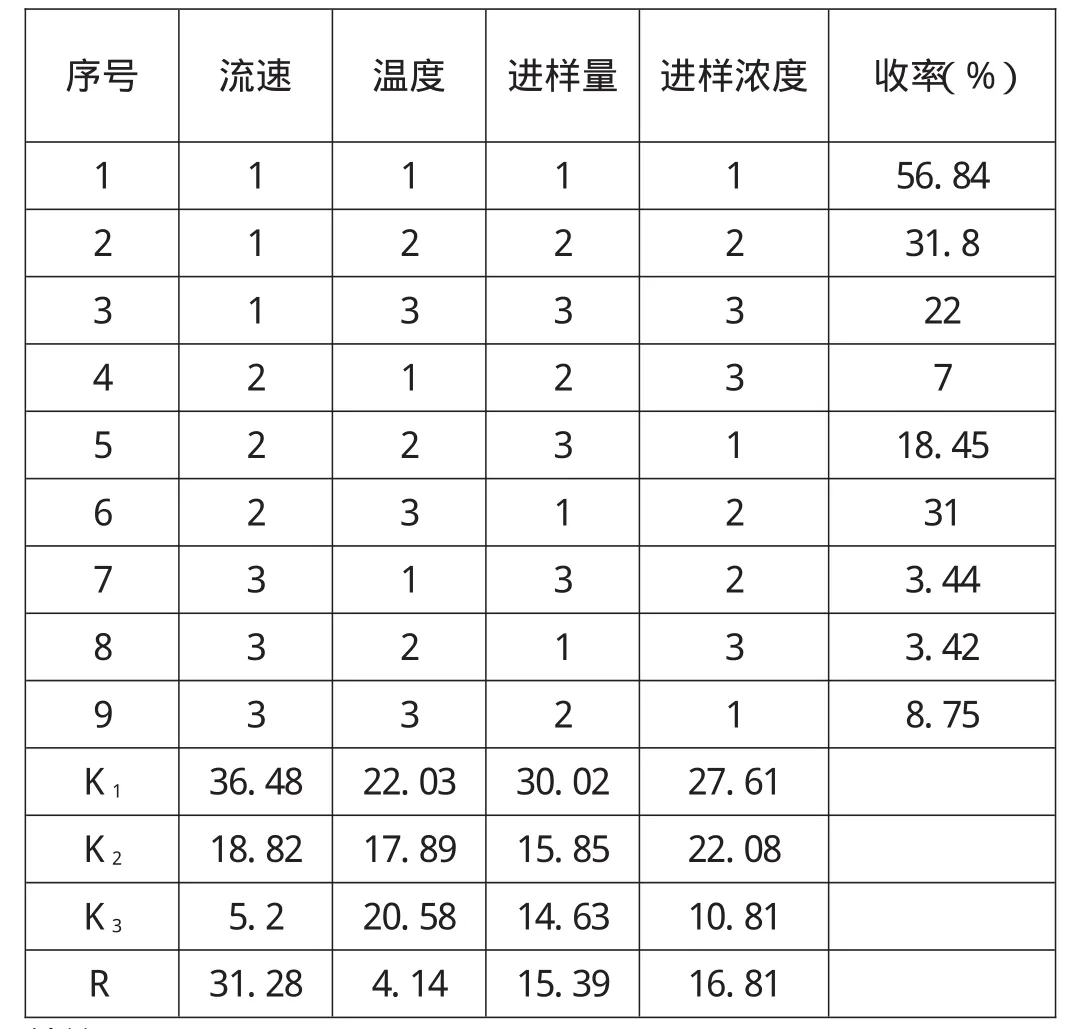
表2 正交实验结果
结论
从表中可以看到四个因素对收率的影响主次为:流速>进样浓度>进样量>温度;最佳条件:流速10mL/min,温度50℃,进样量150g,进样浓度40%,
实验表明,在最佳实验条件下,L-核糖的回收率最高到达56.84%,纯度99.6%。
[1]Chu.C.K.;Ma.T.W.;Shanmuganathan,K.Anturacmb.Agents.Chemother.1995,39(4),979.
[2]Varaprasad.C.V.;Averelt,D.;Ramasamy,K.S.Tetrahedron.1999,55,13345.
[3]Ahmed,Z.;Shimonislu,T.;Bhuiyan.S.H.J.Btosci.Bioeng.1999,88(4),444.
[4]Kawaguchi,T.;Hara.M.;Ueda,M.JPⅡ332591.1999[Chem.Ab⁃str.1999,132,2821m].
