白藜芦醇二聚体与眼镜蛇神经毒素的作用机制*
2014-03-15叶勇邢海婷郭亚
叶勇 邢海婷 郭亚
(华南理工大学化学与化工学院,广东广州510640)
白藜芦醇是存在于许多植物(如虎杖、葡萄)中的一种二苯乙烯化合物,具有抗肿瘤、抗艾滋病、抗炎镇痛及雌激素样作用等多种药理活性[1-3].它对光敏感,紫外光可诱发其聚合[4].笔者所在课题组的前期研究也证实,波长365nm的入射光照射导致了白藜芦醇二聚体的形成[5].白藜芦醇二聚体在抗菌、抗病毒、抗氧化和抗肿瘤等方面的效果均优于白藜芦醇单体,因而成为人们关注的焦点[6-7].眼镜蛇神经毒素(NT)是从眼镜蛇毒中分离出的一种多肽,具有中枢镇痛作用[8];但由于NT相对分子质量较大,难以进入中枢,起效慢[9].白藜芦醇相对分子质量小,可以进入中枢,起效快,但作用时间短[10].如果能将白藜芦醇与NT联合给药,可以取长补短,发挥更好的镇痛作用.为了探讨白藜芦醇及其二聚体与NT的相互作用,文中通过分子模拟和光谱法分析了两者的相互作用,并对其作用机制进行了探讨,以期为实现两者的联合用药、提升临床镇痛效果提供技术和理论支撑.
1 实验
1.1 主要试剂和仪器
白藜芦醇(纯度≥99%,批号20120821),购自广州菲博生物科技有限公司;眼镜蛇神经毒素,由笔者所在实验室从眼镜王蛇(Naja ophiophagus hannah)毒中分离获得;其他试剂均为分析纯试剂.
F-4500型荧光分光光度计(日本日立公司生产);UV-2450紫外可见光谱仪(日本岛津公司生产);5mW点状激光器(东莞三鼎光电公司生产).
1.2 分子作用模拟
采用 Discovery Studio软件进行分子对接模拟[11],具体模拟流程如下:从 Brookhaven蛋白库(http:∥www.rcsb.org/pdb/home/home.do)中下载眼镜蛇神经毒素的pdb文件,打开后进行预处理,除去水分子,整理并补充调整文件中蛋白的氨基酸残基和补充氢,施加力场;将眼镜蛇神经毒素定义为受体,定义结合位点、找到结合空穴,然后定义结合球,确定结合区域坐标;将白藜芦醇及其二聚体结构导入软件绘图窗,优化化合物的几何三维结构;接着施加力场并进行能量优化,确保配基的键长、键能、键角是正确的且处于能量稳定状态[12].分子对接时,采用分子对接程序,将眼镜蛇神经毒素分子选为受体,白藜芦醇及其二聚体选为配体,选择结合区域坐标,运行程序.完成后在结果中可获得结合能等多项参数,进行比较.
1.3 紫外-可见光吸收曲线和荧光光谱测定
将NT用0.1 mol/L、pH=7.4的磷酸盐缓冲液配制成浓度为1.0×10-5mol/L的缓冲溶液.取5mL NT缓冲溶液6份,分别加入0、0.5×10-4、1× 10-4、2×10-4、4×10-4、8×10-4mol/L的白藜芦醇溶液1 mL,在室温下采用波长365 nm的激光照射10~50min.以缓冲液为空白扫描250~500 nm范围内的紫外-可见光吸收曲线;并以275nm为激发波长,在狭缝5nm的条件下,扫描300~500nm范围内NT与白藜芦醇的荧光光谱.
1.4 同步荧光扫描
将激发波长与发射波长间保持固定的波长间隔,来扫描和记录激发波长的变化.白藜芦醇与NT的浓度与1.3节中相同,以波长365nm的激光照射20min,分别扫描波长间隔Δ为15、60 nm的同步荧光光谱.
2 结果与讨论
2.1 白藜芦醇二聚体和NT的分子结构
表1所示为白藜芦醇及其二聚体和NT的分子结构.白藜芦醇分子结构中含有酚羟基和一个双键,分子间易发生羟基间缩合脱水或双键加成,从而形成二聚体.表1中列举的自然界存在的6种二聚体,其结合方式各不相同.NT的相对分子质量为8000,含有73个氨基酸和5个S—S键[13].

表1 白藜芦醇及其二聚体和NT的分子结构Table 1 Molecular structures of resveratrol,dimer and NT
2.2 白藜芦醇二聚体与NT的相互作用
评价分子间相互作用通常以对接能和对接交互作用能为标准,对接能的绝对值越大,证明受体与底物的对接亲和力越强,同时也预测小分子与受体结合的活性越高;对接交互作用能越高说明受体和配体的作用越强、形成的复合物越稳定.通过软件模拟分子对接后,白藜芦醇二聚体除了(+)-白蔹素A只有4种态势外,其他均以5种态势成功与NT实现对接.其结合能见表2.
由表2可见,除了(+)-白蔹素A与NT对接能绝对值较小外,其他二聚体的对接能绝对值均大于单体对接能的绝对值,表明二聚体更易与NT结合,对NT的作用明显增强.白藜芦醇及其二聚体与NT结合的模拟图如图1所示.由图1可见,相比于白藜芦醇单体,其二聚体与NT连接的基团数明显增多.

表2 白藜芦醇及其二聚体与NT分子的结合能Table 2 Binding energy of resveratrol and dimer with NT
2.3 不同光照时间白藜芦醇与NT作用的紫外-可见光光谱和荧光光谱

图1 白藜芦醇及其二聚体与NT的结合模拟图Fig.1 Binding simulaton of resveratrol and dimer with NT
经过不同时间光照的白藜芦醇-NT体系的紫外可见光谱如图2(a)所示.由图2(a)可见:未经光照时白藜芦醇-NT体系的紫外-可见光谱在214和 305nm处有两个峰,经波长365 nm的光照射后体系的紫外-可见光谱峰形发生了变化;随着光照时间延长,第一个峰逐渐红移至238nm,第二个峰逐渐红移至310nm,吸光度也逐渐增加.对比文献[14]发现,310 nm对应于白藜芦醇二聚体的特征峰,而238nm对应于白藜芦醇二聚体与NT的交互作用峰,这表明365nm光照促进了白藜芦醇二聚体的形成及其与NT的交互作用.
以波长365nm的光照射含一定浓度白藜芦醇的NT溶液,体系的荧光光谱如图2(b)所示.由图2(b)可见,经照射后,白藜芦醇-NT体系的荧光发生了猝灭,且随光照时间延长,猝灭加剧,但最大发射波长没有明显的改变.这说明波长365nm的光促进了白藜芦醇二聚体与NT的相互作用,分子聚合加速了能量转移,但聚合物基本结构没有变化.
2.4 不同浓度白藜芦醇与NT作用后的紫外-可见光谱和荧光光谱
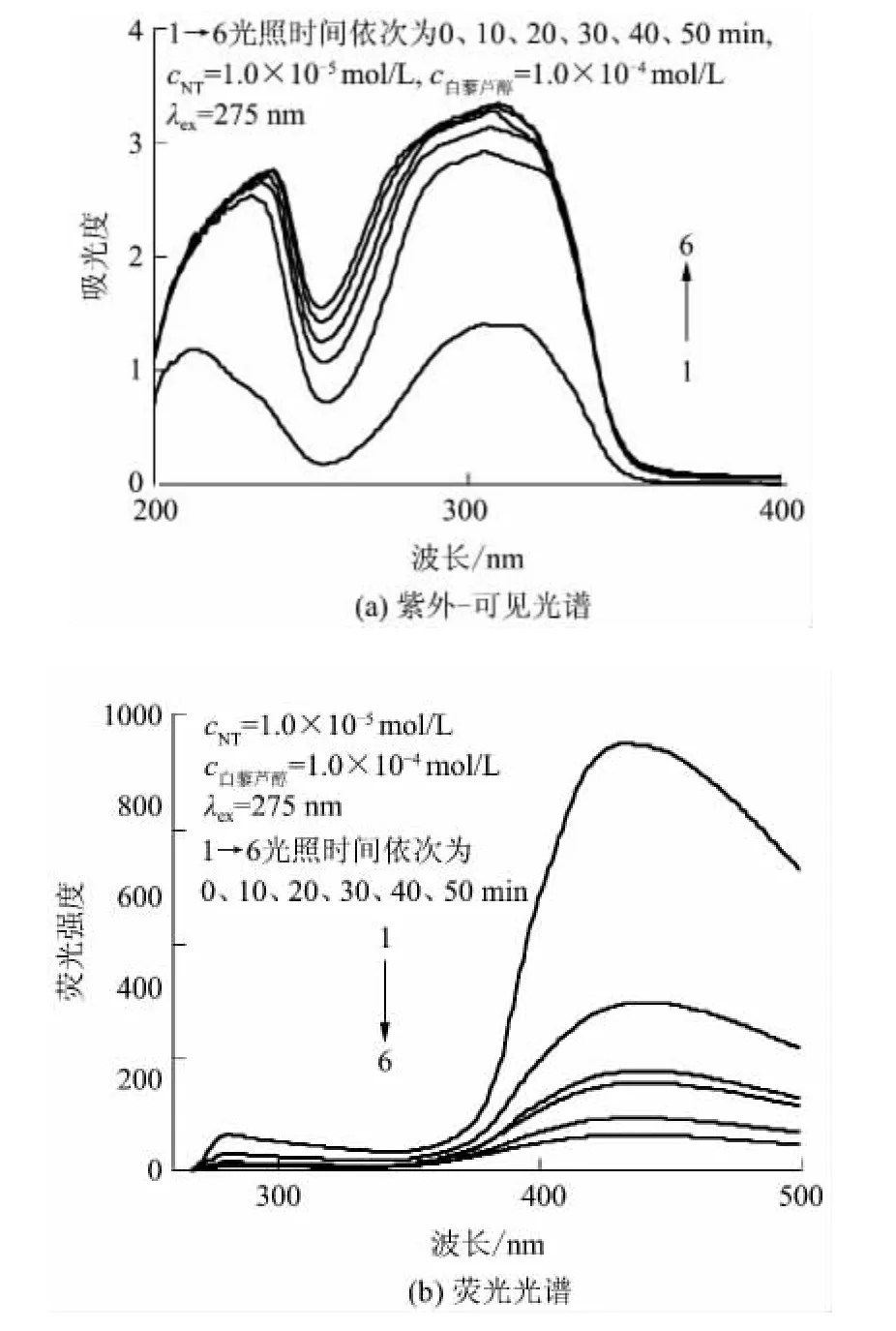
图2 波长365nm的光照射后白藜芦醇-NT体系的紫外-可见光谱和荧光光谱Fig.2 UV-Vis spectra and fluorescence spectra of resveratrol-NT system illuminated by laser at 365nm
以波长365 nm的光照射20 min,考察白藜芦醇浓度对白藜芦醇-NT体系的影响,结果如图3所示.由紫外-可见光谱可见:没有白藜芦醇存在时NT的紫外-可见光谱在211和275nm处有两个峰,加入白藜芦醇后,体系的紫外-可见光谱峰形发生了变化;随着白藜芦醇浓度增大,第2个峰一直保持在310nm,而第1个峰由227nm逐渐红移至233nm,吸收强度也逐渐增加.这表明第2个峰是白藜芦醇二聚体的特征峰,而第1个峰为NT与白藜芦醇二聚体结合物的吸收峰.当增大白藜芦醇浓度时,白藜芦醇二聚体增多,与NT的作用增强.
NT的最大激发光波长为275nm,以此波长的光激发,具有最大发射波长356nm.由图3(b)可见,随着白藜芦醇浓度的增加,NT在356 nm处的荧光强度逐渐降低,表明白藜芦醇对NT具有荧光猝灭聚合作用.荧光光谱中440 nm处出现一峰,且白藜芦醇浓度为1×10-4mol/L时荧光强度最大,表明该峰是NT与白藜芦醇二聚体结合物的荧光发射峰,此浓度为两者的最佳聚合浓度.
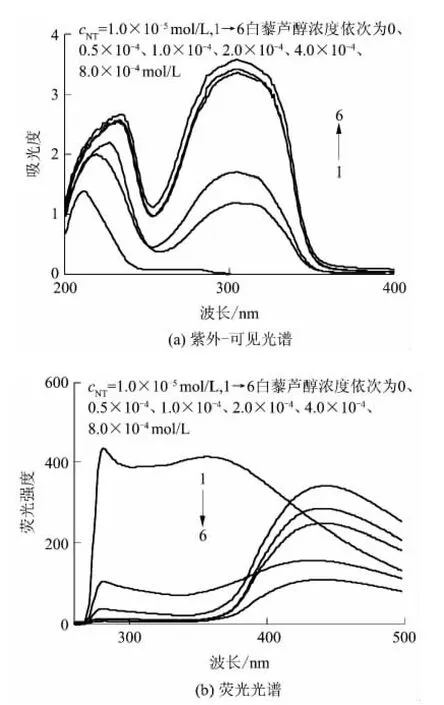
图3 白藜芦醇浓度不同时白藜芦醇-NT体系的紫外-可见光谱和荧光光谱Fig.3 UV-Vis spectra and fluorescence spectra of resveratrol-NT system at different concentrations of resveratrol
2.5 结合参数
采用经典的Stern-Volmer方程[15]进行拟合:

式中:F0和F分别为猝灭剂不存在或存在时的荧光强度;cq为猝灭剂的浓度,mol/L;Kq为猝灭速率常数;0为生物大分子内源性荧光寿命,对于生物大分子其值为10-8s[16].F0/F与cq呈线性关系.应用式(1)计算的Kq为5.62×1012L/(mol·s),其值大大超过生物大分子的最大动态猝灭常数2×1010L/(mol·s)[17],可以认定其为静态猝灭.修正后的方程适合于静态猝灭,故采用如下修正的Stern-Volmer方程[14]来处理数据:
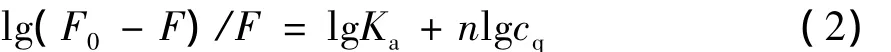
式中,n为荧光猝灭剂结合位点数,Ka为结合常数. lg(F0-F)/F与lgCq呈线性关系.通过计算,获得其结合常数Ka为5.12×105L/mol,结合位点数为1.
根据Förster能量转移理论[18],能量转移效率E与供体受体间距离R以及临界能量转移距离R0之间的关系为
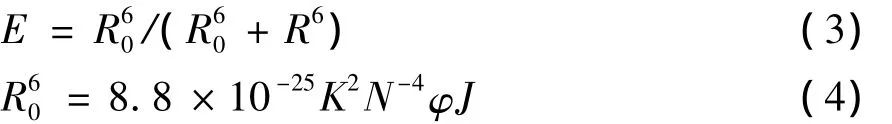
式中,R0为E=50%时供-受体间的距离,K2为偶极空间取向因子,N为介质的折射指数,φ为供体(NT)的量子效率,J为供体(NT)荧光发射光谱与受体(白藜芦醇)吸收光谱的重叠积分.
能量转移效率E由下式求出:
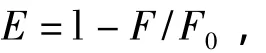
K2取各项随机分布的平均值,即K2=2/3;N取水和有机物的平均值1.336;φ取色氨酸残基的荧光量子效率0.118[19];J可按下式计算:
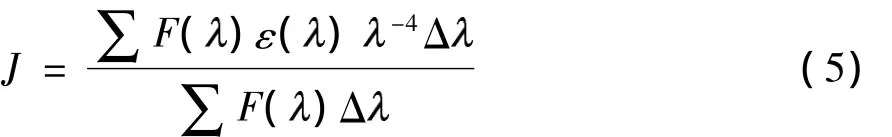
式中,F()为供体在波长 处的荧光强度,ε()为受体在波长 处的摩尔消光系数.
研究中分别测定了NT和白藜芦醇在浓度为1× 10-4mol/L时的荧光发射光谱和紫外-可见光光谱,然后根据式(5)计算两曲线重叠部分的积分,得J= 5.79×10-15cm3·L/mol.将各值代入式(4)可得R0= 2.24nm,通过式(3)可算得R=3.40nm.蛋白的荧光主要来自色氨酸残基[20],所求得的R值为结合部位与该残基之间的距离.结果表明,白藜芦醇与该色氨酸距离较近,容易发生非辐射能量转移.
2.6 同步荧光光谱
同步荧光光谱中不同的固定波长间隔反映了不同荧光基团的特征,因此可借助同步荧光光谱判断药物分子对荧光蛋白质构象的影响.Δ =15 nm时的同步荧光光谱显示了酪氨酸残基的光谱特征,而Δ =60nm的同步荧光光谱显示了色氨酸残基的光谱特征[21].因氨基酸残基的最大发射波长与其所处环境的极性有关,所以通过最大发射波长的改变,可判断蛋白质构象的变化.
固定NT浓度为1.0×10-5mol/L,逐渐增大白藜芦醇浓度,记录扫描波长间隔为15:60nm的同步荧光光谱,结果如图4所示.
由图4可见,随着白藜芦醇浓度的增大,350 nm以下荧光强度逐渐降低;当白藜芦醇浓度不大于1.0×10-4mol/L时,随浓度增大,最大激发波长出现红移(图4(a)中由300nm红移至383nm,图4(b)中由300 nm红移至370 nm);再继续增大白藜芦醇的浓度,最大激发波长维持不变.
上述结果显示:NT与白藜芦醇二聚体结合后构象变化明显,其中酪氨酸和色氨酸残基的亲水性有所增加,这是白藜芦醇二聚体中羟基氢键作用的结果;白藜芦醇浓度为1.0×10-4mol/L时,NT与白藜芦醇二聚体已形成较为稳定的结合物.Δ =60nm的同步荧光强度变化较Δ =15 nm的更为明显,说明白藜芦醇二聚体对色氨酸残基的作用较酪氨酸残基更强,是主要的作用位点.
3 结论
文中采用分子对接方法考察了白藜芦醇二聚体与NT的相互作用,并对不同白藜芦醇浓度和不同光照时间下白藜芦醇-NT体系的紫外-可见光谱和荧光光谱进行分析,得出以下主要结论:
(1)白藜芦醇二聚体与NT的结合能大于白藜芦醇单体与NT的结合能,白藜芦醇二聚体与NT的相互作用更强;
(2)延长光照时间和提高白藜芦醇浓度,均可使白藜芦醇二聚体与NT的相互作用增强,但最大荧光峰波长没有明显变化,表明聚合物分子基本结构没有受到影响;
(3)白藜芦醇二聚体与NT的结合常数较大,有1个结合位点,与结合点的距离较小,易发生非辐射能量转移,导致荧光静态猝灭;
(4)白藜芦醇二聚体与NT通过羟基氢键作用,导致酪氨酸和色氨酸残基亲水性增强和分子构象改变,色氨酸残基是其作用的主要位点.
[1] Huang X,Zhu H L.Resveratrol and its analogues:pro-mising antitumor agents[J].Anticancer Agents Medical Chemistry,2011,11(5):479-490.
[2] 于晶,任朝阳,苍晶.次生代谢物白黎芦醇研究概述[J].中国农业学报,2005,21(7):104-107. Yu Jing,Ren Zhao-yang,Cang Jing.A promising secondary metabolite-resveratrol[J].Chinese Agricultural Science Bulletin,2005,21(7):104-107.
[3] Clouser C L,Chauhan J,Bess M A,et al.Anti-HIV-1 activity of resveratrol derivatives and synergistic inhibition of HIV-1 by the combination of resveratrol and decitabine[J].Bioorganic Medicinal Chemical Letter,2012,22 (21):6642-6646.
[4] 李文玲,臧鹏,李洪福,等.二苯乙烯类低聚物的仿生合成[J].化学进展,2012,24(4):545-555. Li Wen-ling,Zang Peng,Li Hong-fu,et al.Biomimetic synthesis of oligostilbenes[J].Progress in Chemistry,2012,24(4):545-555.
[5] 蔡智丽.光诱导白藜芦醇分子聚合实验研究[D].广州:华南理工大学化学与化工学院,2013:15-20.
[6] Qiao H,Chen X,Xu L,et al.Antitumor effects of naturally occurring oligomeric resveratrol derivatives[J].Journal of Federation of American Societies for Experimental Biology,2013,27(11):4561-4571.
[7] 马丁,胡凯.白藜芦醇脱氢二聚体viniferin的研究进展[J].科技信息,2011(29):487-488. Ma Ding,Hu Kai.Progress on resveratrol dehydrodimer viniferin[J].Scientific Technology Information,2011 (29):487-488.
[8] 班建东,汤圣希.眼镜蛇神经毒素中枢性镇痛作用的研究[J].广西医科大学学报,2000,17(2):192-194. Ban Jian-dong,Tang Sheng-xi.A study of cobra neurotoxin on the central analgesic action[J].Journal of Guangxi Medical University,2000,17(2):192-194.
[9] 朱天新,袁彩君,任晚琼.眼镜蛇神经毒素的规模化制备及其镇痛作用的研究[J].华西药学杂志,2007,22 (3):247-249. Zhu Tian-xin,Yuan Cai-jun,Ren Wan-qiong.Preparation of neurotoxin from cobra venom on a large scale and its analgesic effect[J].Western Chinese Journal of Pharmaceuticals,2007,22(3):247-249.
[10] 梁力.乙酰化白藜芦醇和白藜芦醇在SD大鼠体内药代动力学研究[D].西安:第四军医大学药学院,2012:42-45.
[11] Uthaman G,Mannu J,Durai S.Molecular docking studies of dithionitrobenzoic acid and its related compounds to protein disulfide isomerase:computational screening of inhibitors to HIV-1 entry[J].BMC Bioinformatics,2008,9(Suppl 12):1-10.
[12] Robinson D D,Lyne P D,Richard W G.Partial molecular alignment via local structure analysis[J].Journal of Chemical Information and Computer Sciences,2000,40 (2):503-512.
[13] Peng S S,Kumar T K,Jayaraman G,et al.Solution structure of toxin b,a long neurotoxin from the venom of the king cobra(Ophiophagus hannah)[J].Journal of Biological Chemistry,1997,272:7817-7823.
[14] 李小妹,李娜,黄开胜,等.白藜芦醇低聚体类似物的光谱特征、生源与生物活性[J].药学学报,2002,37 (1):59-74. Li Xiao-mei,Li Na,Huang Kai-sheng,et al.Spectral characteristics,biogenesis and biological activities of oligostilbenes[J].Acta Phamaceutica Silica,2002,37 (1):59-74.
[15] Wang T H,Zhao Z M,Wei B Z,et al.Spectroscopic investigations on the binding of dibazol to bovine serum albumin[J].Journal of Molecular Structure,2010,970 (1/2/3):128-133.
[16] Wang J T,Wu Q H,Wang C,et a1.Study of the interaction of fangchinoline with human serum albumin by fluorescence and UV spectroscopic method[J].Spectroscopic Letter,2008,41(3):128-135.
[17] Li P,Liu S,Wang X,et al.Fluorescence quenching studies on the interaction of riboflavin with tryptophan and its analytical application[J].Luminescence,2013,28(6): 910-914.
[18] Pan J,Ye Z,Cai X,et al.Biophysical study on the interaction of ceftriaxone sodium with bovine serum albumin using spectroscopic methods[J].Journal of Biochemical Molecular Toxicology,2012,26(12):487-492.
[19] Ishida Y,Shimada T,Tachibana H,et al.Regulation of the collisional self-quenching of fluorescence in clay/ porphyrin complex by strong host-guest interaction[J]. Journal of Physical Chemistry A,2012,116(49):12065-12072.
[20] 肖厚荣,盛良全,施春华,等.水杨酸与眼镜蛇神经毒素相互作用的荧光光谱研究[J].光谱学与光谱分析杂志,2004,24(1):78-81. Xiao Hou-rong,Sheng Liang-quan,Shi Chun-hua,et al. Fluorescence study on the interaction of salicylic acid and bovine serum aibumin[J].Spectroscopy and Spectral Analysis,2004,24(1):78-81.
[21] Sivakumar R,Navecnraj S,Anandan S.Interactions of serum albumins with antitumor agent benzo[a]phenazine:a spectroscopic study[J].Journal of Luminescence,2011,131(10):2195-2201.
