石墨烯的制备及其电化学性能分析
2014-03-13刘丽来邢善超徐新龙杜新伟刘红斌
杨 晨,刘丽来,邢善超,徐新龙,杜新伟,刘红斌
(黑龙江科技大学a.环境与化工学院;b.研究生学院,黑龙江哈尔滨150022)
石墨烯是碳原子以sp2杂化轨道组成的碳六元环状呈蜂巢状的单片层薄膜,厚度仅相当于一个碳原子尺寸,是碳类材料的基本组成单元[1]。石墨烯具有较高的电子传导性,较大的比表面积(2630m2·g-1)[2]以及较高的理论储锂容量(744mAh·g-1)[3],作为锂离子电池负极材料时具有独特的优势[4,5]:石墨烯的导电性使其本身具有电子传输性能,而导热性则确保其使用过程中的稳定性;石墨烯纳米片层结构缩短Li+传输路径,较大的层间距更有利于Li+的扩散传输。因此,石墨烯在电化学领域中具有诱人的应用前景。
石墨烯作为锂离子电池负极,片层堆垛越少电性能越好。日本科学家Honma[6]组以石墨烯作为锂离子电池负极,并进行了电化学性能测试。Pan 等[7]采用水合肼还原法、热还原法和电子束还原法3 种方法制备石墨烯,探索石墨烯纳米片层中的缺陷数量对其储锂性能的影响。Yushin 等人[8]同时采用还原法和热处理法制备出具有良好嵌脱锂性能的石墨烯纳米片。由以上报道可知采用不同的制备方法,石墨烯纳米片的存储锂性能也就不同,有的甚至远远超出石墨烯的理论容量[9,10]。1996年,Dahn等[11,12]假设Li+可以同时结合在单层石墨的两边,则石墨的理论储锂容量将可达到原来的2 倍。2003年suzuki 等[13]经过计算证实了当石墨单片层之间的距离大于0.77nm 时,Dahn 等的假设即可成立。目前制备的石墨烯剥离度较低,比表面积较小,降低石墨烯锂离子电池负极的可逆容量,并且不容易重复操作。所以寻求一种新的、容易和可以重复操作的实验方法是目前石墨烯研究的热点。本文以膨胀石墨为原料制备的氧化石墨经NaBH4化学还原后制备石墨烯,以石墨烯为锂离子电池负极材料组装扣式电池,进行循环伏安、恒流充放电等性能测试,研究电极材料的电化学性能。
1 实验部分
1.1 材料与仪器
大鳞片石墨(碳含量94%,粒度180μm),浓H2SO4,KMnO4,H2O2,HCl,NaBH4,NH3·H2O 等均为分析纯。
BT224S 电子天平(湖南凯达科学仪器有限公司);CS101-2ABNR 干燥箱(重庆市永生实验仪器厂);769YP-60E 压片机(深圳科晶集团);CHI604B电化学分析仪(上海辰华仪器有限公司);MX 2600FE 型扫描电子显微镜(英国Camscan 公司);X射线衍射仪(德国Bruker)。
1.2 试样制备
1.2.1 膨胀石墨的制备 10g 大鳞片石墨加与20mL H2SO4(98%)于500mL 烧杯中混合,并置于冰水浴中磁力搅拌30min;缓慢加入一定量的KMnO4,搅拌均匀,移入40℃水浴中恒温反应60min;用去离子水洗至中性,60℃干燥,得到可膨胀石墨;用石英烧杯做容器,迅速放入980℃马弗炉中,高温膨化得到蠕虫状膨胀石墨。实验中,加入KMnO4时溶液逐渐粘稠并放出大量的热,颜色由黑色渐变为墨绿色,40℃反应后,加水溶液颜色变为黄褐色,放出大量热。
1.2.2 氧化石墨的制备 称取2g 膨胀石墨与150mL H2SO4(98%)在反应容器内混合均匀,冰水浴中机械搅拌30min;缓慢加入一定量KMnO4,低温机械搅拌60min;将反应容器移入35℃水浴中恒温反应一定时间;加入适量去离子水并在98℃水浴中恒温反应一定时间,待反应物颜色呈现亮黄色后将反应容器取出,加入10mL H2O2(30%)磁力搅拌均匀;用10%HCl 和1%H2O2混合液洗至无及,再用去离子水水洗至中性,45℃真空干燥,得到黄色物质为氧化石墨。
1.2.3 石墨烯的制备 100mg氧化石墨溶解于100mL去离子水中,得到棕黄色溶液;再超声分散1h,得到稳定的分散液;将其转移到三颈瓶中,加入一定量的NaBH4,在100℃条件下加热回流24h;静置过滤,40℃真空干燥箱中充分干燥,收集备用。
1.3 结构表征
采用扫描电子显微镜对样品进行形貌表征,X射线衍射仪对样品进行结构表征。
1.4 电化学性能分析
1.4.1 扣式电池组装方法 以制备得到的电极极片为工作电极,金属锂片(直径14mm)为对电极,浓度为1mol·L-1的LiPF6为电解液(EC+DEC+EMC 三元体系,体积比为1∶1∶1),组装CR2025 型扣式电池:先将电池负极壳口向上置于白纸上,然后放入负极片,再放入两层隔膜,使用一次性滴管滴加适量商用电解液后,将隔膜中的气泡赶净,然后依次放入正极片(商用锂片)、垫片、弹簧片,最后扣上正极壳。用力按压电池后用塑料镊子将已组装的纽扣电池置于对应纸袋中,自手套箱中取出。负极朝上,使用压力封口机在50MPa 下密封电池。
1.4.2 电化学性能测试 电池的循环伏安实验测试环境为室温25℃,扫描速率为0.1mV·s-1,电压扫描范围为0~3V。采用新威BTS-510A(5 V-1mA 和5 V-5mA)电池性能测试系统对组装“Li/电解质/石墨烯电池”进行测试。
2 结果与讨论
2.1 石墨烯结构形貌表征
2.1.1 结构表征 氧化石墨经剥离还原后生成的石墨烯XRD 谱图见图1。
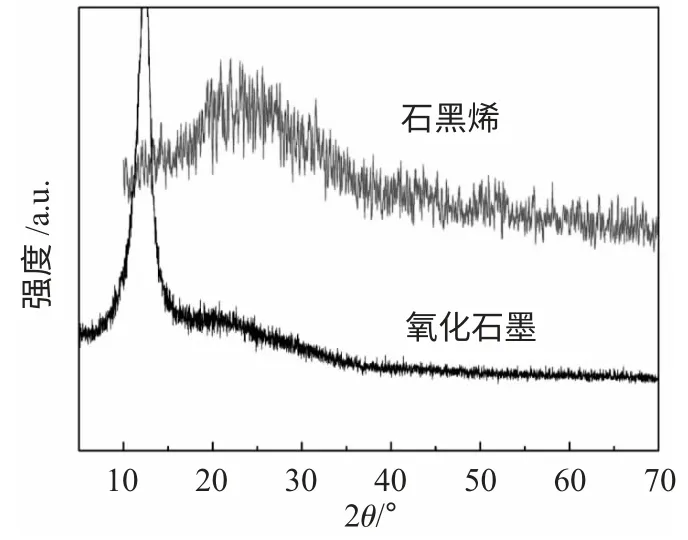
图1 石墨烯与氧化石墨XRD 谱图Fig.1 XRD patterns of graphene and GO
与氧化石墨相比,石墨烯在2θ 为10°左右的氧化石墨衍射峰消失,说明氧化石墨被还原,大量有机含氧官能团消失。石墨烯在2θ 约为25°附近出现衍射峰,与石墨(002)晶面特征峰相接近,石墨烯衍射峰强度变弱,峰型较宽,说明由氧化石墨还原得到的石墨烯与天然鳞片石墨相比结构发生变化。氧化石墨经超声剥离,得到片层较少的氧化石墨烯片,再经化学还原后得到的石墨烯为碳层片状结构,不仅结构尺寸和完整度降低,无序度增加。氧化石墨结构中大量含氧官能团破坏部分sp2杂化碳原子结构,形成sp3杂化结构和部分缺陷。化学还原时,产物在缺陷处断裂,导致石墨烯片层尺寸变小;部分sp3杂化结构被还原,大量含氧官能团消失,但仍有部分-OH 存在,为后期复合材料的制备提供条件。
2.1.2 形貌表征 石墨烯样品经行透射电镜表征见图2。

图2 石墨烯样品TEM 表征Fig.2 TEM images for grapheme
氧化石墨经超声剥离还原后得到的石墨烯薄如蝉翼,边缘卷曲,少量褶皱。从石墨烯片边缘可以判断出该样品层数较少。
2.2 石墨烯锂离子电池负极材料电化学性能分析
2.2.1 恒流充放电 为深入研究石墨烯性能,分别对石墨和石墨烯锂离子电池负极材料在相同的条件下进行电化学性能测试。测试电压区间为0.005~3.0V,电流密度为100mA·g-1时的前3 次放、充电曲线见图3。
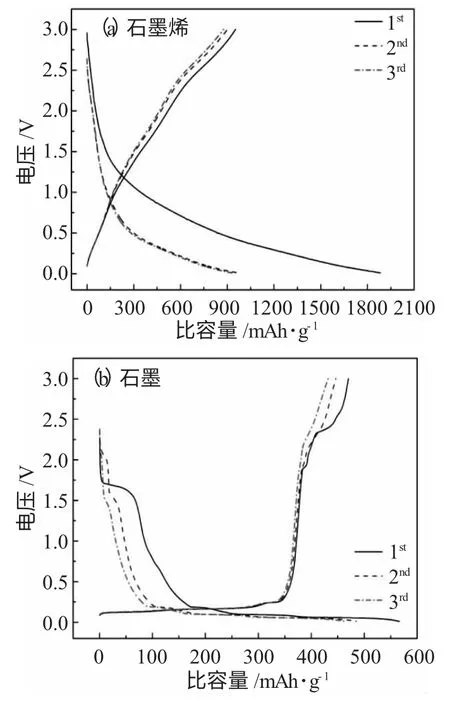
图3 石墨烯与石墨负极材料前3 次充放电曲线Fig.3 Galvanostatic charge-discharge curves of graphene and graphite anode materials after three cycles:(a)graphene(b)graphite
图3(a)、(b)对比发现,石墨电极在锂离子嵌脱过程中出现狭长的平台,而石墨烯电极却是一条逐渐降低的平滑曲线,认为可能是由于Li+嵌入这两种电极材料的机理不同而引起的。Li+嵌入到长程有序的石墨层中发生还原反应,因条件的不同而生成多种层间化合物;对石墨烯而言,Li+的嵌入多半是和石墨烯片层两侧的空位、吸附的官能团及石墨烯边缘有关。在100mAh·g-1电流密度下,石墨电极首次放、充电比容量分别为563、470mAh·g-1,石墨烯电极则分别可以达1883、973mAh·g-1,远远高于石墨的3 倍,石墨烯电极对提高锂离子电池的比容量具有更大潜力。
石墨烯电极在100mA·g-1电流密度下,0.005~3.0V 电压之间的多次恒流充放电性能见图4。

图4 石墨烯负极材料100 次循环的充放电曲线Fig.4 Galvanostatic charge-discharge curves of graphene anode materials after one hundred cycles
由图4 可直观看出,石墨烯电极在循环过程中比容量的变化。在首次放电曲线没有出现明显的放电平台,第二次放电比容量明显比首次衰减很多,且从第二个循环以后,充放电比容量逐渐趋于稳定。100 次循环后,放、充电容量为450、423mAh·g-1,库伦效率为94%。首次放电时,当电极极化到小于1.5V 时,电解液溶剂分子发生还原反应,生成的产物在电极表面形成稳定的保护膜即SEI(solid electrolyte interface)膜,在此过程中需要消耗部分不可逆的Li+,导致首次充放电循环出现较大的不可逆比容量。SEI 膜稳定后可以阻止电解液不可逆还原反应继续进行,使整个电极进入亚稳定状态,这就表现为石墨烯电极在第二次充放电循环后比容量趋于稳定[14]。但SEI 膜的厚度随循环次数的增加而增大,致使电极内阻也增加,从而影响电极储锂容量。
2.2.2 循环伏安 石墨烯与石墨分别作为锂离子电池负极材料的循环伏安曲线见图5。

图5 石墨烯与石墨负极材料的循环伏安曲线图Fig.5 Cyclic voltammograms of graphene and graphite anode materials:(a)graphene;(b)graphite
由两图C-V 曲线的积分面积比较知,石墨烯电极比石墨具有更大的可逆容量,与之前所述一致。
从图5(a)知,石墨烯首次放电曲线在0.79V 处出现一个微弱的还原峰,对应SEI 膜的形成,另外在0V 附近出现较强还原峰,对应Li+嵌入石墨烯电极的反应;充电曲线在1.75V 出现较弱氧化峰,对应SEI 膜的部分分解和Li+脱嵌,峰强度较弱,说明Li+嵌脱可逆性较低。第二次放电时,电流密度明显降低,是因为在首次循环时发生了一些不可逆反应并且形成SEI 膜[64]。第三次循环曲线与第二次基本重合,说明石墨烯电极在首次循环之后进入稳定状态,与前面恒流充放性能表现一致。图5(b)中石墨电极出现3 处还原峰,分别位于2.48、1.80 和0.25V,并对应Li+嵌入石墨电极发生的还原反应和SEI 膜的形成;氧化峰位于0.09、0.94 和1.65V 对应Li+脱嵌反应。值得注意的是,与图(a)相比图(b)中氧化还原峰之间的距离随着循环次数的增加而略微增大,说明石墨电极在Li+嵌脱过程中还是发生部分极化,再加之石墨本身的脆性易使石墨电极在多次循环后发生裂解、剥离而降低电池的循环性能及使用寿命。由此认为石墨烯电极具有更高的循环性能。
2.3.3 倍率性能及库伦效应 石墨烯和石墨作为锂离子电池负极材料在不同的电流密度下100~1000 mA·g-1的循环性能见图6。

图6 石墨烯与石墨负极材料的倍率循环性能Fig.6 Rate capability of graphene and graphite anode materials between 100 and 1000mA·g-1
石墨烯及石墨负极材料不同倍率下首次嵌锂容量,第10 次循环嵌锂容量及10 个循环后的容量保持率详见表1。

表1 石墨烯与石墨负极材料的倍率循环性能Tab1 Rate capability of graphene and graphite anode materials between and 1000mA·g-1
由图6、表1 分析,石墨烯比石墨表现出更高倍率性能。石墨烯在1000mA·g-1电流密度下,首次放电容量1093mAh·g-1,10 个循环后容量保持率可达98%。在不同倍率下循环50 次后,电流密度再次回到100mA·g-1时,石墨烯负极仍然可保持较高的可逆电容量986mAh·g-1,容量保持率为95%。这意味着石墨烯电极在高电流密度下经多次充放电循环后仍然保持着完整的晶体结构。又因为制得的石墨烯纳米片层较少,Li+在石墨烯电极中的扩散路径缩短,且较高的比表面和孔隙率都决定了石墨烯作为锂离子电池负极材料高倍率性能。
石墨烯电极在1000mAh·g-1电流密度下的库伦效率见图7。
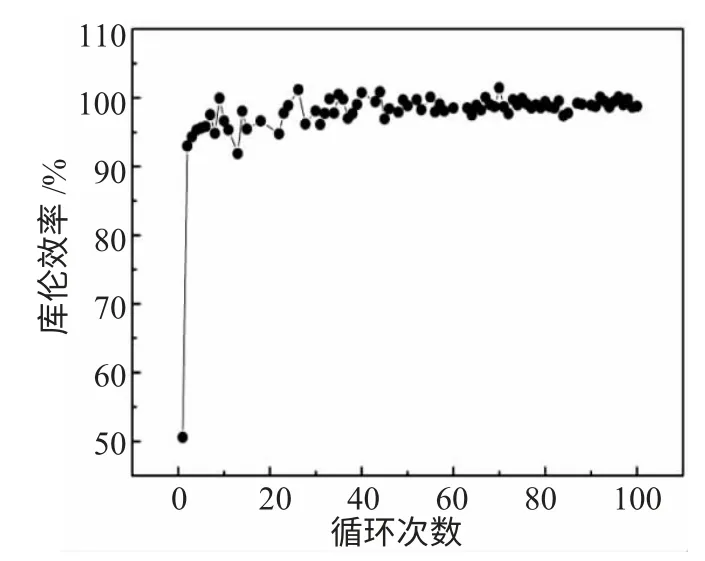
图7 石墨烯负极材料高电流密度下库伦效率图Fig.7 Coulombic efficiency of graphene anode materials at high current density
首次库伦效率较低,主要因为首次放电过程中有大量Li+发生不可逆反应,在电极表面形成SEI膜。SEI 膜具有离子特性,从而保证了Li+的良好透过性。经多次充放电循环后,库伦效率趋于100%并达到稳定。说明SEI 膜保持稳定状态,电极嵌脱锂容量也趋于稳定。
3 结论
本文以膨胀石墨为原料,采用Hummers 法制备剥离度较高的氧化石墨烯,然后以NaBH4为还原剂,化学还原氧化石墨烯制备片层较少的石墨烯;以制得的石墨烯作为锂离子电池负极材料进行电化学性能测试。
(1)在电流密度为100mA·g-1时,首次放电比容量达1900mAh·g-1,远远超过石墨烯的理论容量。因首次循环SEI 膜的生成,部分Li+发生不可逆反应,首次库伦效率偏低。
(2)石墨烯电极与石墨相比,除具有较高的储锂容量外,还具有较高的循环性能和倍率性能。在电流密度100mA·g-1时,100 个循环后石墨烯电极比容量为450mAh·g-1,库伦效率为98%。当石墨烯电极在不同电流密度下循环50 次,再回到100mA·g-1时,电极结构保持完整,仍保持首次循环92%的比容量。
(3)微观结构决定电极的性能,石墨烯纳米片层的分散,层间分布均匀程度都直接影响复合材料嵌锂容量和循环稳定性能,在本文基础上通过制备工艺的改进有望制备更加优异的锂离子电池负极材料。
[1]Allen MJ,Tung V C,Kaner R B,et al.Honeycomb carbon:a review of graphene[J].Chem.Rev.,2010,132-1.
[2]Wang C,Li D,T OO C O,et al. Electrochemical properties of graphenepaper electrodes used in lithiumbatteries[J].Chem.mater,2009,21:2064-2606.
[3]Chen P,Guo L,Wang Y.Graphene wrapped SnCo nanoparticles for high-capacitylithiumionstorage[J].Journalof PowerSources,2013,222:526532.
[4]Cai W W,Piner R D,Stadermann F J. Synthesis and solidstate NMR structural characterization of C-labeled graphite oxide[J].Science,2008,321(26):1814-1817.
[5]Mcallister MJ,Lio J L,Adamson D H et al.Single sheet functionalized graphene by oxidation and thermal expansion of graphite[J].Chem.mater,2007,19:4396-4404.
[6]傅强,包信和.石墨烯的化学研究进展[J].科学通报,2009,54(18):2657-2666.
[7]Pan D,Wang S,Zhao B,et al. Li storage properties of disordered graphene nanosheets[J]. Chemistry of Materials,2009,21(14):3136-3142.
[8]Evanoff K,Magasinski A,Yang J,et al. Nanosilicon-coated graphene granules as anodes for Li-ion batteries[J].Advanced Energy Materials,2011,l(4):495-498.
[9]Kim H,Seo D H,Kim S W,et al.Highly reversible Co3O4/graphene hybrid anode for lithium rechargeable batteries[J]. Carbon,2011,49(1):326-332.
[10]Wang G,Wang B,Wang X,et al.Sn/graphene nanocomposite with 3D arehiteeture for enhanced reversible lithium storage in lithium ion batteries[J]. Journal of Materials Chemistry,2009,19(44):8378-8384.
[11]麦永津.过渡金属氧化物锂离子电池负极材料纳米复合化改性研究[D].浙江大学,2012.
[12]Zheng T,Xue J S,Dahn J R.Lithium insertion in hydrogen-containing carbonaceous materials[J]. Chemistry of Materials,1996,8(2):389-393.
[13]Suzuki T,Hasegawa T,Mukai S R,et al. A theoretical study on storage states of Li ions in carbon anodes of Li ion batteries using moleeularorbitalcaleulations[J].Carbon,2003,41(10):1933-1939.
[14]Gao M X,Zhou P,Wang P,et al. FeO/C anode materials of high capacity and cycle stability for lithium-ion batteries synthesized by carbothermal reduction[J]. Journal of Alloys and Compounds,2013,565:97-103.
