表面活性剂辅助萃取雪灵芝黄酮及结构初析
2014-03-13霍彤孙宝国王昌涛孙啸涛周雪
霍彤,孙宝国,王昌涛,*,孙啸涛,周雪
(1.北京工商大学北京市植物资源研究开发重点实验室,北京100048;2.北京工商大学食品学院,北京100048)
表面活性剂辅助萃取雪灵芝黄酮及结构初析
霍彤1,孙宝国2,*,王昌涛1,*,孙啸涛2,周雪1
(1.北京工商大学北京市植物资源研究开发重点实验室,北京100048;2.北京工商大学食品学院,北京100048)
利用正交试验法对雪灵芝中黄酮类质的提取工艺进行优化,应用高效液相色谱法对提取样品的成分进行了初步分析。通过单因素试验分别考察表面活性剂种类、表面活性剂用量、乙醇体积分数、料液比、回流温度、回流时间对雪灵芝黄酮提取率的影响,选取适当的试验因素与水平,利用正交法设计试验,对各个因素的显著性和交互作用进行分析。结果表明:乙醇体积分数为5%,十二烷基苯磺酸钠浓度0.25%,料液比为1∶30(g/mL),提取时间30min,提取温度70℃,此条件下黄酮提取率可达1.75%,样品经HPLC检测发现含有少量槲皮素和山奈酚,表面活性剂辅助浸提法在植物资源提取领域显示出了优良的应用前景。
雪灵芝;提取;十二烷基苯磺酸钠;正交试验;高效液相色谱
雪灵芝(Arenaria kansuensis Maxim.)又名草灵芝,属石竹科(Caryophyllaceae)蚤缀属(Arenaria)植物,分布于海拔5 000m左右的甘肃、青海、四川西部及西藏地区[1-2],是生长海拔最高的绿色开花植物之一。研究发现雪灵芝含有黄酮类化合物,具有免疫调节[3-4]、抗肿瘤[5]、抗自由基活性[6]等多种功效。黄酮类化合物是指以2-苯基苯并吡喃酮为母核,即以C6-C3-C6为骨架结构的一大类天然化合物及其衍生物[7-8],极性相对较小,一般为植物体多酚类代谢物。对植物体内黄酮类物质提取研究的报道很多,常用的提取方法包括:加热水浴回流法[9]、超声提取法[10]、微波提取法[11]、索式提取法[12]、闪式提取法[13]和超临界流体萃取法[14]等。但上述提取法一方面提取率较低;另一方面,在提取过程中均需使用浓度较高的有机试剂,对环境污染较大。表面活性剂能够显著降低表面张力,提高弱极性物质的溶解性,已有文献报道将其应用于植物资源提取领域[15-17]。
目前,对雪灵芝黄酮提取的深入研究报道还较少,本研究在已有工作基础上,通过正交试验设计[18],应用表面活性剂辅助浸提法对雪灵芝黄酮的提取工艺进行了系统研究,以达到保障提取率和减少有机溶剂消耗的目的,属于绿色化学范畴;高效液相色谱法(High Performance Liquid Chromatography,HPLC)具有高速、高效、高灵敏度的特点,本研究应用HPLC对提取物的结构进行了初步分析。
1 材料与方法
1.1 材料与试剂
雪灵芝:市购,产地西藏喜马拉雅山脉,特级品。
乙醇、亚硝酸钠、硝酸铝、氢氧化钠等(均为分析纯)北京化学试剂厂;芦丁对照品(纯度≥98%,生产批号100080-200707)中国药品生物制品检定所;十二烷基苯磺酸钠(LAS)、十二烷基硫酸钠(SDS)、十二烷基三甲基氯化铵(DTAC)、十六烷基三甲基溴化铵(CTMAB)、聚氧乙烯月桂醚(Brij-35)、吐温20(Tween 20)、曲拉通X-100(X-100)、双(2-乙己基)磺基丁二酸钠(Aerosol OT)芦丁标准品、槲皮素标准品、山奈酚标准品:上海阿拉丁试剂有限公司。
1.2 仪器与设备
UV-T6型紫外分光光度计:北京普析通用仪器有限公司;RE-52CS/5299型旋转蒸发器:上海亚荣生化仪器厂;DZKW-4电子恒温水浴锅:北京中兴伟业仪器有限公司;SHB-B95循环水式多用真空泵:郑州长城科工贸有限公司;TB-2002电子天平:北京赛多利斯仪器系统有限公司;ZN-04B小型粉碎机:北京兴时利和科技发展有限公司;1525高效液相色谱仪(配2707自动进样器、2489紫外检测器):美国Waters科技有限公司。
1.3 雪灵芝黄酮的提取方法
取干燥雪灵芝,粉碎过60目筛,准确称量2.00 g,按一定比例加入表面活性剂,按一定料液比加入不同体积分数乙醇溶液,在一定温度下回流提取,待提取液冷却至室温后减压抽滤,按1∶1比例加入无水乙醇(因为提取液有机溶剂浓度较低,提取工程可将蛋白质和多糖一并萃取,因此加入无水乙醇将杂质沉淀),混匀后静置60min,15 000 r/min离心10min,取上清液用体积分数为70%的乙醇定容为25mL,混匀后测定总黄酮含量。
1.4 总黄酮含量的测定方法
雪灵芝总黄酮含量测定应用铝络合物显色法。
1.4.1 芦丁标准曲线的绘制
芦丁标准曲线的配置采取本课题组之前建立的方法。具体过程为:精确称取120℃干燥至恒质量的芦丁标准品50.3mg,无水乙醇定容至50mL,超声,得到质量浓度为1mg/mL的标准液。
准确移取上述标准溶液0.0、1.0、2.0、3.0、4.0、5.0mL于25mL容量瓶中,各加入5 g/100mLNaNO2溶液0.8mL,摇匀,静置6min;加入10 g/100mL Al(NO3)3溶液0.8mL,摇匀,静置6min;加入1mol/LNaOH溶液10.00mL,用体积分数为70%乙醇溶液定容至25.00mL,摇匀,静置10min~15min,于510 nm波长处测定吸光度。以标准溶液的质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,y=1.724 9x+0.010 5,R2=0.999 7。
1.4.2 雪灵芝中总黄酮含量的测定
精确移取样品溶液1.00mL于25mL容量瓶中,按照1.4.1节方法测定吸光度。
1.4.3 黄酮提取率的计算公式
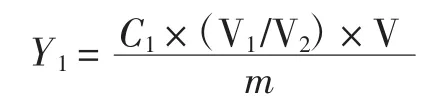
式中:Y1为总黄酮提取率,(mg/g);C1为吸光度按照标准曲线计算出得显色溶液中得质量浓度,(mg/ mL);V1为显色时溶液的定容体积,mL;V2为显色时移取的提取液的体积,mL;V为提取液的总体积,mL;m为称取样品的质量,g。
1.5 单因素试验
依1.3实验方法分别考察表面活性剂种类、表面活性剂用量、乙醇体积分数、料液比、回流温度、回流时间对雪灵芝总黄酮提取率的影响。
1.6 正交试验设计
依据单因素试验结果,以影响雪灵芝黄酮提取率的主要因素作为考察因素,采用正交试验模型优化和预测雪灵芝黄酮化合物的提取工艺。
1.7 高效液相色谱法对雪灵芝黄酮纯度的测定
色谱检测条件:Waters Ultimate XB-C18色谱柱(4.6mm×250mm,5μm);流动相为乙腈-水(含0.05%乙酸),流速1mL/min,进样体积15μL,等度洗脱:乙腈:水(含0.05%乙酸)=55∶45。运行时间:45min;柱温:30℃;检测波长:375 nm。
精确称取槲皮素、芦丁和山奈酚标准品10mg于10mL容量瓶中,甲醇定容至刻度,得到1mg/mL的三种黄酮标准品溶液。各吸取0.5mL混匀置于样品瓶中,再加入0.5mL甲醇,混匀,即得到0.5mg/mL黄酮混合标准品溶液,进样分析。
实际提取样品过0.45μm滤膜后直接进样分析。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇体积分数对黄酮提取率的影响
由于黄酮极性较弱,水溶液中溶解性较差,因此,升高乙醇浓度势必会提高黄酮得率,但本研究引入表面活性剂的初衷即为减少有机溶剂的消耗量,并非单纯为了提取率,本研究将乙醇浓度选定为5%。
2.1.2 表面活性剂种类对黄酮提取率的影响
表面活性剂的种类对提取效果的影响差异较大,分别选择了毒性较低的:十二烷基苯磺酸钠(LAS)、十二烷基硫酸钠(SDS)、十二烷基三甲基氯化铵(DTAC)、十六烷基三甲基溴化铵(CTMAB)、聚氧乙烯月桂醚(Brij-35)、吐温20(Tween 20)、曲拉通X-100(X-100)、双(2-乙己基)磺基丁二酸钠(Aerosol OT)等八种表面活性剂,考察了在纯水和5%乙醇两种提取介质中对雪灵芝黄酮提取率的影响。表面活性剂种类对黄酮提取率的影响见图1。
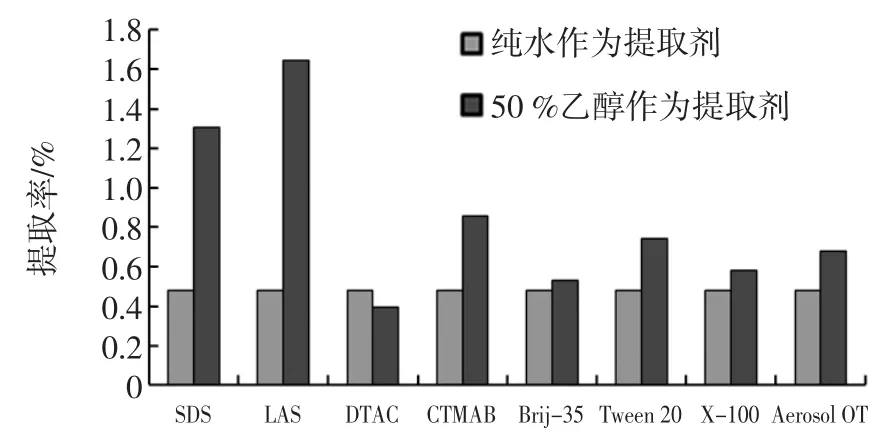
图1表面活性剂种类对雪灵芝黄酮提取率的影响Fig.1 Effect of types of surfactant on the extraction of flavonoids from Arenaria kansuensis Maxim
图1 结果显示单纯使用表面活性剂辅助纯水浸提提取率均小于0.5%,提取效率很低;当使用5%乙醇作为提取液时LAS显示出较高的提取率接近1.6%远高于其它7种表面活性剂,因此,本研究选用LAS作为潜在高效表面活性剂进行系统研究。
2.1.3 不同表面活性剂浓度提取率的影响
选取十二烷基苯磺酸钠的添加量在0.06%~0.25%的范围作为考察对象,不同表面活性剂浓度对雪灵芝黄酮提取率的影响见图2。
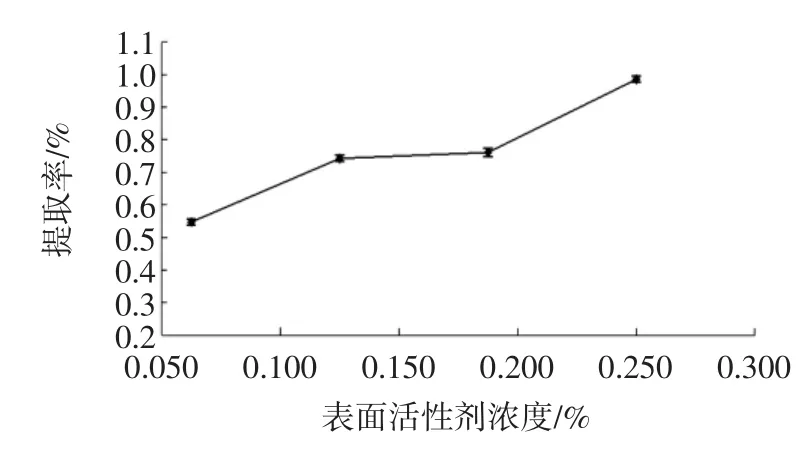
图2 表面活性剂的浓度对雪灵芝黄酮提取率的影响Fig.2 Effect of concentration of surfactant on the extraction of flavonoids from Arenaria kansuensis Maxim
如图2所示,雪灵芝黄酮提取率随着十二烷基苯磺酸钠的添加量在0.06%~0.25%范围内增加而升高,当十二烷基苯磺酸钠浓度为0.25%时提取率最高,原因是黄酮类化合物极性较小,因此,随着十二烷基苯磺酸钠的添加量增加溶解度增大,提取率升高;当十二烷基苯磺酸钠添加量继续增加时提取率骤然增大,原因可能是高十二烷基苯磺酸钠添加量使得一些蛋白质溶出量增加,参与显色反应使干扰因素增大进而影响最终的测定,导致黄酮类化合物的骤然增大。
2.1.4 料液比对黄酮提取率的影响
考察不同料液比(g/mL),即1∶20、1∶30、1∶40和1∶50对雪灵芝黄酮提取率的影响,结果见图3。

图3 料液比对雪灵芝黄酮提取率的影响Fig.3 Effect of solid/liquid ratio on the extraction of flavonoids from Arenaria kansuensis Maxim
如图3所示,随着料液比的增大黄酮提取率随之升高,当料液比达到1∶40后,继续增大料液比提取率反而下降,原因可能是高乙醇体积使得一些醇溶性杂质溶出量增加从而与黄酮类化合物竞争,并参与显色反应使干扰因素增大进而影响最终的测定,导致黄酮类化合物的提取率下降。从减少试剂用量和保证提取效率的综合考虑,最优的料液比为1∶40(g/mL)。
2.1.5 提取温度对黄酮提取率的影响
考察不同温度对雪灵芝黄酮提取率的影响,结果见图4。
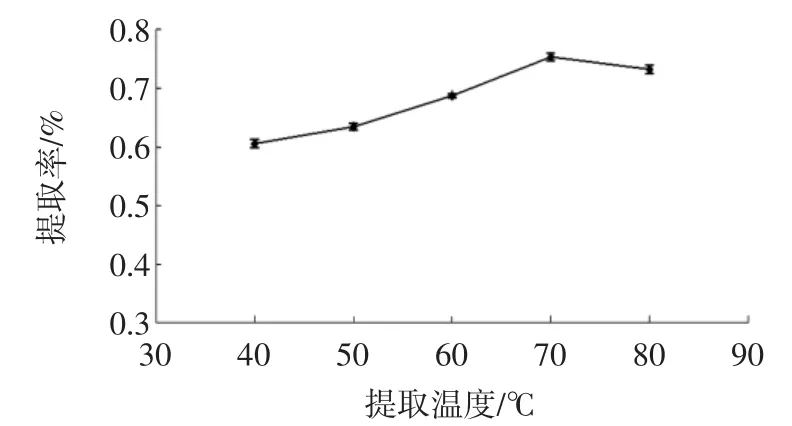
图4 提取温度对雪灵芝黄酮提取率的影响Fig.4 Effect of temperature on the extraction yield of flavonoids from Arenaria kansuensis Maxim
在固定乙醇体积分数为5%、LAS添加量为0.12%、料液比为1∶40、提取时间为1 h的条件下,不同提取温度对雪灵芝黄酮提取率的影响如图4所示,在40℃~90℃的温度范围内,提取率随提取温度的升高而增大,原因可能是温度的增加能够降低提取溶剂的黏度,促进介质传递同时增加溶解度;当温度高于70℃后进一步升高温度,提取率略微降低。从整体趋势走向可以看出,提取率的变化范围比较小,从降低提取成本和保证提取率的综合因素考虑,最优提取温度为70℃。2.1.6提取时间对黄酮提取率的影响
考察不同的提取时间对雪灵芝黄酮提取率的影响,结果见图5。

图5 提取时间对雪灵芝黄酮提取率的影响Fig.5 Effect of extraction time on the extraction yield of flavonoids from Arenaria kansuensis Maxim
在固定乙醇体积分数为5%、AR添加量为0.12%、料液比为1∶30、提取温度为70℃的条件下,不同提取时间对雪灵芝黄酮提取率的影响如图5所示,随着提取时间的延长,总黄酮提取率在1.06%~1.10%范围内波动,波动范围较小,因此确定该单因素为不影响因素。从减少提取时间和保证提取率的综合因素考虑,最优提取时间为0.5 h。
2.2 正交试验优化雪灵芝黄酮提取工艺及确认
2.2.1 正交试验优化雪灵芝黄酮提取工艺
根据单因素试验的结果,选择表面活性剂浓度、料液比、提取温度三个单因素设计三因素两水平的正交试验,主体间因子设计见表1。
按照主体间因子设计表设计正交试验,试验结果分析见表2、表3。

表1 主体间因子表Table1 Between-subjects factors table

表2 主体间效应的检验表Table2 Between-subjects effects test table

表3 估算边界均值检验表Table3 Estimating border means test table
由表2分析可知,各因素水平对结果影响的强弱顺序是:表活浓度>提取温度>料液比,其中表活浓度对提取率影响最大,提取温度和料液比对提取率影响非常小,但是三种单因素对提取率的影响均为不显著;由表3分析可知,各因素水平对提取率的影响结果为:A2>A1,B1=B2,C1>C2。因此最佳工艺选取5%乙醇作为提取剂,表活浓度0.25%,料液比为1∶30,提取时间30min,提取温度70℃。
2.2.2 雪灵芝黄酮最佳提取工艺的确证
在选取的各因素范围内,根据正交实验得出雪灵芝黄酮的最佳提取工艺条件为:乙醇体积分数为5%,LAS浓度0.25%,料液比为1∶30,提取时间30min,提取温度70℃。在此条件下进行实验验证,平行测定6批样品,提取率分别为1.747%,1.743%,1.734%,1.757%,1.762%,1.749%,波动范围很小,故本最佳工艺条件合理,同时也表明此工艺具有较好的稳定性。
2.3 HPLC法对提取物的结构分析
图6所示为标准品芦丁,槲皮素和山奈酚的色谱图,对应的保留时间分别为15.4min,33.4min和34.9min。通过HPLC法对标准品分析的色谱图结果见图6。

图6 标准品的HPLC色谱图Fig.6 The chromatogram of standards
HPLC法对雪灵芝提取物的分析结果见图7。

图7 实际样品的HPLC色谱图Fig.7 The chromatogram of real sample
将实际经提取获得的黄酮类物质依1.7方法直接进HPLC分析,结果如图7所示,编号为1、2色谱峰的保留时间分别为33.6和34.8min,与标准品槲皮素和山奈酚的色谱峰相对应,即提取得到的黄酮类物质中含有槲皮素和山奈酚,同时由吸光度数据可以看到含量较低。
3 结论
本研究首先通过单因素试验分别考察表面活性剂种类、表面活性剂用量、乙醇体积分数、料液比、回流温度、回流时间对雪灵芝总黄酮提取率的影响,确定了影响黄酮提取率的主要因素,在此基础上,利用正交实验得到了最优提取工艺条件,并进实验行验证,雪灵芝黄酮的最佳提取工艺条件:乙醇体积分数为5%,LAS浓度0.25%,料液比为1∶30,提取时间30min,提取温度70℃,此条件下黄酮提取率可达1.75%,样品经HPLC检测发现含有少量槲皮素和山奈酚,表面活性剂辅助浸提法在植物资源提取领域显示出了优良的应用前景。
[1]黄勇,许倩兮,彭光华.藏药雪灵芝中总皂苷含量的测定[J].中国药师,2010,13(1):94-96
[2]唐昌林.中国植物志第26卷[M].北京:科学出版社,2004:187-188
[3]彭宝珠,冯伟力,王利彦,等.藏药雪灵芝对炎症和免疫功能的影响[J].中国中药杂志,1991,16(6):363-366
[4]李凤文,赵鹏,刘荣珍,等.雪灵芝调节小鼠免疫功能作用的实验研究[J].中国热带医学,2007,7(11):1999-2000
[5]赵鹏,姚思宇,王彦武,等.雪灵芝对二乙基亚硝胺诱导大鼠肝癌组织细胞的抑制作用[J].中国组织工程研究与临床康复,2007, 11(38):7553-7555
[6]付翔,陈薇,段小群,等.雪灵芝提取物清除羟基自由基和抑制脂质过氧化作用[J].中国中医药信息杂志,2010,17(7):35-36
[7]Liu W,Kong Y,Zu Y,et al.Determination and quantification of active phenolic compounds in pigeon pea leaves and its medicinal product using liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2010,1217(28):4723-4731
[8]Inbaraj BS,Lu H,Kao TH,et al.Simultaneous determination of phenolic acids and flavonoids in Lycium barbarum Linnaeus by HPLCDAD-ESI-MS[J].Journal of Pharmaceutical and Biomedical Analysis,2010,51(3):549-556
[9]Tang H,Chang L,Ding C,et al.Process research on the reflux extraction of flavonoids from Rubus crataegifolius leaves[J].Medicinal Plant,2012,3(6):58-60,63
[10]Pan G,Yu G,Zhu C,et al.Optimization of ultrasound-assisted extraction(UAE)of flavonoids compounds(FC)from hawthorn seed(HS) [J].Ultrasonics Sonochemistry,2012,19(3):486-490
[11]Yi J,Wu J,Wu Y,et al.Ultrasound and microwave assisted extraction of luteolin from Eclipta prostrate[J].African Journal of Pharmacy and Pharmacology,2013,7(4):114-124
[12]李维莉,马银海,彭永芳,等,云南栘依总黄酮提取工艺研究[J].食品科学,2006,27(7):147-149
[13]韩帅,李淑燕,陈芹芹,等,响应面分析法优化闪式提取胡柚皮中黄酮类化合物工艺[J].食品科学,2011,32(10):52-56
[14]He J,Shao P,Liu J,et al.Supercritical carbon dioxide extraction of flavonoids from pomelo(Citrus grandis(L.)Osbeck)peel and their antioxidant activity[J].International Journal of Molecular Sciences, 2012,13:13065-13078
[15]马祥,晏日安.超声波-表面活性剂协同提取竹叶总黄酮的工艺[J].食品科学,2012,33(22):76-80
[16]赵二劳,郭青枝,郭春燕,等.表面活性剂CTMAB-微波协同提取山楂黄酮的研究[J].中国食品添加剂,2010(6):88-91
[17]颜贤仔,王纯荣,寇磊.表面活性剂-超声法提取野生刺五加黄酮工艺[J].食品工业科技,2011(12):314-317
[18]张吉祥,赵文静,白晓杰,等.正交试验法优化黑米黑色素的超声辅助提取工艺[J].食品科学,2010,31(4):39-41
Study on Surfactant-assisted Extraction Process and Preliminary Structural Analysis of Total Flavonoids from Arenaria kansuensis Maxim
HUO Tong1,SUN Bao-guo2,*,WANG Chang-tao1,*,SUN Xiao-tao2,ZHOU Xue1
(1.Beijing Key Laboratory of Plant Resources Research and Development,Beijing Technology&Business University,Beijing 100048,China;2.School of Food and Chemical Engineering,Beijing Technology& Business University,Beijing 100048,China)
The optimum conditions for the extraction of flavonoids from Arenaria kansuensis Maxim were determined using orthogonal experiment.An analysis method with high performance liquid chromatography(HPLC)was established to study the composition of extraction.On the basis of single-factor experiments,the effect on extraction yield was investigated by surfactant kind,surfactant amount,ethanol concentration,extraction duration,extraction temperature and liquid-to-solid ratio.Based on this,the significance of the various factors and interactions were analyzed with the use of orthogonal experiment.The optimal extraction conditions for flavonoids from Arenaria kansuensis Maxim were ethanol concentration of 5%,sodium dodecylbenzene sulfonate(LAS)concentration of0.25%,liquid-to-solid ratio of1∶30(g/mL),extraction temperature of 70℃ and extraction time of 0.5 h.Under the optimized conditions,the maximum extraction yield of flavonoids was 1.75%.The extraction had a small amount of quercetin and kaempferol which was analyzed by HPLC.Therefore,the extraction method that surfactant-assisted showed good application prospects in the field of extraction effective components of plant.
Arenaria kansuensis Maxim.;extraction;dodecylbenzene sulfonate;orthogonal experiment;high performance liquid chromatography
10.3969/j.issn.1005-6521.2014.06.005
2014-03-19
北京市科技新星项目(2008B08);“中青年骨干人才培养计划”项目(PHR20110873);质检公益性行业科研专项(201010023)
霍彤(1987—),女(汉),研究生,硕士,研究方向:化妆品生物技术。
*通信作者:孙宝国(1961—),男,教授,博士,研究方向:食品科学。王昌涛(1975—),男,副教授,博士,研究方向:生物技术。
