寇氏隐甲藻突变株的糖、氮代谢对产油的影响
2014-03-13赵书林何东平王文翔
赵书林 何东平 陈 涛 田 华,3 佘 隽,3 王文翔
(武汉轻工大学食品科学学院1,武汉 430023)
(中国科学院武汉病毒研究所2,武汉 430060)
(武汉博特尔油脂科技有限公司3,武汉 430040)
寇氏隐甲藻(Crypthecodinium cohnii)是一种海生、无色、异养双鞭毛甲藻,多生长在腐败的大型褐藻上,也可在琼脂板上生长,属于从原核生物向真核生物的过度类型。目前国内外文献报道寇氏隐甲藻藻体中,产油率高达10%~15%,DHA质量分数高达35%~40%。2010国家卫生部正式批准由寇氏隐甲藻等藻种经生物发酵、提取、精炼等工艺制取的DHA藻油为新资源食品[1]。利用寇氏隐甲藻高密度发酵生产富含DHA的油脂,具有很大的经济效益和社会效应[2]。寇氏隐甲藻在生长对数期之前主要利用碳源和氮源进行自身的生长繁殖和油脂积累;生长对数期之后若没有及时的碳源补给,寇氏隐甲藻便会分解自身的油脂来提供生存所必需的能量,此时应该及时补糖,保证寇氏隐甲藻有充足的碳源来进行油脂的积累。De Swaaf等[3]报道当发酵液中葡萄糖质量浓度高于25 g/L时,对寇氏隐甲藻的生长速率有抑制作用;在葡糖糖质量浓度高达84.3 g/L时寇氏隐甲藻也能生长;当氮源质量浓度为2 g/L时,寇氏隐甲藻产可以合成更多的 DHA;Wang等[4]、Mendes等[5]研究也指出当碳/氮比在15∶1左右时补糖最佳。因此研究发酵液中的糖、氮代谢过程,可以提高产油率和DHA含量。
1 材料与方法
1.1 藻种
寇氏隐甲藻(Crypthecodinium cohnii突变株2.4K-2A2-5),本实验室保存[6]。
1.2 培养基
固体培养基:葡萄糖、谷氨酸钠、碳酸氢钠、磷酸二氢钾、碳酸钙、氯化钠、硫酸镁、金属离子混合液、维生素混合液、琼脂。
液体培养基:葡萄糖、谷氨酸钠、碳酸氢钠、磷酸二氢钾、碳酸钙、氯化钠、硫酸镁、氯化钾、金属离子混合液、维生素混合液。
1.3 试剂
正己烷、盐酸、硫酸、硼酸、氢氧化钠、硫酸铜、硫酸钾、乙酸锌、酒石酸钾钠、亚铁氰化钾、甲醇、95%乙醇、亚甲基蓝、甲基红、纤维素酶(酶活:10~140 U/g),、碱性蛋白酶(酶活:20万 U/g),试验所用的试剂均为分析纯。
1.4 仪器与设备
Agilent7890A气相色谱仪:安捷伦科技(中国)有限公司;SPX-150C恒温恒湿箱:上海博讯实业有限公司医疗设备厂;SW-CJ-1F单人双面净化工作台:苏州净化设备有限公司;LDZX-75KB立式蒸汽灭菌器:武汉利天科技仪器有限公司;RE-52C旋转蒸发器:上海亚荣生化仪器厂。
1.5 发酵条件的讨论
对照组和5个补糖的试验组初始葡萄糖质量浓度均为70 g/L,分别记为 A、B、C、D、E、F。A为对照组,B组在24 h时补糖10 g,C组在48 h时补糖10 g,D组在72 h时补糖10 g,E组在96 h时补糖10 g,F组在120 h时补糖10 g。每组试验隔24 h观察碳和氮的利用情况,最后收获藻体提取油脂,测定每组的生物量、产油率、DHA%和DHA产量。
1.6 分析方法
1.6.1 还原糖质量浓度的测定[7]
1.6.1.1 样品预处理吸取20 mL样品和20 mL水,置于150 mL锥形瓶中充分混匀,然后取10 mL混合液,继续添加3 mL浓度6 mol/L的盐酸,加入玻璃珠2粒,加热至沸15~20 min,待充分水解后冷却至室温调pH至7,定容至100 mL的容量瓶,然后过滤到150 mL锥形瓶中,取续滤液备用。
1.6.1.2 标定碱性酒石酸铜溶液
吸取5 mL碱性酒石酸铜甲液与5 mL碱性酒石酸铜乙液,置于150 mL锥形瓶中,加10 mL水,加入玻璃珠2粒,从滴定管滴加约9 mL葡萄糖标准溶液,控制在2 min内加热至沸,趁热以1滴/2 s的速度继续滴加葡萄糖标准溶液,至溶液蓝色刚好褪去为终点,记录消耗葡萄糖标准溶液的总体积,同时平行操作3份,取平均值,计算每10 mL碱性酒石酸铜溶液相当于葡萄糖的质量。
1.6.1.3 试样溶液预测
吸取5 mL碱性酒石酸铜甲液与5 mL碱性酒石酸铜乙液,置于150 mL锥形瓶中,加10 mL水,加入玻璃珠两粒,控制在2 min内加热至沸,保持沸腾以先快后慢的速度,从滴定管中滴加试样溶液,并保持沸腾的状态,待溶液变浅时,以1滴/2 s的速度滴定,直至溶液蓝色刚好褪去为终点,记录样液消耗体积(如果样品残糖浓度偏低,可先加入一定量的标准葡萄糖溶液,再滴加试样溶液滴定至终点)。
1.6.1.4 试样溶液测定
吸取5 mL碱性酒石酸铜甲液与5 mL碱性酒石酸铜乙液,置于150 mL锥形瓶中,加10 mL水,加入玻璃珠2粒,从滴定管滴加比预测体积少1 mL的试样溶液至锥形瓶中,使在2 min内加热至沸,保持沸腾继续以1滴/2s的速度滴定,直至溶液蓝色刚好褪去为终点,记录样液消耗体积。同法平行操作3份,得出平均消耗体积(如果样品残糖浓度偏低,可先加入一定量的标准葡萄糖溶液,再滴加试样溶液滴定至终点)。
1.6.1.5 计算还原糖含量
试样中还原糖的质量浓度计算:

式中:X为试样中还原糖的含量/g/L,V1为碱性酒石酸铜溶液消耗的标准葡萄糖的体积/mL;V2为消耗葡萄糖的体积/mL;V为消耗试样的体积/mL,20为化简后的系数/g/L。
1.6.2 氨基酸质量浓度的测定[8]
取用4层纱布过滤后的试样2 mL,加10 mL水,加1滴甲基红,以0.3 mol/L的硫酸溶液调制红色,再以0.1 mol/l的氢氧化钠溶液调制橙黄色,再加4 mL的18%中性甲醛,静置10 min,滴加8滴酚酞试剂,然后用0.1 mol/L的氢氧化钠溶液滴定,直至溶液颜色刚好为微红为终点,记录样液消耗体积。同法平行操作3份,得出平均消耗体积。
试样中氨基酸的质量浓度计算:

式中:X为试样中氨基酸的含量/g/L,V是平均消耗的氢氧化钠体积/mL。
1.7 色谱条件
色谱柱:Agilent SP-2560(100 m×25μm,0.2 μm);升温程序:100℃保持4 min,以3℃/min升温至230℃,保持20min,载气(N2)流速25 mL/min,压力 2.4 kPa,进样量1μL;分流比 15∶1。
2 结果与分析
2.1 寇氏隐甲藻突变株对碳、氮利用的变化
寇氏隐甲藻突变株对碳、氮利用的变化如表1。本试验分别在 0、24、48、72、96、120、144、168 h等时刻测定寇氏隐甲藻突变株对发酵液中碳、氮的利用情况;A为对照组,B、C、D、E、F为5个不同的补糖试验组。
首先测定了每组试验初始葡萄糖和氨基酸质量浓度均为67.74 g/L和1.89 g/L,说明用斐林试剂法和甲醛法可以准确测定寇氏隐甲藻突变株对发酵液中碳、氮的利用情况。
其次,当发酵至24 h时B组开始补糖10 g,此时测定B组与其他试验组相比葡萄糖质量浓度略有上升,而氨基酸质量浓度基本一致;当发酵至48 h时C组开始补糖10 g,此时测定C组葡萄糖质量浓度高于A、D、E、F组,但低于B组,每组氨基酸质量浓度基本一致;当发酵至72 h时D组开始补糖10 g,此时测定D组葡萄糖质量浓度最高,且在48~72 h之间寇氏隐甲藻突变株对糖的利用率最大,每组氨基酸浓度基本一致;当发酵至96 h时E组开始补糖10 g,此时测定E组葡萄糖质量浓度最高,A、B、C、D、F组葡萄糖和氨基酸质量浓度基本一致;当发酵至120 h时F组开始补糖10 g,此时测定F组葡萄糖质量浓度最高,A、B、C、D、E组葡萄糖和氨基酸质量浓度基本一致;当发酵144 h以后测定 A、B、C、D、E、F组葡萄糖和氨基酸质量浓度基本不变。
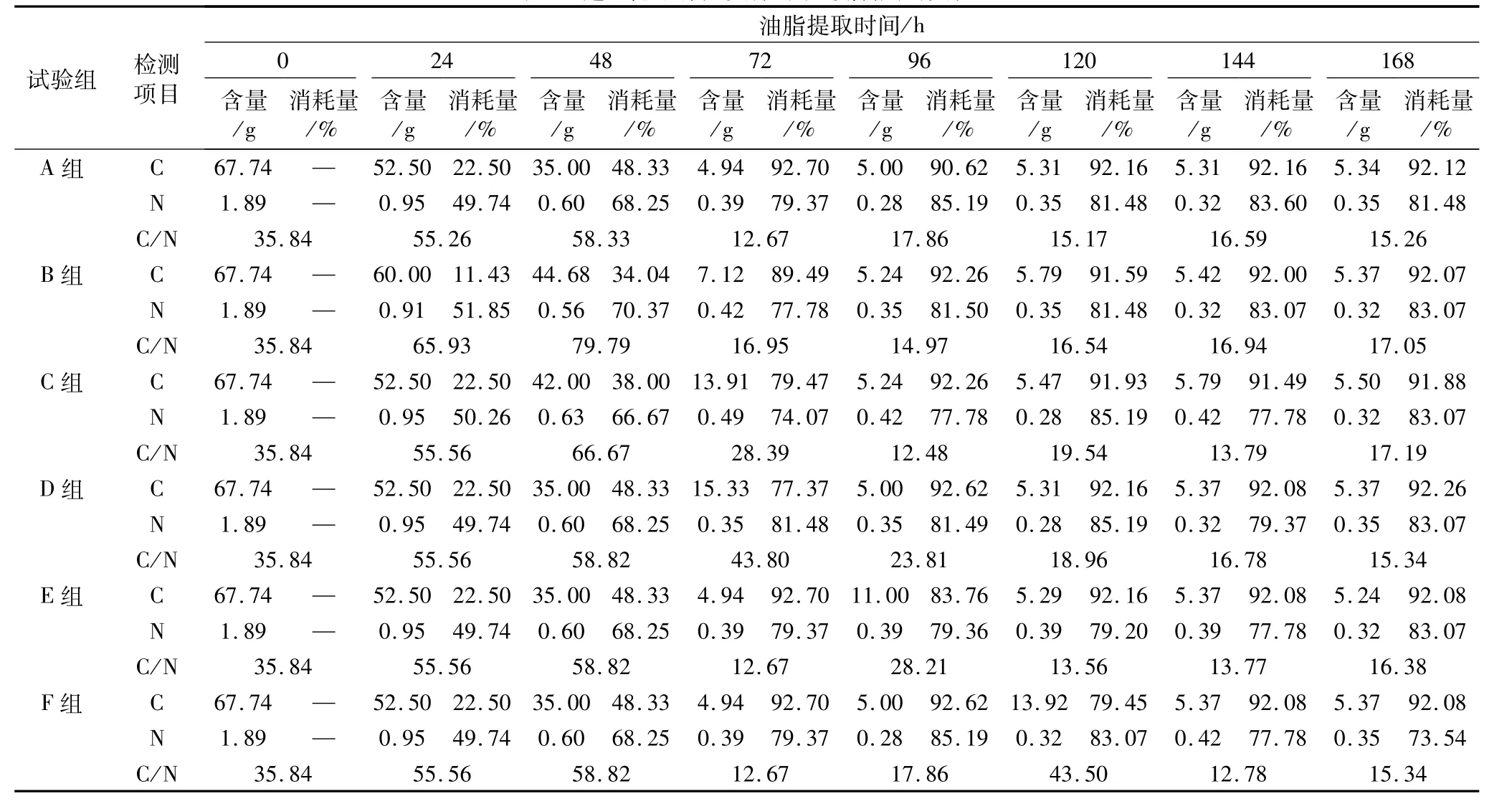
表1 寇氏隐甲藻突变株对碳、氮利用的变化
最后,尝试在144 h收获藻体,因为144 h后发酵液中的碳、氮消耗基本趋于稳定,不再被寇氏隐甲藻突变株利用。
2.2 不同时期的补糖对寇氏隐甲藻突变株糖、氮代谢的影响
将对照组和试验组发酵培养7 d,每隔24 h观察碳、氮的利用情况,绘制趋势图,如图1~图6。
从图1首先看出对照组A前72 h糖耗为93.0%左右,氮耗为80.0%左右;说明前72 h是寇氏隐甲藻利用营养物质的主要时期,72 h后碳源和氮源消耗趋于稳定;其次前72 h糖耗的速率先慢后快,而氮耗的速率则是先快后慢[9-10]。当168 h收获时发酵液中剩余残糖质量浓度仅5.34 g/L,氨基酸质量浓度为 0.35 g/L,碳氮比约为 15∶1。
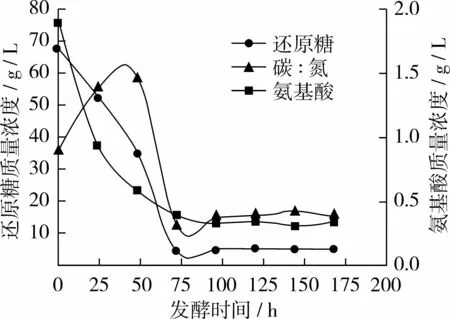
图1 对照组A碳、氮利用变化曲线
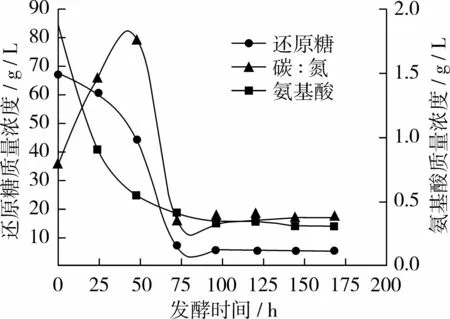
图2 试验组B碳、氮利用变化曲线
从图2看出试验组B与对照组相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在24 h时略有上升;96 h后趋于稳定,此时糖耗为92.3%左右,氮耗为81.5%左右;当168 h放瓶收获时发酵液中剩余残糖质量浓度仅5.37 g/L,氨基酸质量浓度为 0.32 g/L,碳/氮比约为 18∶1。
图3 试验组C碳、氮利用变化曲线
从图3看出试验组C与对照组相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在48 h时略有上升;96 h后趋于稳定,此时糖耗为92.3%左右,氮耗为77.8%左右;当168 h放瓶收获时发酵液中剩余残糖质量浓度仅5.50 g/L,氨基酸质量浓度为 0.32 g/L,碳氮比约为 17∶1。
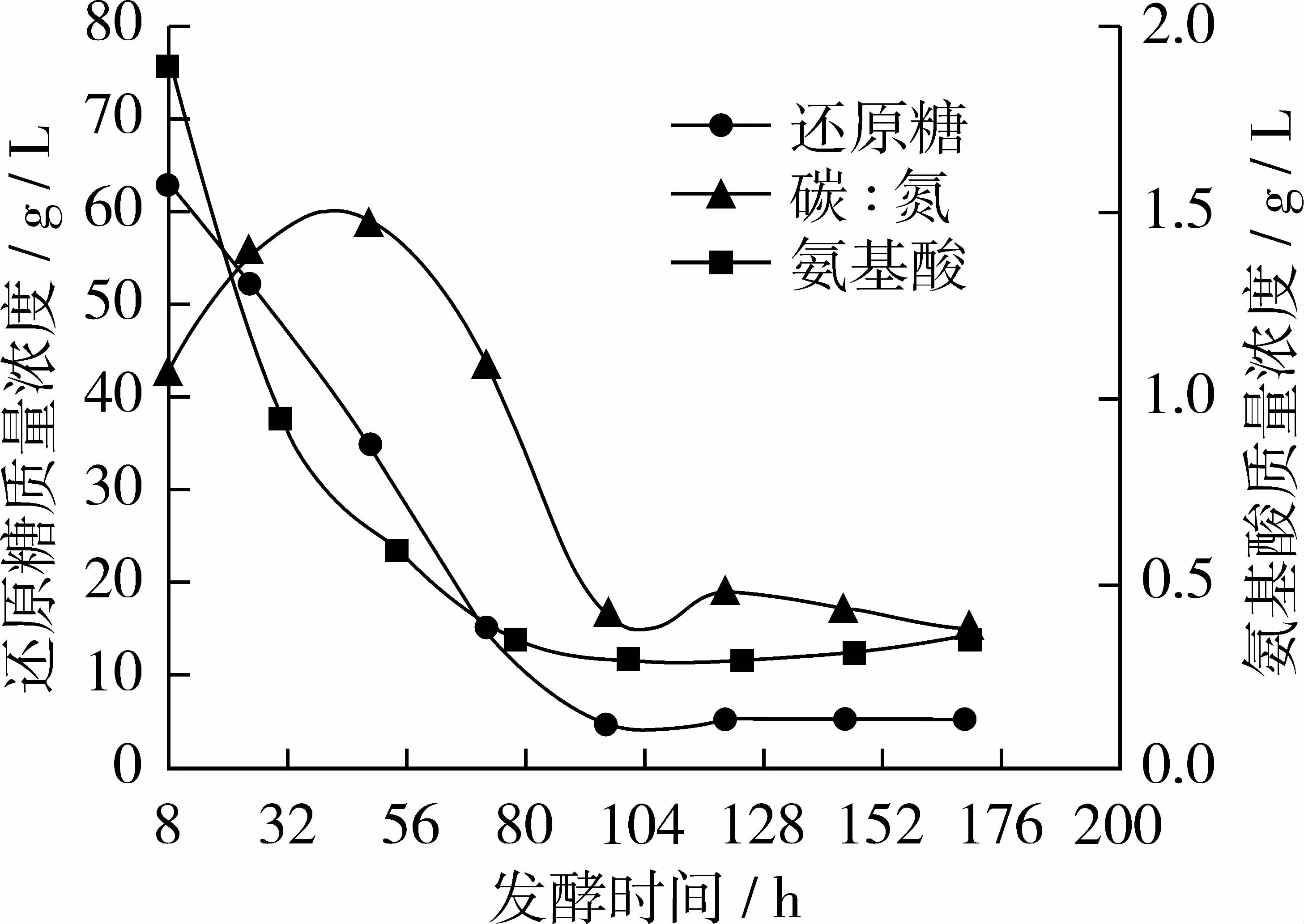
图4 试验组D碳、氮利用变化曲线
从图4看出试验组D与对照组相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在72 h时略有上升;96 h后趋于稳定,此时糖耗为92.6%左右,氮耗为81.49%左右;当168 h放瓶收获时发酵液中剩余残糖质量浓度仅5.37 g/L,氨基酸质量浓度为 0.35 g/L,碳/氮比约为 15∶1。
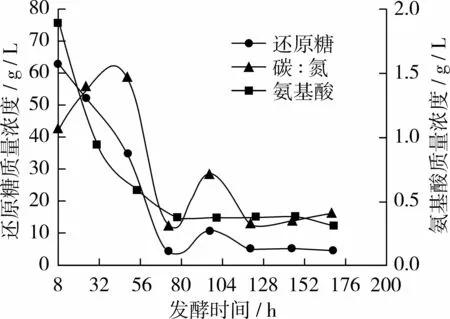
图5 试验组E碳、氮利用变化曲线
从图5看出,试验组E与对照组相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在96 h时略有上升;前72 h糖耗为92.7%左右,氮耗为79.4%左右;当96 h补10 g时时,发酵液中残糖浓度为16.2%左右,氨基酸浓度为20.0%左右;当168 h放瓶收获时发酵液中剩余残糖质量浓度仅5.24 g/L,氨基酸质量浓度为 0.32 g/L,碳/氮比约为 16∶1。
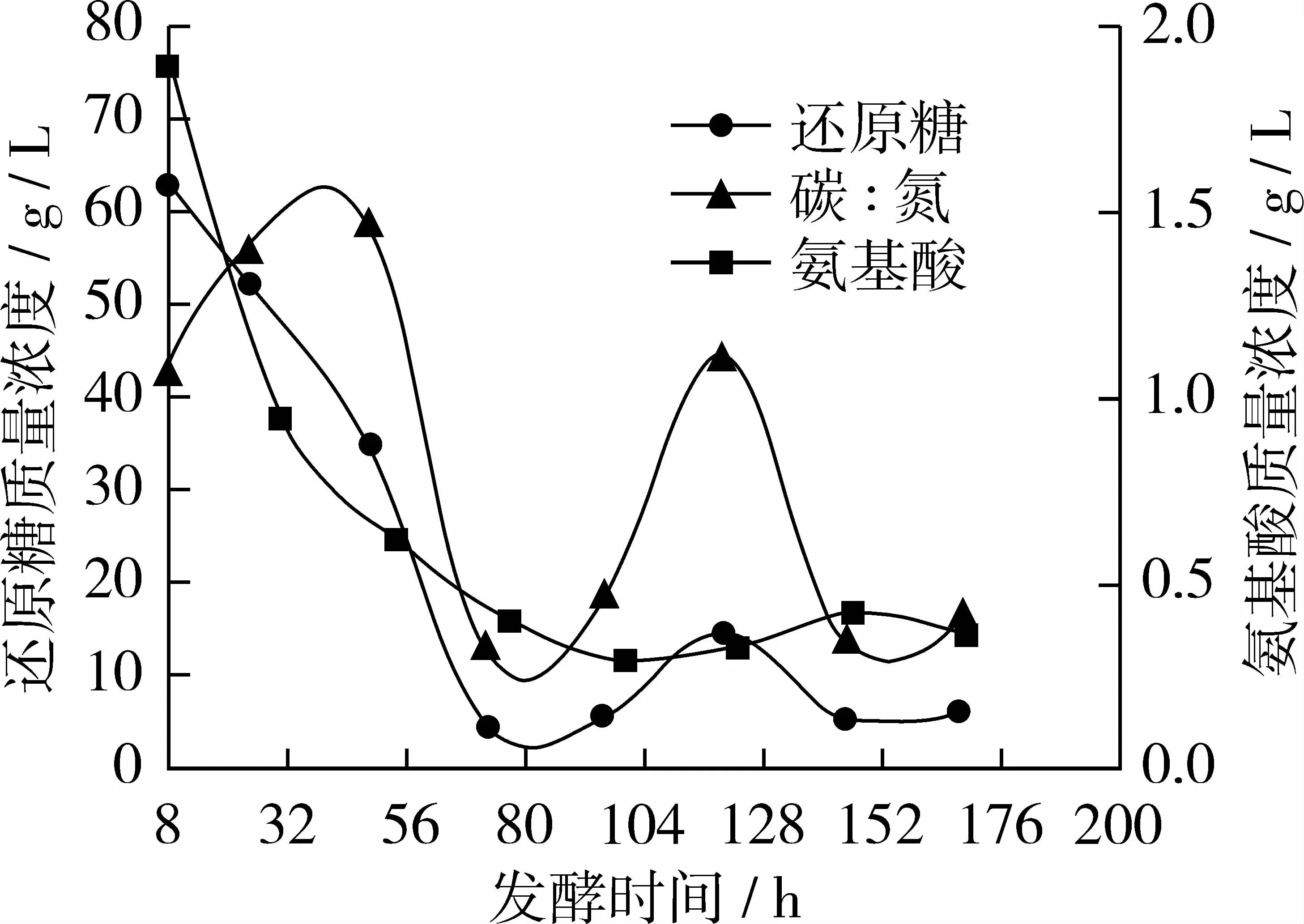
图6 试验组F碳、氮利用变化曲线
从图6看出试验组F与对照组相比氨基酸质量浓度曲线基本不变,还原糖质量浓度曲线在120 h时略有上升;前72 h糖耗为92.7%左右,氮耗为79.4%左右;当120 h补糖10 g时,发酵液中残糖浓度为20.6%左右,氨基酸浓度为17.0%左右;当168 h放瓶收获时发酵液中剩余残糖质量浓度仅5.37 g/L,氨基酸质量浓度为0.35 g/L,碳/氮比约为15∶1。
2.3 补糖对寇氏隐甲藻干重、产油率及DHA的影响
试验组 B、C、D、E、F中干重、产油率、DHA产量及含量明显高于对照组,特别是F组的产油率及DHA产量分别比对照组高出了42.58%和49.30%。
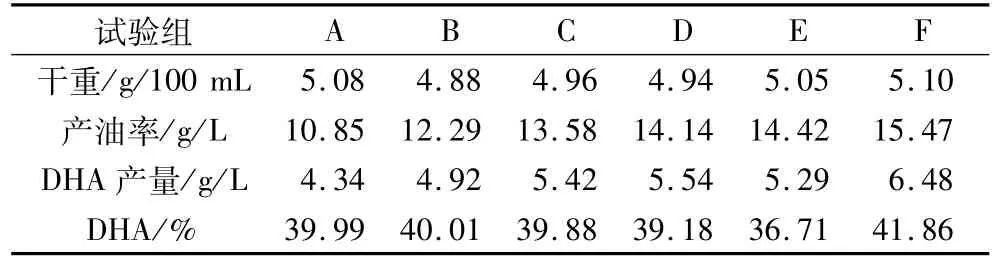
表2 对照组和试验组的干重、产油率、DHA产量及含量
3 讨论与结论
从补糖来看,5个不同的补糖试验组油脂的干重、产油率、DHA产量及含量明显高于对照组,当寇氏隐甲藻细胞受到氮源的限制,油脂浓度成指数增长。说明油脂的积累是在细胞生长受限的条件下进行的,细胞不会消耗自身合成的油脂;在线性生长时,营养限制使得细胞生长受限因此产生更多的油脂,并且充足的营养供给可能导致更多的饱和脂肪酸合成,相反氮源的限制可能使得更多的不饱和脂肪酸形成[11]。本试验结果也表明当氮源耗尽时补糖不仅可以促进油脂的产生,而且对DHA的形成也是有利的。
前72 h是寇氏隐甲藻生长的重要时期,随着发酵的不断进行,碳氮比会一直下降。当对照组发酵至120 h时,发酵液中的碳氮比约为15∶1,此时补糖的F组干重、产油率、DHA产量及含量达到本试验最高。
[1]翟中和,蔡树涛.一种原始真核细胞—寇氏隐甲藻的染色体骨架[J].电子显微学报,1991,10(4):315-316
[2]潘冰蜂,李祖义.利用海洋微藻生产富含DHA的单细胞油脂[J].中国生物工程杂志,2000,20(6):43-45
[3]M.de Swaaf,J.Pronk,L.Sijtsma.Fed-batch cultivation of the docosahexaenoic-acid-producing marine alga Crypthecodinium cohnii on ethanol[J].Applied microbiology and biotechnology,2003,61(1):40-43
[4]WANG Jufang,Wu Haizhen,Liang Shizhong,et al.Effect of nitrogen sources on the growth and docosahexaenoic acid accumulation in Crypthecodinium cohnii[J].Marina Science Bulletin,2002,4(1):87-92
[5]Ana Mendes,Alberto Reis,Rita Vasconcelos,et al.Crypthecodinium cohniiwith emphasis on DHA production:a review[J].Journal of applied phycology,2009,21(2):199-214.
[6]杨革,徐承水.隐甲藻深层培养产生二十碳五烯酸的研究[J].生物工程学报,2001,17(2):221-223
[7]郑捷,胡爱军.超声对提取海藻二十二碳六烯酸和二十碳五烯酸的影响[J].声学技术,2007,26(1):75-79
[8]王永华,梁世中,杨博,等.隐甲藻发酵产DHA最佳无机盐浓度的确定[J].中国油脂,2002,27(2):26-28
[9]杨革,孔庆娥.镧与钕对隐甲藻的生长、DHA合成及固氮活性的影响[J].中国稀土学报,2002,20(Z2):168-170
[10]Yue Jiang,Feng Chen.Effects ofmedium glucose concentration and pH on docosahexaenoic acid content of heterotrophic Crypthecodinium cohnii[J].Process Biochemistry,2000,35(10):1205-1209
[11]姜剑锋,赵丽芹,陈涛,等.寇氏隐甲藻不同破壁方法的研究[J].中国粮油学报,2011,26(8):92-94.
