内源性神经生长因子在大鼠心脏缺血再灌注急性期的表达变化
2014-03-13魏珂,敖丽,刘力,闵苏
魏 珂,敖 丽,刘 力,闵 苏
·基础研究·
内源性神经生长因子在大鼠心脏缺血再灌注急性期的表达变化
魏 珂,敖 丽,刘 力,闵 苏
目的探讨内源性神经生长因子(NGF)在大鼠心脏缺血再灌注过程中不同阶段和不同部位表达的特点。方法
神经生长因子;再灌注损伤;心肌;大鼠
其功能包括促进交感神经元突触的形成、生长,增加神经纤维与心肌组织间连接的数量等[3]。部分研究还发现,心肌缺血再灌注(ischemia-reperfusion,I/R)过程中NGF的表达增加可对抗心肌缺血后交感神经顿抑和心肌细胞凋亡[4]。本研究拟通过大鼠在体心脏观察内源性NGF在I/R过程中不同阶段和不同区域的表达特点。
1 材料与方法
1.1 实验动物模型 大鼠经腹腔注射10%水合氯醛300 mg/kg麻醉后,仰卧固定于鼠板上,术中通过热板法维持肛温37~38℃。连续监测标准肢体Ⅱ导联心电图。气管切开插管后连接TKR-200C小动物呼吸机(江西省特力麻醉呼吸设备公司)行机械通气,设定潮气量为2~3 ml/100 g,F 80~90次/min,I/E 1∶1,氧流量0.5 L/min。分离左颈总动脉,插管后连接YP100型压力换能器(成都仪器厂)以及RM6240B型多道生理信号采集处理系统(成都仪器厂)监测左室内压力变化。打开胸腔,剪开心包后充分暴露心脏,在肺动脉圆锥和左心耳之间找到左冠状动脉前降支(left anterior descending branch,LAD),6-0号细线穿过LAD的心肌表层,结扎时用一约2 mm长的橡胶圈垫于结扎线与血管之间。LAD结扎成功标志:结扎线以下心肌组织发绀并活动减弱,血压下降,ECG显示心肌梗死改变(ST段明显抬高或压低等)。
1.2 实验分组 成年雄性SD大鼠24只,鼠龄8~10 w,体重250~300 g,由重庆医科大学动物中心提供。按照随机数字表法随机分成三组(n=8):假手术组(S组)、缺血组(I组)和缺血再灌注组(I/R组)。S组开胸后于LAD下用细线穿过但不结扎,持续150 min;I组结扎LAD 30 min;I/R组结扎30 min后复灌120 min。各组术毕抽动脉血测定生化指标,取心肌标本。
1.3 实验数据采集及蛋白测定
1.3.1 血流动力学监测 记录缺血前(T0)、缺血30 min(T1)及再灌注120 min(T2)时各组大鼠心率(heart rate,HR),左室收缩压(left ventricular systol⁃ic pressure,LVSP)和舒张末压(left ventricular end diastolic pressure,LVEDP)。
1.3.2 生化指标检测 各组实验结束时颈总动脉取血,离心后用乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒、肌酸激酶(creatine kinase-MB,CK⁃MB)试剂盒(上海沪尚生物科技有限公司)检测血清中LDH、CKMB浓度。
1.3.3 免疫组化法检测不同区域心肌NGF的表达I/R组再灌注120 min后取左心室前壁(即缺血区,IS区)和右心室(即非缺血区,NIS区)心肌组织经过4%的多聚甲醛溶液固定、乙醇脱水、石蜡包埋制成表面积小于0.5 cm×0.5 cm的石蜡块,再经过切片、35℃水浴中展切、捞片后在30℃恒温干燥箱中干燥48 h,干燥后的切片再经过常规脱蜡、灭活内源性酶后,分别滴加兔抗鼠NGF抗体、生物素标记的山羊抗兔抗体,经显色、复染、再脱水,再透明,中性树脂封片。显微镜下观察拍照,NGF定位于心肌细胞的胞浆,其阳性染色均呈棕黄色。高倍镜下IS 和NIS区每张切片随机选取5个视野进行拍照,用Image-Pro Plus 6.0图像分析系统分析心肌NIS和IS区NGF阳性表达的平均光密度值,计算阳性细胞百分比。
1.3.4 Western-blot检测NGF蛋白的表达 各组在实验处理结束后立即取心尖组织80~100 mg匀浆、离心取上清液-80℃保存,提取蛋白并采用BCA方法检测蛋白浓度,每组取等量蛋白进行SDS-PAGE电泳,将蛋白转移到聚偏氟乙烯(PVDF)膜,放入含5%脱脂奶粉的封闭液中,室温振荡封闭2 h。一抗1∶1 000稀释,4℃孵育过夜。取出PVDF膜用磷酸盐吐温缓冲液(PBST液)洗膜15 min×3次。按1∶2 000的比例加入辣根过氧化物酶标记的二抗,室温下反应2 h。PBST液洗膜15 min×3次。利用MGIAS-1000多媒体凝胶成像分析系统测量条带的积分光密度值。以磷酸甘油醛脱氢酶(GAPDH)作为内参照进行校正,求灰度比值代表特异性条带的信号强弱。
1.3.5 心肌组织中NGF mRNA的表达 各组实验结束后取心尖组织液氮保存。NGF mRNA在心肌的表达水平测定通过逆转录-聚合酶链反应(RTPCR)半定量方法测定。液氮冻存的心肌组织剪碎约100 mg加入1 ml Trizol提取心肌组织中总mR⁃NA。紫外分光光度计(UV-2550)测量 A260 nm/A280 nm,计算RNA纯度及浓度。取总 RNA 2 μg,按逆转录试剂盒说明书逆转录成cDNA,取cDNA 5 μl,加入25 μl反应体系。引物:NGF上游引物5'-CCGAGCCCCGAATCCTGTA GAGAG-3'NGF下游引物5'-GGGAAGGGGGCTGCA GGCAAG-3'扩增产物211bp;GAPDH 上游引物 5'-GGGGGGAGC⁃CAAAAGGGTCA-3'GAPDH下游引物5'-CCCTC⁃CGACGCCTG CTTCA-3'扩增产物465 bp,所有引物是由上海生物工程公司合成的。反应条件为:94℃预变性5 min,94℃变性40 s,58℃退火45 s,72℃延伸50 s,30个循环,72℃最后延伸8 min,取扩增产物1 μl加样,1.5%琼脂糖凝胶电泳,成像分析扫描,以每例标本NGF与GAPDH电泳带灰度值之比作为该例标本目的基因表达的相对数值。
1.4 统计学分析 应用SPSS 20.0软件进行统计学处理和分析,计量资料采用均数±标准差(x¯±s)表示。不同时间点的比较采用重复测量方差分析,各组间指标的比较采用单因素方差分析(Least Signifi⁃cant Difference,最小显著差值法);P<0.05为差异有统计学意义。
2 结 果
2.1 血流动力学 T0时各组血流动力学指标差异无统计学意义。T1、T2时I/R组LVSP、HR较S组显著降低,LVEDP升高(P<0.05)。见表1。
表1 各组心脏不同时点LVSP、LVEDP、HR的变化(n=8,±s)
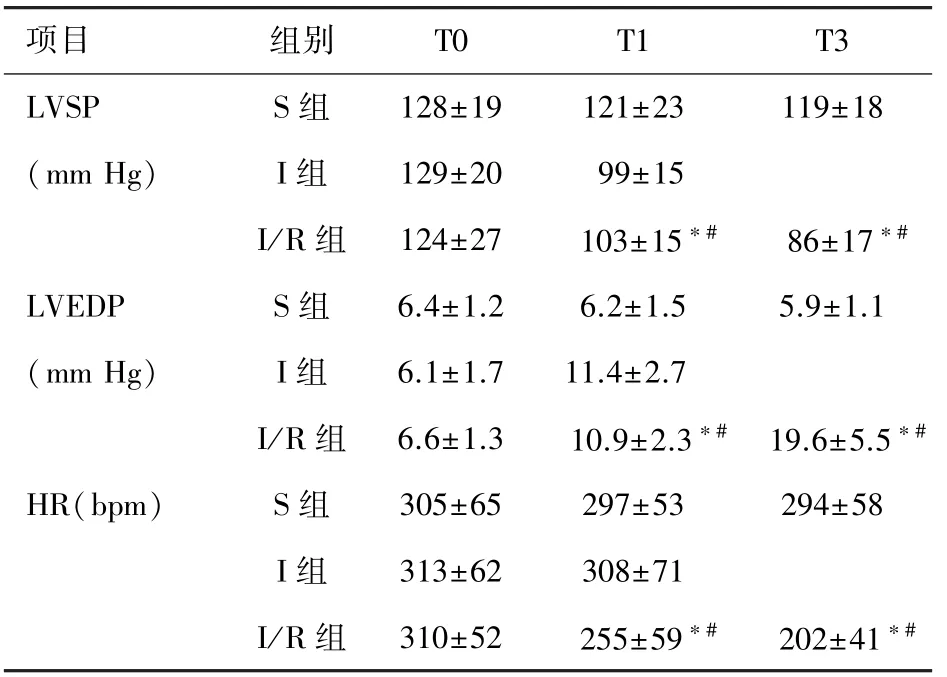
表1 各组心脏不同时点LVSP、LVEDP、HR的变化(n=8,±s)
注:与T0比较∗P<0.05;与S组比较#P<0.05。
?
2.2 心肌酶学指标 与S组相比、I组和I/R组血清CKMB、LDH浓度显著升高(P<0.05)。见表2。
表2 各组实验处理末血清CKMB和LDH浓度(n=8,±s)

表2 各组实验处理末血清CKMB和LDH浓度(n=8,±s)
注:与S组比较∗P<0.05;与I组比较#P<0.05。
组别 CKMB(IU/L) LDH(IU/L)S组 145±34 436±77 I组 1 709±274∗1 405±233∗I/R组 2 076±476∗#2 918±464∗#
2.3 不同区域心肌NGF蛋白表达 免疫组化分析显示,I/R组大鼠心肌组织IS区和NIS区均有NGF蛋白免疫组化阳性表达。IS区NGF表达水平显著高于NIS区(P<0.01)。见图1。
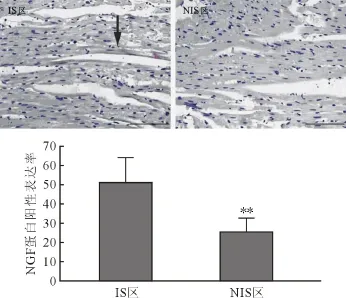
图1 I/R组大鼠IS区和NIS区心肌细胞NGF蛋白表达(SABC法免疫组化×400,DAB显色,标尺100 μm)
2.4 各组NGF蛋白表达量(Western-blot法) 与S组比较,I组、I/R组心肌组织NGF蛋白表达增加(P<0.05),I/R组心肌组织NGF蛋白表达高于I组(P<0.05)。详见图2。
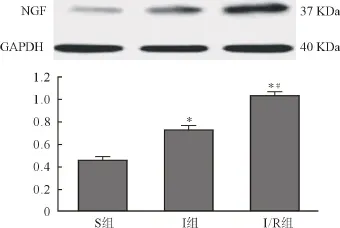
图2 各组心肌组织内NGF蛋白表达(n=8)
2.5 各组心肌组织中NGF mRNA表达(RT-PCR法) 各组大鼠心肌组织中均有NGF mRNA表达,S组心肌组织表达NGF mRNA最低。与S组比较,I组、I/R组心肌组织NGF mRNA表达增加(P<0.05),I/R组高于I组(P<0.05)。详见图3。
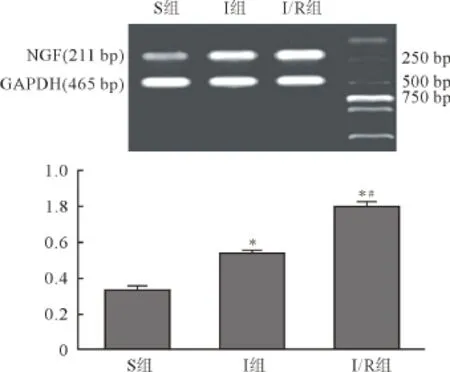
图3 各组心肌组织内NGF mRNA含量(n=8)
3 讨 论
本实验通过阻断LAD建立在体大鼠I/R模型。结果表明,心脏缺血再灌注过程中内源性NGF表达增加,在缺血区心肌该表达尤其明显。本研究还表明,在缺血末期和再灌注末期NGF的表达均有所增加,再灌注末期NGF的表达明显高于缺血末期,提示NGF的高表达在缺血刺激后即开始启动,并持续至再灌注过程中。
NGF长期以来一般被认为仅作用于神经系统,对神经元的分化、发育以及维持生理功能等具有重要作用。近年来,其显著的心血管效应引起了心血管科学家们的兴趣。NGF是心脏形成、血管发生和发育的重要调控因素之一,可影响内皮细胞、血管平滑肌细胞、心肌细胞的存活。既往,零星研究提示NGF对抗心肌缺血(/再灌注)损伤的效应可能是通过其对心脏交感神经、感觉神经等的功能保护而产生的。例如,Abe等在狗的在体冠脉阻断15 min的心肌缺血模型上,观测到外源性冠脉内给予NGF或刺激神经内源性释放NGF均能有效防止心肌缺血后的交感神经抑顿,从而改善心脏功能[5]。Hiltunen等也在大鼠在体I/R模型上观测到NGF mRNA表达的增加[6]。与既往研究一致,本研究也证实了内源性NGF在心脏I/R过程中的过表达。而且,这种缺血诱导的NGF过表达在再灌注过程中仍然持续存在,并且主要发生于缺血区,提示NGF的表达增加可能是心肌在经历缺血刺激后一种代偿性的自身保护机制。
新近发现,在大鼠心肌梗死模型上,局部的NGF基因转移能够维持心肌细胞的存活,更不同以往的是,NGF被发现能减轻离体梗死心肌细胞凋亡。Caporali等发现,NGF是心肌细胞自分泌的一种促存活因子。在表达NGF和trkA受体(NGF效应的心肌细胞膜受体)的新生大鼠心肌上,用NGF抗体或trkA抑制剂K252a均能够引起心肌细胞凋亡。在培养的心肌细胞上,以能引起细胞凋亡的缺氧/复氧(hypoxia/reoxygenation,H/R)或血管紧张素Ⅱ(angiotensionⅡ,ANGⅡ)处理后,NGF的表达明显增加;而对这两种处理的NGF-trkA通路进行阻断后,心肌细胞的凋亡显著加剧。而且,在新生和成年大鼠心肌细胞的H/R或ANG II处理模型上,以基因转移或重组蛋白方式外源性地增高NGF水平能保护细胞免受凋亡[7]。上述现象提示了NGF对病理性损伤心肌细胞的保护效应可源于其心脏神经调节以外的直接效应。
NGF减轻心肌I/R损伤的机制,尤其是非神经源性的保护机制目前仍不清楚。本研究未涉及内源性NGF过表达在I/R过程中对心肌的保护作用及其机制,而相关的研究仍然不多。最近的研究在PC12细胞上发现,NGF激活的磷脂酰肌醇3-激酶-Akt(PI3K-Akt)信号通路,可通过增加GRP78的表达拮抗2-脱氧-d-葡萄糖模拟的内质网应激(endo⁃plasmic reticulum stress,ERS)引发的凋亡[8]。ERS是同样是心肌I/R过程细胞凋亡的主要机制之一[9]。因此,NGF的心肌保护作用是否通过PI3KAkt信号通路仍有待证实。
综上所述,本研究通过在体大鼠I/R心脏表明,心肌缺血可诱发内源性NGF的代偿性过表达,该表达可持续至再灌注过程中,并且在缺血区心肌细胞中尤其明显。
[1] Lopez AD,Mathers CD.Measuring the global burden of disease and epidemiological transitions[J].Ann Trop Med Parasitol,2006,100(5-6):481-499.
[2] Govoni S,Pascale A,Amadio M,et al.NGF and heart:Is there a role in heart disease[J]?Pharmacol Res,2011,63 (4):266-277.
[3] Caporali A,Emanueli C.Cardiovascular actions of neurotrophins [J].Physiol Rev,2009,89(1):279-308.
[4] Strande JL,Routhu KV,Lecht S,et al.Nerve growth factor re⁃duces myocardial ischemia/reperfusion injury in rat hearts[J].J Basic Clin Physiol Pharmacol,2013,24(1):81-84.
[5] Abe T,Morgan DA,Gutterman DD.Protective role of nerve growth factor against postischemic dysfunction of sympathetic coronary innervation[J].Circulation,1997,95(1):213-220.
[6] Hiltunen JO,Laurikainen A,Vakeva A,et al,Saarma M.Nerve growth factor and brain-derived neurotrophic factor mR⁃NAs are regulated in distinct cell populations of rat heart after ischaemia and reperfusion[J].J Pathol,2001,194(2):247 -253.
[7] Caporali A,Sala-Newby GB,Meloni M,et al.Identification of the prosurvival activity of nerve growth factor on cardiac myo⁃cytes[J].Cell Death Differ,2008,15(2):299-311.
[8] Kishi S,Shimoke K,Nakatani Y,et al.Nerve growth factor at⁃ tenuates 2-deoxy-d-glucose-triggered endoplasmic reticulum stress-mediated apoptosis via enhanced expression of GRP78 [J].Neurosci Res,2010,66(1):14-21.
[9] Rutkowski DT,Kaufman RJ.That which does not kill me makes me stronger:adapting to chronic ER stress[J].Trends Bio⁃chem Sci,2007,32(10):469-476.
The expression of endogenous nerve growth factor in rat hearts during acute is⁃chemia reperfusion injury
Wei Ke,Ao Li,Liu Li,Min Su
Department of Anesthesiology,First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
Min Su,Email:ms89011068@163.com
ObjectiveTo investigate the expression of endogenous nerve growth factor(NGF)in the different part of the is⁃chemic rat hearts during different stage of ischemia and reperfusion.MethodsTwenty-four healthy male SD rats aged 8-10weeks weighing 200-300 g were randomly assigned to one of the 3 groups(n=8):sham group(Group S),ischemia group(Group I)and ischemia-reperfusion group(Group I/R).Hemodynamics of left ventricular was monitored during the operation.Left anterior descend⁃ing coronary artery(LAD)of the rat hearts were separated without clamping in Group S.LAD was clamped for 30 min without unclamping in Group I.The hearts were undergoing 30 min of ischemia and 120 min of reperfusion by clamping and unclamping of the LAD in Group I/R.Blood samples were collected from arterial carotis communis at the end of the operation for determination of creatine kinase-MB(CKMB)and lactate dehydrogenase(LDH)activity.The animals were then sacrificed and myocardial specimens were ob⁃tained from the left and right ventricular for NGF expression assay by immune-histochemistry.Myocardia from the tip of the hearts were collected for the determination of the expression of NGF and NGF mRNA in each group by Western-blot and RT-PCR.ResultsA dramatic decrease of cardiac function at the end of ischemia and reperfusion was observed in Group I and Group I/R,CKMB and LDH were also significantly decreased(P<0.05).Eexpressions of NGF and NGF mRNA in the Group I and Group I/R were both in⁃creased,and Group I/R was with a significant higher level(P<0.05).In the hearts undergoing ischemia and reperfusion,NGF ex⁃pression in the ischemic area was higher than that in the none-ischemic area within the same heart(P<0.05).ConclusionMyocar⁃dial ischemia may trigger the increasing expression of endogenous NGF and continue to the reperfusion stage,this overexpression of NGF is more obvious in ischemic area of the heart.
Nerve growth factor;Reperfusion injury;Myocardium;Rat心脏缺血再灌注损伤(ischemia reperfusion inju⁃ry,IRI)仍然是复灌心肌面临的主要问题[1],能否有效防治IRI直接关系到治疗效果和预后。神经生长因子(nerve growth factor,NGF)是神经营养素家族中的一员,长期以来一般被认为仅作用于神经系统[2]。近年来发现,心肌细胞能产生并分泌NGF,
2013⁃09⁃12)
2013⁃09⁃30)
10.13498/j.cnki.chin.j.ecc.2014.01.14基金项目:国家自然科学基金青年基金资助项目(81000066)作者单位:400016重庆,重庆医科大学附属第一医院麻醉科通讯作者:闵 苏,Email:ms89011068@163.com
健康清洁级雄性SD大鼠24只,鼠龄8~10周,体重200~300 g,随机分为3组(n=8):假手术组(S组)、单纯缺血组(I组)和缺血再灌注组(I/R组),术中监测左心血流动力学。S组左冠状动脉前降支(LAD)仅穿线,不结扎,持续观察150 min后抽血取心肌标本;I组结扎LAD 30 min;I/R组结扎LAD 30 min后,复灌120 min制备心脏缺血再灌注损伤模型。各组实验处理结束后在颈总动脉处采血测定血清肌酸激酶(CKMB)和乳酸脱氢酶(LDH)的浓度,然后处死大鼠。I/R组分别取左室和右室心肌组织用免疫组化法观察NGF的表达。各组取心尖组织心肌Western-bloting测定NGF的表达;RT-PCR检测各组NGF mRNA的表达。结果与S组相比,I组和I/R组在缺血和再灌注末期左心功能明显降低,血清LDH、CKMB浓度升高,心肌组织中NGF mRNA和NGF蛋白表达均明显增加(P<0.05),I/R组高于I组;在经历I/R的心脏中,缺血区NGF表达高于非缺血区(P<0.05)。结论心肌缺血能诱发内源性NGF的表达增加并持续至再灌注过程,这种NGF的高表达在缺血区心肌中尤其明显。
