Stanford-A型主动脉夹层外科治疗的动脉插管策略及评价
——附85例报道
2014-03-13徐凌峰
郭 震,徐凌峰,常 昕,李 欣
·临床经验·
Stanford-A型主动脉夹层外科治疗的动脉插管策略及评价
——附85例报道
郭 震,徐凌峰,常 昕,李 欣
目的 回顾上海交通大学附属胸科医院Stanford-A型主动脉夹层外科治疗的动脉插管策略、并发症及转归,分析插管策略的选择及相关并发症的防治。方法2009年至2011年,共对85例主动脉夹层患者进行了直视手术治疗,分析手术中经由升主动脉、股动脉、腋动脉直接插管和腋动脉人造血管吻合插管建立体外循环的优缺点及中枢神经系统事件、出血、脏器灌注不足等相关并发症的发生率。所有患者中升主动脉置换32例,半弓替换28例,全弓加“象鼻”替换17例,升主动脉替换加去分支技术8例。采用升主动脉、股动脉和右腋动脉插管分别为22(25.9%)、35(41.2%)和28(32.9%)例,其中腋动脉人造血管吻合插管11例。结果住院期间共13例(15.3%)患者死亡,死亡原因分别为无法控制的出血、低心排、肾功能衰竭、肺部感染、脑卒中。并发症中插管部位出血和脑卒中的发生率最高,仅股动脉插管患者有脏器灌注不足发生(3/35,8.5%)。结论根据病变范围和术式及患者的个体化情况慎重选择插管位置,股动脉和锁骨下动脉均可成为可靠的插管部位,通过术前认真评估、术中仔细操作,并发症发生率可控制在较低水平。
体外循环;插管;并发症;主动脉夹层
主动脉夹层(Stanford A或De-BakeyⅠ、Ⅱ)是死亡率和并发症率较高的心脏外科疾病,体外循环下手术治疗是主要治疗方式之一。因病变主要累及
升主动脉及主动脉弓,常无法使用常规的升主动脉插管建立体外循环,因而股动脉、腋(锁骨下)动脉成为常见的替代插管部位。这些插管部位各有其优缺点,选择策略常受到病变累及范围、手术方式、外周血管病变等因素的影响。股动脉是此类手术的经典插管部位,但可能导致下肢缺血、脏器灌注不足、脑卒中等问题[1]。而腋(锁骨下)动脉则可以避免这些问题,最大可能保证真腔供血,便于实施顺行选择性脑灌注进行脑保护[2]。本研究回顾了近三年上海市胸科医院升主动脉夹层和动脉瘤的插管策略及并发症,分析了不同插管部位的优缺点及并发症的防治。
1 资料与方法
1.1 患者基本资料 从2007年至2011年,共对85 例A型主动脉夹层和动脉瘤患者进行了外科修复,其中男性58例,女性27例,年龄32~66(46.3±16.7)岁。合并冠状动脉粥样硬化性心脏病5例,合并二尖瓣返流2例。全组患者均经超声心动图、CT和(或)核磁共振明确诊断和病变程度。病变受累范围、破口位置、手术方式及插管等情况详见表1。
1.2 插管策略和方法 本组升主动脉瘤未破裂形成夹层或夹层局限于半弓范围之内时首选股动脉插管;夹层累及全弓甚至膈肌以远时首选右侧腋动脉插管;病变仅局限升主动脉且有足够插管空间,预计不会停循环时可首选升主动脉或弓部插管,如Ben⁃ tall或David术等。股(腋)动脉插管选用17~21 Fr动脉插管(Bio-Medicus®cannula,Medtronic,Mich,USA)。静脉引流通过右房二级插管建立,如同时合并心内操作可选用上、下腔分别插管,如瘤体巨大需要开胸前建立体外循环则选用股静脉插管,必要时开胸后改为右房二级插管。手术台上将供血管分为两支,采用“单泵双管法”进行管理,以便在手术的不同阶段进行供血管位置的转换和脑保护。
股动脉插管时,在腹股沟下方做长3~5 cm的纵切口并暴露股动脉。股动脉两端套阻断带,肝素化后在股深动脉远端做横切口插管,之后收紧两端阻断带并妥善固定。右腋动脉插管时,在右锁骨下方约1~2 cm处做长3~5 cm的横切口并显露腋动脉。腋动脉两端套阻断带,肝素化后阻断腋动脉两端,中间做一长度约为血管周长的1/2~2/3横切口进行插管,之后收紧两端阻断带并妥善固定。操作中注意保护臂丛神经。如动脉较细或位置较深时,通过端侧吻合8 mm的人造血管进行插管。
插管后通过观察是否有明确的回血,泵压与患者血压是否相近,通过泵入50~100 ml液体后泵压有无明显增高来确认插管位置,排除插入夹层的可能。体外循环结束后动脉直接插管的横切口用5-0 Prolene线单层连续缝合关闭。端侧吻合的人造血管则在吻合口远端5~10 mm处横断,5-0 Prolene线单层连续缝合关闭。
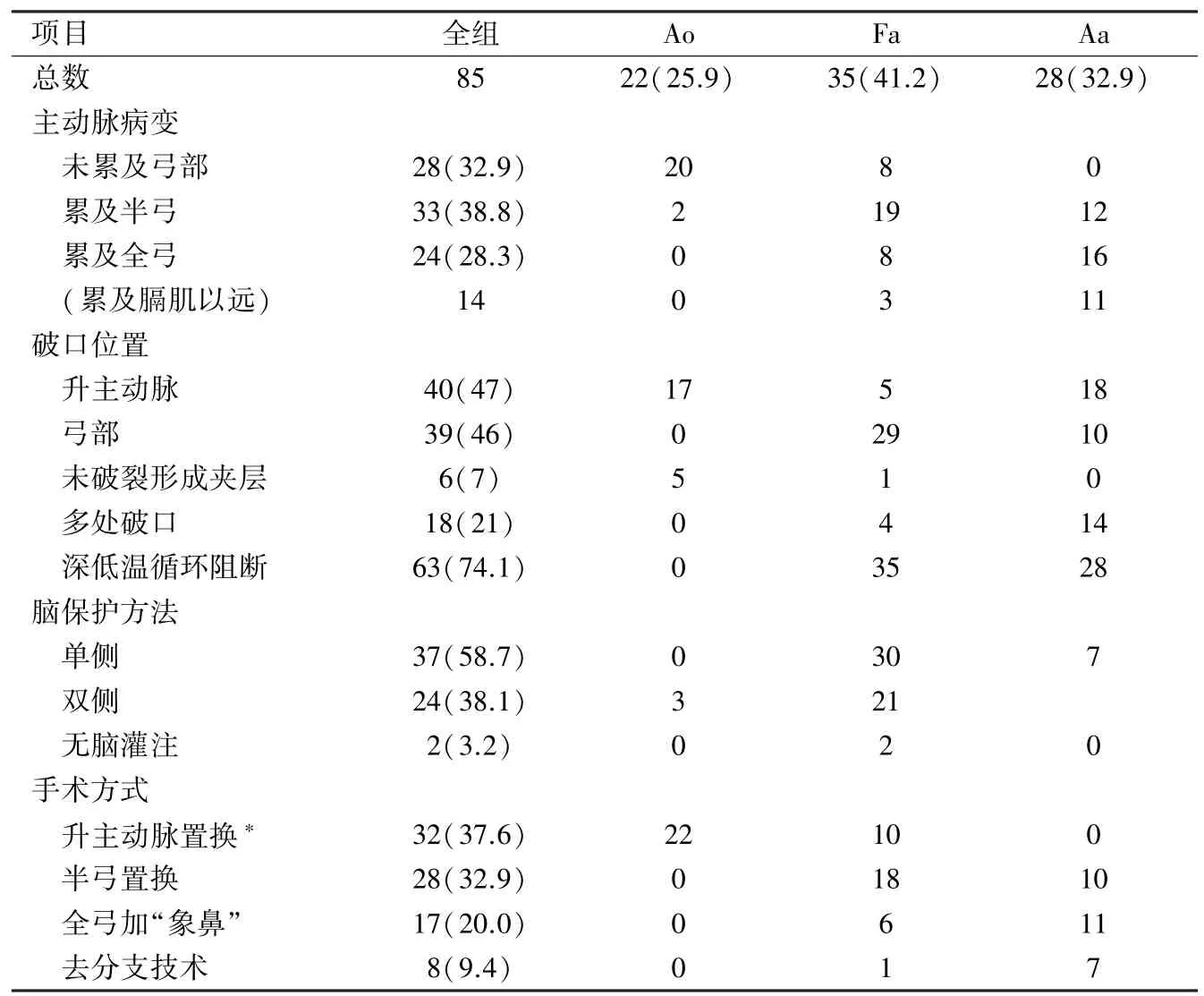
表1 病变范围及手术技术情况[例(%)]
1.3 体外循环管理 体外循环采用膜式氧合器(泰尔茂或美敦力公司)及体外循环管道套包(祥盛,上海)。预充乳酸林格液和羟乙基淀粉(130/0.4),晶胶比例为2∶1。4∶1含血停搏液结合冠状静脉窦口逆行灌注和冠状动脉窦开口直视灌注进行心肌保护。深低温停循环时,根据手术范围和术式以及Willis环是否健全进行单侧或双侧选择性脑灌注,灌注通过右侧腋动脉或颈内动脉直接插管,流量依据灌注方式、灌注部位以及灌注压力维持在5~15 ml/(kg·min)。使用近红外反射光谱(NIRS)技术监测双侧脑氧饱和度,停循环期间维持脑氧饱和度50%~70%。通过鼻咽部和膀胱监测头部温度和中心体温,停循环期间核心温度维持在18~22℃,常规使用冰帽。复温时鼻咽温与水温梯度不超过5℃,最高水温不超过37.5℃。在双侧桡动脉和单侧足背动脉(选取非股动脉插管的一侧)进行血压监测,通常维持灌注压50~70 mm Hg。体外循环开始后给予甲泼尼龙30 mg/kg,温度降至28℃给利多卡因2 mg/kg,复温>26℃给甘露醇1 g/kg。体外循环中红细胞比容维持于0.25,结束时大于0.30。全程使用α稳态进行血气管理。
1.4 插管并发症定义 动脉插管相关并发症主要包括插管部位出血、动脉损伤、肢体缺血、假腔供血导致的脏器供血不良以及不同程度的中枢神经系统并发症。动脉损伤指需要外科修复或重建的情况。肢体缺血指出现功能障碍、坏死或筋膜间隔综合征等,肢体苍白和脉搏减弱不包括在内。假腔供血导致的脏器供血不良发生在头侧通过双侧桡动脉压和脑氧饱和度的变化判断,发生在膈肌下通过体外循环中尿量变化来判断。中枢神经系统并发症根据严重程度分为:①围术期可恢复的短期神经系统功能障碍(包括意识淡漠、躁狂、谵妄等);② 影像学资料证实的脑卒中;③ 严重神经系统功能障碍,包括不同程度的截瘫、偏瘫和植物人。
2 结 果
全组共13例(15.3%)患者死亡,其中无法控制的出血3例,低心排2例,肾功能衰竭3例,肺部感染1例,脑卒中4例。出血、肢体缺血、中枢神经系统事件等并发症情况见表2。1例股动脉插管患者,主动脉阻断后双侧桡动脉血压降至10~15 mm Hg,紧急改为腋动脉插管后血压恢复,因低血压时间持续约20 min,导致术后植物人。
3 讨 论
在急性Stanford-A型主动脉夹层、胸主动脉瘤、再次手术和机器人辅助等复杂和微创心脏直视手术,以及升主动脉严重钙化和粥样硬化的患者中,常常无法通过升主动脉插管建立体外循环。此时,股动脉和腋(锁骨下)动脉成为最常见的替代位置,插管部位的选择因适应证的不同而异[3-5]。在主动脉夹层的外科治疗中,尽管诊断和外科技术不断进步,但围术期死亡率和并发症发生率仍然较高,夹层所致的中枢神经系统和内脏器官的灌注不足以及脑保护不理想是影响围术期并发症和死亡率的重要因素[6]。这些问题很大程度上取决于插管方案的选择。
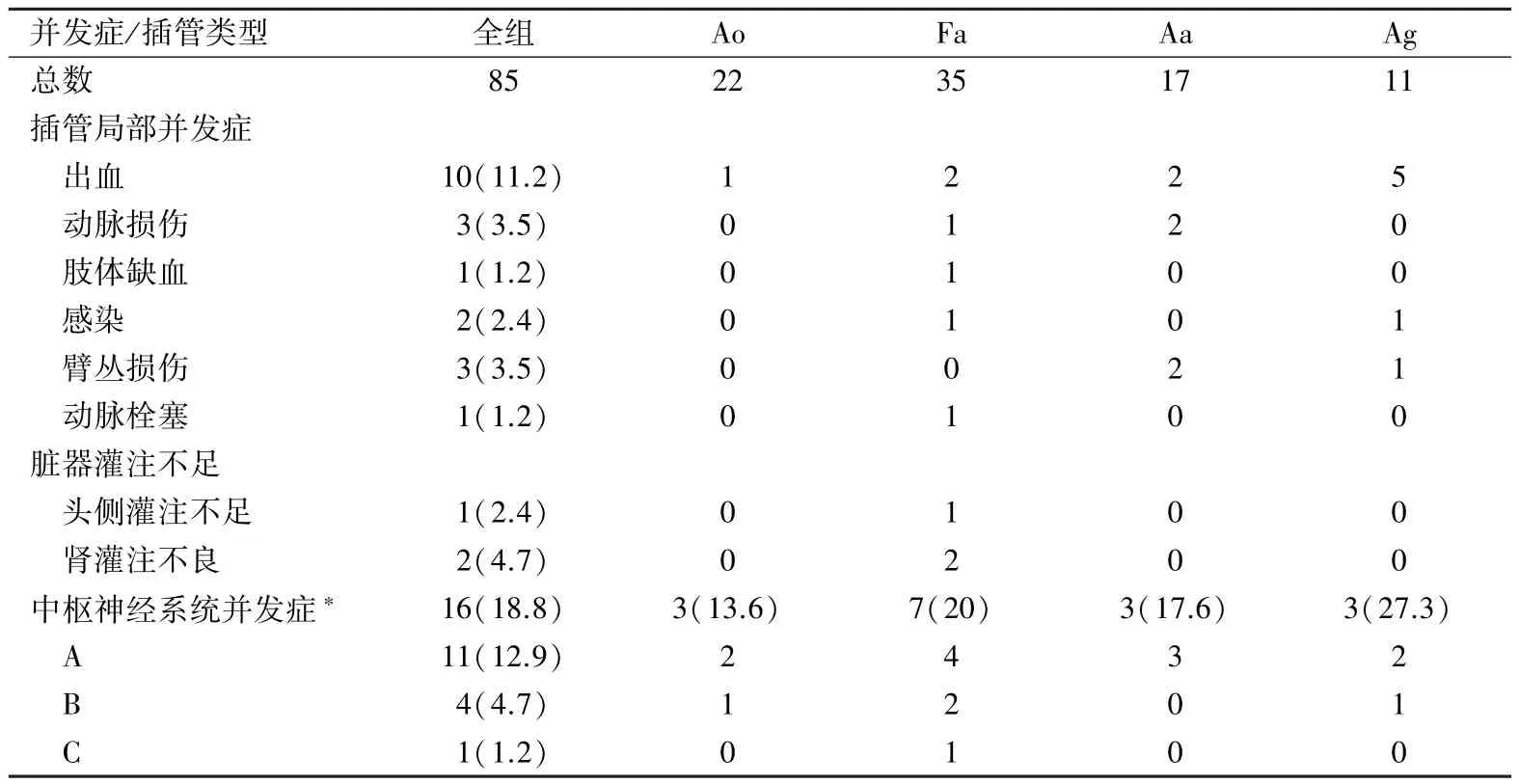
表2 动脉插管并发症情况[n(%)]
选择合适的动脉插管策略是降低并发症和死亡率的关键因素之一。动脉插管策略指插管位置的选择和相适应的脑灌方法。这主要根据主动脉夹层的累及范围和手术方式,以及不同插管部位的特点和并发症而决定。股动脉插管自上世纪50年代即用于体外循环,曾是主动脉夹层的标准插管部位,因插管技术相对简单便捷得到广泛使用[1]。但因其逆行灌注所致的脏器灌注不足和高发的脑卒中率而一直受到诟病,多项研究显示股动脉逆行灌注有如下的不足[1,3]:① 导致夹层逆行扩大;② 产生“活瓣”效应和假腔供血,导致中枢神经系统、上臂、肾和腹腔脏器灌注障碍;③ 假腔供血、逆行血流冲刷血管壁上粥样硬化斑块导致栓塞增加脑卒中发生率;④相比腋动脉,更易被粥样硬化和广泛的夹层累及;⑤并发下肢缺血;⑥不便进行顺行选择性脑灌注。本组中41.2%的患者使用了股动脉插管,其脏器灌注障碍和中枢神经系统并发症控制在15%之内。为了减少股动脉并发症的发生,笔者将股动脉插管仅用于病变累及升主动脉或半弓的患者,此类患者通常只有一个位于升主动脉或弓部的破口,脏器灌注不足发生率较低。也有学者报道通过术前对股动脉的认真评估和超声的监测来控制并发症的发生,如术前能通过影像学资料和双侧桡动脉与足背动脉血压来判断股动脉和腋动脉是否被粥样硬化或夹层累及[5],准确判断夹层累及范围和破口的位置;股动脉通过导引钢丝插管,并经食道超声确认导引钢丝进入真腔再插管,同时通过彩色多普勒判断是否真腔供血,通过上述手段,股动脉插管并发症可以得到有效控制[1,3,5]。经密切的监测和慎重的选择虽然可将并发症控制在较低水平,但脏器灌注不足仍不可避免,且致死率较高。发生在脊髓、肠系膜、肾脏等部位的灌注不足往往临床症状不显著,术中不易发现,术后会导致严重的并发症[7]。本组中3例患者出现明确证据证实的脏器灌注不足,2例患者体外循环中无尿提示肾灌注不良,1例患者体外循环开始后双侧桡动脉血压骤降提示上半身灌注不佳,最终导致两例死亡、1例植物人状态。为了避免股动脉插管的这些不足,在病变累及全弓、存在两个以上破口或明确采用深低温停循环技术的患者中优先选用腋(锁骨下)动脉插管。从1995年开始,腋(锁骨下)动脉插管作为股动脉的替代部位应用于A型主动脉夹层患者[8]。多数研究认为它可以最大程度保证真腔供血,避免内脏器官的灌注不足,减少脑卒中的发生[2,9]。除此之外,腋动脉和锁骨下动脉插管的优势还表现在[4,6,10]:① 颈肩部动脉侧支循环丰富,不易发生远端肢体缺血;② 不易被粥样硬化和夹层累及;③避免逆行栓塞和夹层范围的扩大;④ 方便进行选择性脑灌注。但腋(锁骨下)动脉插管需要更加精细的操作和更长的时间,容易损伤臂丛神经造成右臂麻痹和部分功能丧失,在个别患者位置较深不易插管。Gulbins等认为在深低温停循环患者中,腋动脉插管与股动脉相比,可明显降低中枢神经系统并发症[4]。顺行选择性脑灌被认为是目前最理想的脑保护方法,而腋动脉插管可以很方便与之配合的进行脑保护,甚至在25℃也能取得良好的效果,这大大降低了深低温带来的副作用[11]。本组中32.9%的患者选用了腋动脉插管,术中无一例患者出现可证实的脏器灌注不足。但由于腋动脉主要用于需要深低温停循环的患者,故中枢神经系统并发症并不低于股动脉插管。
升主动脉插管已较少用于A型主动脉夹层,本组仅在病变未累及弓部,确定不需要深低温停循环或开放探查远端病变,且有足够范围的正常动脉壁用于插管的患者中使用升主动脉插管。对于A型主动脉夹层体外循环最佳插管位置的选择一直存在争议,应根据病变范围和术式选择最适合的插管位置,并通过精细的操作和密切的监测控制插管相关并发症的发生[3-4,12]。腋动脉的插管技术有直接插管和吻合人造血管插管两类。人造血管吻合耗时长、技术要求较高,有时会导致远端肢体高灌注综合征,全肝素化后吻合口针孔易出血,体外循环时间较长时不可忽视;但此方法不会导致远端肢体缺血,拔管后处理相对便捷,且脑灌时可通过右侧桡动脉灌注压评估灌注效果。本组研究中,腋动脉插管部位出血是一个突出的并发症,个别体外循环时间较长的患者失血明显,甚至影响了血流动力学的稳定,Ag组出血发生率尤为明显(5/11,45.5%)。这与插管技术不熟练和人造血管吻合插管时吻口不佳相关,精细的人造血管吻合并在吻口周围涂抹生物胶等止血材料尤为重要。本组中仅有3例患者出现右手麻痹症状,笔者认为这与腋动脉游离时臂丛神经损伤相关,与插管方式无关。Sabik等认为腋动脉直接插管更易发生动脉和臂丛神经损伤,且拔管后直接缝合动脉切口容易导致狭窄,而通过吻合人造血管插管则可以避免这些并发症的发生,建议常规使用人造血管吻合插管[13]。Svensson等在1 336例大样本复杂心脏外科手术的插管部位比较中也证实腋动脉人造血管吻合插管并发症最低,是值得推荐的插管方法[14]。本组病例中除出血在Ag组稍高外,两种方式臂丛和动脉损伤发生率均较低。得益于颈肩部侧支循环丰富的解剖特点[2],本组中两种插管方式均无缺血并发症发生。笔者的经验是在动脉位置较深,直接插管困难时选择人造血管吻合插管,以减少对动脉和臂丛神经的损伤,拔管后处理便捷,无需修补插管切口,可避免狭窄的发生。
在主动脉夹层术中,通常通过双侧桡动脉和单侧足背动脉(选取非股动脉插管的一侧)三个部位进行血压监测。在体外循环开始和主动脉阻断两个时间点重点监控不同部位血压的变化,同时结合体外循环期间的尿量来判断脏器灌注不足及范围。本组中1例股动脉动插管的A型夹层患者,主动脉阻断后双侧桡动脉血压降至10~15 mm Hg,双侧脑氧饱和度也相应下降,足背动脉血压正常,此时主动脉已切开,无法恢复自身心脏灌注,紧急改为腋动脉插管,但腋动脉插管时间较长,低血压时间持续20 min,最终导致术后植物人状态。在A型主动脉夹层的外科治疗中,上述三个部位的血压监测是重要而必须的。在体外循环开始和主动脉阻断两个时间点,原有的血流模式发生改变,最易发生假腔和真腔供血的相互转变,此时应密切监测不同部位的血压变化,没有血压的异常改变方可进行进一步操作。如压力异常变化,可中断体外循环或重新开放主动脉,恢复原有血流模式,重新选择插管策略。此外,双侧桡动脉压力监测还可作为停循环期间顺行选择性脑灌流量调节的参考指标。
除股动脉和腋动脉之外,也有学者提出经心尖升主动脉插管或升主动脉穿刺插管的方法。Wada等[15]通过左室心尖插入插管,在食道超声的引导下插管经主动脉瓣直接插入升主动脉(见图1A),降至目标温度后拔除供血管,停循环完成远端吻口,之后通过人造血管侧支插管完成剩余操作。升主动脉穿刺插管通常利用经皮血管穿刺(Seldinger)技术经升主动脉夹层未累及的动脉壁区域穿刺进行(见图1B),体外循环建立降至目的温度停循环后拔出插管,切除包括插管部位的病变动脉,做好远端吻合口后供血管移至人造血管侧路完成剩余操作[16]。上述方法可以避免外周插管及相关并发症,在原有顺行灌注模式的基础上快速、便捷的建立体外循环,但有继发夹层破裂或是继发主动脉瓣返流等问题。另有学者提出升主动脉切开直接插管的方法,开胸经右房二级插管建立部分体外循环后,引流右房血液至储血罐,直至动脉压<30 mm Hg,直视下横断升主动脉,辨明真腔后直接插入供血管建立体外循环。该方法简单而快捷,不增加外周插管的额外创伤和相关并发症,并保证顺行真腔供血[17-18]。上述升主动脉开放或闭合穿刺的插管方法临床应用尚不广泛,还需要进一步评价,仅建议在血流动力学不稳定的急诊A型动脉夹层患者中使用[19],可以快速、便捷的建立体外循环,并最大程度的避免脏器灌注不良。

图1 插管示意图
本文是回顾性的临床观察和经验总结,在A型升主动脉夹层的外科治疗中,对不同病变范围和术式中动脉插管位置的选择进行回顾和分析,以供临床参考。而不是对不同插管方式的随机前瞻性研究,没有进行严格的统计学分析,没有完善的远期随访资料,不能对插管相关并发症进行确切论证。如要对A型主动脉夹层术中不同插管部位的并发症进行严格的科学分析,需要更大的样本,根据不同病变范围和术式科学的分组,对插管相关并发症进行准确定义并排除术前因素的影响,进行随机前瞻性的研究。
结论,根据病变范围和术式及患者的个体情况慎重选择插管位置,通过术前认真评估,术中精细的操作和密切的监测,并发症发生率可控制在较低水平,股动脉和腋(锁骨下)动脉均可成为可靠的插管部位。
[1] Shimokawa T,Takanashi S,Ozawa N,et al.Management of in⁃traoperative malperfusion syndrome using femoral artery cannula⁃tion for repair of acute type A aortic dissection[J].Ann Thorac Surg,2008,85(5):1619-1624.
[2] Neri E,Massetti M,Capannini G,et al.Axillary artery cannu⁃lation in type a aortic dissection operations[J].J Thorac Cardio⁃vasc Surg,1999,118(2):324-329.
[3] Fusco D S,Shaw R K,Tranquilli M,et al.Femoral cannulation is safe for type a dissection repair[J].Ann Thorac Surg,2004,78(4):1285-1289.
[4] Gulbins H,Pritisanac A,Ennker J.Axillary versus femoral can⁃nulation for aortic surgery:Enough evidence for a general recom⁃mendation[J]?Ann Thorac Surg,2007,83(3):1219-1224.
[5] Lee HK,Kim GJ,Cho JY,et al.Comparison of the outcomes between axillary and femoral artery cannulation for acute type a aortic dissection[J].Korean J Thorac Cardiovasc Surg,2012,45(2):85-90.
[6] Moizumi Y,Motoyoshi N,Sakuma K,et al.Axillary artery can⁃nulation improves operative results for acute type a aortic dissec⁃tion[J].Ann Thorac Surg,2005,80(1):77-83.
[7] Pacini D,Leone A,Belotti LM,et al.Acute type a aortic dis⁃section:Significance of multiorgan malperfusion[J].Eur J Car⁃diothorac Surg,2013,43(4):820-826.
[8] Sabik JF,Lytle BW,McCarthy PM,et al.Axillary artery:An alternative site of arterial cannulation for patients with extensive aortic and peripheral vascular disease[J].J Thorac Cardiovasc Surg,1995,109(5):885-890.
[9] Hedayati N,Sherwood JT,Schomisch SJ,et al.Axillary artery cannulation for cardiopulmonary bypass reduces cerebral microem⁃boli[J].J Thorac Cardiovasc Surg,2004,128(3):386-390.
[10] Strauch JT,Spielvogel D,Lauten A,et al.Axillary artery can⁃nulation:Routine use in ascending aorta and aortic arch re⁃placement[J].Ann Thorac Surg,2004,78(1):103-108.
[11] Pacini D,Leone A,Di Marco L,et al.Antegrade selective cere⁃bral perfusion in thoracic aorta surgery:Safety of moderate hypo⁃thermia[J].Eur J Cardiothorac Surg,2007,31(4):618-622.
[12] Reece TB,Tribble CG,Smith RL,et al.Central cannulation is safe in acute aortic dissection repair[J].J Thorac Cardiovasc Surg,2007,133(2):428-434.
[13] Sabik JF,Nemeh H,Lytle BW,et al.Cannulation of the axil⁃lary artery with a side graft reduces morbidity[J].Ann Thorac Surg,2004,77(4):1315-1320.
[14] Svensson LG,Blackstone EH,Rajeswaran J,et al.Does the arterial cannulation site for circulatory arrest influence stroke risk J]?Ann Thorac Surg,2004,78(4):1274-1284.
[15] Wada S,Yamamoto S,Honda J,et al.Transapical aortic cannula⁃tion for cardiopulmonary bypass in type a aortic dissection opera⁃tions[J].J Thorac Cardiovasc Surg,2006,132(2):369-372.
[16] Suzuki T,Asai T,Matsubayashi K,et al.Safety and efficacy of central cannulation through ascending aorta for type A aortic dissection[J].Interact Cardiovasc Thorac Surg,2010,11 (1):34-37.
[17] Conzelmann LO,Kayhan N,Mehlhorn U,et al.Reevaluation of direct true lumen cannulation in surgery for acute type A aor⁃tic dissection[J].Ann Thorac Surg,2009,87(4):1182-1186.
[18] Conzelmann LO,Weigang E,Mehlhorn U,et al.How to do it:direct true lumen cannulation technique of the ascending aorta in acute aortic dissection type A[J].Interact Cardiovasc Tho⁃rac Surg,2012,14(6):869-870.
[19] Bockeria LA,Malashenkov AI,Rychin SV.eComment.Acute aortic dissection type A:which strategy of the arterial perfusion to choose[J]?Interact Cardiovasc Thorac Surg,2012,14 (6):870-871.
Strategy and evaluation of artery cannulation for repair of acute type A aortic dissection:clinical report and reviews of experience of 85 cases
Guo Zhen,Xu Ling-feng,Chang Xin,Li Xin
Department of Cardiopulmonary Bypass,Shanghai Chest Hospital,Shanghai JiaoTong University,Shanghai,200030,China
Li Xin,Email:lee21@hotmail.com
ObjectiveTo review the cannulation strategies and associated complications in the treatment of acute type A aortic dissection(AAAD)in the Shanghai Chest Hospital,analyze the choice of cannulation site and investigate the etiology and preventive procedures for the complication.MethodsWe examined data of 85 patients with AAAD,cannulated through ascending aorta,axillary artery(with side graft or direct cannulation)or femoral artery between January 2009 and December 2011.Neurological event,bleeding and malperfusion related to the approach and technique were retrospectively analyzed.Extension of replacement include ascending aorta (with or without aortic valve replacement,n=32),hemiarch(n=28),total arch(with or without elephant trunk technique,n=17)and ascending arota with debranch technique(n=8).Arterial access for cardiopulmonary bypass was usually via the ascending aorta in 25.9%(n=22),femoral artery in 41.2%(n=35)and axillary artery in 32.9%(n=28),while the axillary artery cannulation was performed using the'side graft technique'in 21.9%(n=11).ResultsThe in-hospital mortality rate was 15.3%(n=13)and the cause of death were intractable haemorrhage,low cardiac output,renal failure,pulmonary infection and stroke.Bleeding and stroke were the most common complications associated with cannulation and malperfusion was occurred only in the patients cannulated by fem⁃oral artery(3/35,8.5%).ConclusionAxillary and femoral artery are safe cannulation site,which are tailored to extend of dissec⁃tion,operative procedure and individual patients status.The perioperative complications can be well controlled by careful assessment and accurate cannulaplacement.
Cardiopulmonary bypass;Cannulation;Complication;Aortic dissection
2013⁃03⁃21)
2013⁃05⁃07)
10.13498/j.cnki.chin.j.ecc.2014.01.11
200030上海,上海交通大学附属胸科医院体外循环室
李欣,Email:lee21@hotmail.com
