低温治疗在小儿体外膜肺氧合患者中的应用
2014-03-13WarwickButt
楼 松,Warwick Butt
·临床研究·
低温治疗在小儿体外膜肺氧合患者中的应用
楼 松,Warwick Butt
目的描述小儿体外膜肺氧合(ECMO)患者进行低温治疗的方法,比较低温和常温患者ECMO及低温相关并发症的发生率,研究ECMO期间低温治疗和院内死亡率及长期生存率的关系。方法 回顾性分析2005年至2011年ECMO患者临床资料,包括ECMO前情况、ECMO建立及管理信息、ECMO和低温的治疗过程以及相关并发症和预后。根据ECMO期间是否进行低温治疗分为常温组及低温组,并将所收集的资料进行单因素分析。单因素分析提示两组间不一致的变量(P<0.1)纳入逻辑回归以评估低温治疗对院内死亡率的影响。在成功撤除ECMO的患者中,重复上述单因素分析。组间不一致的变量(P<0.1)纳入Cox回归以评价低温治疗对长期生存的影响。P<0.05为具有统计学意义。结果共纳入210名患者,其中70名接受了低温治疗。低温治疗可以有效地通过膜肺整合的变温器进行。逻辑回归不能证实低温治疗和院内死亡相关(比值比0.85 95%置信区间0.30~2.39,P=0.762)。Cox回归分析提示,校正ECMO前葡萄糖浓度(风险比0.92 95%置信区间0.85~0.99,P=0.040)和ECMO期间高血压(风险比2.59 95%置信区间1.23~5.46,P=0.013)后,低温组患者显示更高的长期生存率(风险比0.40 95%置信区间0.17~0.92,P=0.032)。结论ECMO期间可以方便地进行低温治疗。低温组患者具有较好的长期生存率。在缺乏随机对照研究的情况下,尚无证据支持低温治疗在ECMO患者中的常规应用。
体外膜肺氧合;低温治疗;死亡率
体外膜肺氧合(Extracorporeal membrane oxygen⁃ation,ECMO)每年可为数以千计的顽固性心肺功能衰竭患者提供短期辅助循环和/或呼吸功能支持。尽管ECMO技术和患者管理水平不断提高,患者预后仍不能令人满意,尤其是因心功能衰竭而进行ECMO治疗者[1]。
心脏手术体外循环期间经常应用低温治疗(Therapeutic hypothermia,TH)。一些研究表明,EC⁃MO辅以低温治疗可以降低死亡率、提供心、脑保护,尤其在心脏骤停患者中。在一项动物实验中,常温下诱导室颤15 min后开始ECMO辅助24 h。低温组动物从心肺复苏开始维持肺动脉温度33℃达20 h,并观察到较低的死亡率及较好的心、脑功能[2]。已有明确证据证实低温治疗对于新生儿低氧性缺血性脑病患者,可以提高神经元生存率并改善患者神经系统发育[3]。美国心脏协会建议成人院外心脏骤停且初始心律为室颤者,为治疗神经系统损伤可进行低温治疗[4]。因此,笔者推测低温治疗有可能改善小儿ECMO患者预后。尽管观察到心律失常[5]、凝血功能障碍及感染等并发症[6-7],一些病例报告显示成人和儿童ECMO期间辅以低温治疗是安全可行的[8-11]。但是由于样本量有限,低温治疗相关的并发症及临床预后没有进行比较。
本研究的目的是回顾小儿ECMO患者进行低温治疗的方法;比较低温和常温患者ECMO及低温相关并发症的发生率;研究ECMO期间低温治疗和院内死亡率及长期生存率的关系。
1 资料与方法
经墨尔本皇家儿童医院伦理委员会同意,收集
2005年至2011年该院所有ECMO患者临床资料。
接受多次ECMO的患者仅第一次ECMO纳入分析[12]。ECMO不足24 h者及原始病历资料不能获得者未纳入本研究。
1.1 ECMO系统 主要由管路、膜肺(Quadrox D、Medos Hilite LT或Lilliput 2)及离心泵(Rotaflow)组成。ECMO期间患者管理,包括呼吸机参数设置、血管活性药应用、ECMO流量及抗凝等可参见既往已发表文章[13-14]。近期(<14天)心脏手术及顽固性休克患者一般采用中心插管,年幼儿童多采用颈动静脉插管,年长儿童多采用股动静脉插管。初始肝素剂量为100 U/kg,随后通过控制肝素泵入剂量维持激活凝血时间(ACT)在160~180 s。ECMO流量维持在100~150 ml/(kg·min)。
1.2 分组 患者在接受ECMO后是否进行低温治疗由主管医生决定,所有患者根据是否接受低温治疗分为低温组及常温组。低温组患者ECMO开始后在充分镇静下,利用氧合器内置的变温装置进行低温治疗。食管温度在决定进行低温治疗2 h内达到32~33℃。此温度维持48~72 h,随后患者缓慢复温(每3 h复0.5℃),复温不超过37℃。自发性低温患者通过ECMO复温至常温者、发热患者通过ECMO降温至常温者均纳入常温组。
1.3 资料收集 收集患者一般资料、ECMO前情况、ECMO建立及管理信息、ECMO和低温相关并发症及患者预后。一般资料包括性别、年龄、体重、ECMO指征。指征分为下列4类:心脏骤停、原发性心脏疾病、原发性呼吸疾病及顽固性感染性休克。ECMO前情况包括进行机械通气、需心肺复苏、进行体外循环心脏手术、动脉血气、生化检查及血管活性药物剂量。根据下列公式计算血管活性药物积分:多巴胺[μg/(kg·min)]+多巴酚丁胺[μg/(kg· min)]+去甲肾上腺素[μg/(kg·min)]×100+肾上腺素[μg/(kg·min)]×100+米力农[μg/(kg· min)]×15。ECMO建立及管理信息包括ECMO模式、氧合器类型、建立地点、插管位置、是否进行EC⁃MO系统更换、ECMO支持时间及ECMO期间血液制品应用。低温治疗期间通过食道温度探头每小时记录核心温度1次。记录低温治疗时间(温度<35℃)、平均和最低核心温度。对于常温组患者,记录ECMO开始后72 h内核心体温。如ECMO不足72 h则记录ECMO期间所有核心体温。低温组患者记录下列时间间隔:原发疾病(如心脏骤停)发生到低温治疗开始的时间、低温治疗开始到获得目标温度的时间、充分低温(核心体温在复温前不高于目标体温0.5℃,否则视为不充分低温)和不充分低温的时间、复温至36.5℃所需的时间。患者预后包括是否成功撤除ECMO、机械通气时间、ICU停留时间、ICU死亡率、院内死亡率及长期生存率。
1.4 统计处理 主要研究终点为院内死亡,次要终点为长期生存(ECMO治疗成功撤除后的生存时间)。所有统计分析均利用Stata 12.0(StataCorp LP,Texas,USA)进行。正态分布通过标准化正态概率图进行确认(P-P图)。连续变量表示为平均值±标准误或中位数(25~75百分位数)。连续变量的比较采用t检验或Wilcoxon秩和检验。分类变量以百分比表示,采用卡方或Fisher精确检验进行比较。对常温组及低温组患者一般资料、ECMO前情况、ECMO建立及管理信息及并发症进行比较(单因素分析)。单因素分析提示两组间不一致的变量(P<0.1)包括指征、ECMO前pH、碱剩余(BE)、乳酸、葡萄糖、ECMO模式、插管位置、ECMO建立地点、血小板减少、心脏骤停、癫痫、心室收缩功能降低、高血压(需扩血管药物)和并发症个数。纳入上述变量后采用逻辑回归分析低温治疗对院内生存的影响。因不符合正态分布,红细胞、血浆、血小板输入量进行了对数转换。血管活性药物积分分为低(≤20)、中(>20并≤40)、高(>40)三组。在成功撤除ECMO的患者中,重复上述单因素分析。组间不一致的变量(P<0.1)包括指征、ECMO前乳酸、BE、葡萄糖、高血压(需扩血管药物)和血浆输入量。纳入上述变量后采用Cox回归分析低温治疗对长期生存率的影响。P<0.05为具有显著性差异。
2 结 果
2005年1月1日至2011年12月31日期间,234名患者接受了261次ECMO治疗。27人次为非首次ECMO、20人次ECMO不足24 h、4人次未能获得原始病历资料,本研究共纳入210名患者。其中男性117名(55.7%),中位年龄0.14(0.019~3.83)岁、中位体重4.0(3.2~15.6)kg。87名(41.4%),71名(33.8%),17名(8.1%)和35名(16.7%)患者分别因心脏骤停、顽固性心衰、感染性休克及顽固性呼吸衰竭而接受ECMO。70名(33.3%)患者ECMO期间接受了低温治疗。38名(54.3%)低温组患者和91名(65.0%)常温组患者经治疗后出院。
低温治疗可以有效地通过膜肺整合的变温器进行。低温组患者目标温度为(33.6±0.6)℃。6名(8.6%)患者的目标温度大于34℃。低温组患者最低核心温度为33(32.5~33.7)℃。
8名(11.4%)患者最低核心温度低于32℃。原发疾病到低温治疗开始间隔1.6(1.0~3.3)h,低温治疗开始3(1~6)h后达到目标温度。患者接受48 (38~68)h的充分低温。7名(10%)患者核心温度始终高于34℃。14名(20%)患者经历了5(2~10)h的不充分低温。复温至36.5℃需要23(16~32)h,相当于每小时复温0.11(0.07~0.16)℃。低温组患者核心体温低于35℃的时间为61(40~75)h。常温组最低核心温度为35.6(33.6~36.2)℃。7名(5%)患者发生一过性自发性低温,均在ECMO建立后复温至35℃以上。研究期间低温组患者核心体温明显低于常温组(33.8℃ vs 35.6℃,P<0.001)。
常温组和低温组患者一般资料、ECMO前情况、ECMO建立及管理信息、ECMO和低温相关并发症比较见表1~4。两组患者预后比较见表5。单因素分析表明:指征、ECMO前pH、BE、乳酸、葡萄糖、ECMO模式、插管位置、ECMO建立地点、血小板减少、心脏骤停、癫痫、心室收缩功能降低、高血压(需扩血管药物)和并发症个数在两组间不一致(P<0.1)。纳入上述变量后逻辑回归分析提示,校正血管活性药物积分(中度积分比值比2.91 95%置信区间1.09~7.81,P=0.034)、血小板输入量(比值比1.96 95%置信区间1.05~3.64,P=0.034)和并发症个数(比值比1.47 95%置信区间1.15~1.88,P=0.002)后,不能证实低温治疗和院内死亡相关(比值比 0.85 95%置信区间0.30~2.39,P=0.762)。排除所有未能成功撤除ECMO治疗的患者,重复上述单因素分析(数据未显示)提示指征、ECMO前乳酸、BE、葡萄糖、高血压(需扩血管药物)和血浆输入量在两组间不一致(表6)。纳入上述变量后Cox回归分析提示,校正ECMO前葡萄糖浓度(风险比 0.92 95%置信区间0.85~0.99,P=0.040)和ECMO期间高血压(风险比 2.59 95% 置信区间 1.23~5.46,P=0.013)后,低温组患者显示更高的长期生存率(风险比0.40 95%置信区间0.17~0.92,P=0.032)。
3 讨 论
通过本研究笔者发现ECMO期间低温治疗可以通过氧合器整合的变温装置实现。尽管低温组患者有并发症增加的趋势,校正ECMO前病情及EC⁃MO并发症后,低温治疗与院内死亡无明显关联。低温组患者具有较高的长期生存率。
低温治疗在临床体外循环中十分常见,动物实验和临床研究都证实低温治疗可以通过多种途径提供心、脑保护[15-17],包括减少氧耗、降低代谢率、减少神经元胞体肿胀及减少神经递质释放[18-20]。美国心脏协会建议对院外心脏骤停后昏迷患者,如果初始心律为室颤,可以采用32~34℃低温治疗12~24 h。初始心律非室颤者也可考虑低温治疗[21]。Zobel的研究表明,心脏骤停后出现心源性休克者使用低温治疗,与历史对照比较,可以改善心肌收缩功能、减少儿茶酚胺使用量并提高生存率[16]。小儿ECMO患者在ECMO建立前往往经历心脏骤停或其他状况导致的循环、呼吸衰竭。因此有理由认为,低温治疗可能改善小儿ECMO患者的预后。
目前,报道小儿ECMO辅以低温治疗的研究较少[8-9,22]。Massaro的病例报告证实了利用ECMO进行低温治疗的可行性(33.5℃维持72 h)[22]。ECMO进行低温治疗可以减少核心体温的波动。Horan等将5名新生儿降温至34℃并维持48 h,未观察到明显不良事件[8]。但是由于样本量有限,低温治疗相关并发症及临床预后没有进行比较。此外,纳入的患者多由于呼吸衰竭或低氧性缺血性脑病而接受ECMO治疗,这些患者已不是目前ECMO的主要治疗对象[1]。因此,笔者认为有必要以临床常见EC⁃MO患者为研究对象,进行大样本对比分析,以明确ECMO辅以低温治疗的安全性和有效性。
表1 低温及常温组患者一般资料比较(±s)
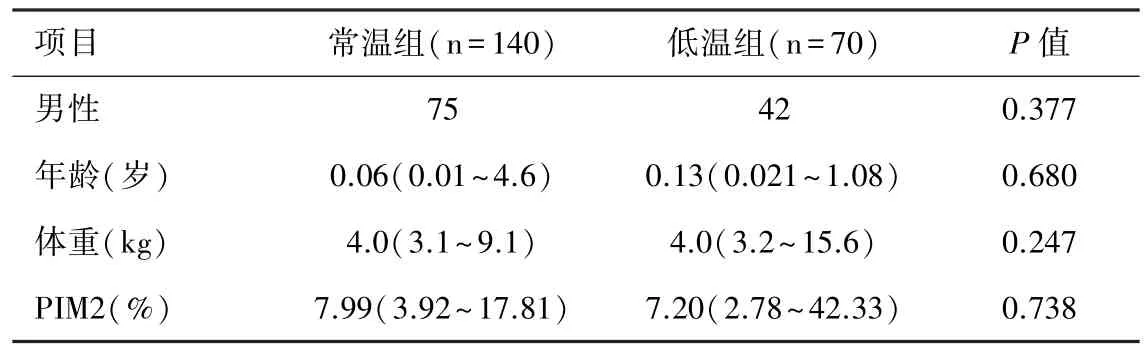
表1 低温及常温组患者一般资料比较(±s)
注:PIM2=儿童死亡率指数2
项目 常温组(n=140) 低温组(n=70) P值男性 75 42 0.377年龄(岁) 0.06(0.01~4.6) 0.13(0.021~1.08) 0.680体重(kg) 4.0(3.1~9.1) 4.0(3.2~15.6) 0.247 PIM2(%) 7.99(3.92~17.81) 7.20(2.78~42.33) 0.738
表2 低温及常温组患者ECMO前情况比较(±s)

表2 低温及常温组患者ECMO前情况比较(±s)
项目 常温组(n=140) 低温组(n=70) P值指征 <0.001呼吸衰竭(例) 34 1感染性休克(例) 17 0循环衰竭(例) 62 9心肺复苏(例) 27 60 ECMO前机械通气时间(h) 134 63 0.105 ECMO前体外循环时间(min) 60 37 0.171 pH 7.28±0.01 7.10±0.03 <0.001 BE(mmol/L) -6.0±0.7 -14.9±1.1 <0.001乳酸(mmol/L) 5.8±0.4 9.9±0.7 <0.001葡萄糖(mmol/L) 8.9±0.4 10.3±0.6 0.033肌酐(mmol/L) 0.053(0.04~0.08) 0.06(0.04~0.08) 0.379尿素氮(mmol/L) 5.1(3.2~7.5) 5.5(3.6~8.1) 0.335血管活性药物积分 0.094低(≤20) 72 47中(>20并≤40) 25 9高(>40) 43 14
表3 低温及常温组患者ECMO建立及管理比较(±s)

表3 低温及常温组患者ECMO建立及管理比较(±s)
项目 常温组(n=140) 低温组(n=70) P值氧合器0.590 Quadrox D(个) 109 51 Medos(个) 22 15 Lilliput(个) 9 4 ECMO模式0.005 VA(例) 117 69 VV(例) 14 0 VA+VV(例) 9 1插管位置0.007中心(例) 86 58外周(例) 48 11中心+外周(例) 6 1建立地点<0.001监护室(例) 67 51手术室(例) 46 18外院转入(例) 27 1 ECMO运行时间(h) 112(68.5~204) 110.5(69~171) 0.549系统更换(次) 22 8 0.403红细胞[ml/(kg·h)] 0.90(0.43~1.36) 0.98(0.55~1.54) 0.077血小板[ml/(kg·h)] 0.50(0.22~0.78) 0.64(0.43~0.96) 0.012血浆[ml/(kg·h)] 0.48(0.24~0.87) 0.64(0.49~1.05) 0.002
表4 低温及常温组患者ECMO并发症比较(±s)

表4 低温及常温组患者ECMO并发症比较(±s)
注:#需外科手术或介入处理;§游离血红蛋白>0.1g/L;∗血小板<100×109/L;∗∗需使用血管扩张剂;△经胸超生提示收缩功能重度降低;▲培养证实GI-Gastro-intestinal
项目 常温组(n=140) 低温组(n=70) P值消化道出血#(例) 3 2 0.749术野出血#(例) 21 12 0.688插管位置出血#(例) 47 26 0.608溶血§(例) 90 44 0.839血小板减少∗(例) 126 69 0.023脑死亡(例) 2 0 0.315癫痫(例) 2 5 0.030脑梗死(例) 10 9 0.174脑出血(例) 8 1 0.148肌酐升高(例) 118 63 0.258肾替代治疗(例) 59 31 0.767超滤(例) 31 12 0.397腹膜透析(例) 30 22 0.113心脏骤停(例) 2 4 0.079心律失常(例) 10 5 1.000使用血管加压素(例) 27 10 0.370高血压∗∗(例) 72 52 0.001使用血管活性药物(例) 101 49 0.746心室收缩功能降低△(例) 26 21 0.061气胸(例) 1 2 0.217肺出血(例) 2 2 0.475感染▲(例) 60 32 0.694并发症个数 5.7±0.2 6.3±0.3 0.059
表5 低温及常温组患者ECMO预后比较(±s)

表5 低温及常温组患者ECMO预后比较(±s)
项目 常温组(n=140) 低温组(n=70) P值成功脱机(例) 117 55 0.375转出监护室(例) 97 40 0.082出院(例) 91 38 0.133机械通气时间(h) 309.5(178.5~597.5) 288(193~483) 0.946监护室停留时间(h) 348(205~642.5) 342(235~591) 0.762
表6 成功撤除ECMO的低温及常温组单因素比较结果(±s)

表6 成功撤除ECMO的低温及常温组单因素比较结果(±s)
注:∗需使用血管扩张剂
项目 常温组(n=117) 低温组(n=55) P值ECMO建立前乳酸(mmol/L) 5.8±0.4 9.3±0.7 <0.001 ECMO建立前BE(mmol/L) -6.1±0.7 -14.7±1.2 <0.001 ECMO建立前葡萄糖(mmol/L) 9.0±0.4 10.3±0.7 0.052高血压∗(例) 61 40 0.011输入血浆[ml/(kg·h)] 0.46(0.25~0.87) 0.63(0.49~1.02) 0.004
接受ECMO的患者,通过膜肺内置的变温器可以方便地进行低温治疗,具有降温迅速、温度易于维持稳定、可缓慢复温等优势。但同时不应忽略的是低温治疗的相关并发症。本研究发现低温组患者有并发症增多的趋势。低温组患者在ECMO期间发生血小板减少、癫痫、需血管扩张药治疗的高血压等并发症的比率较高,同时血浆及血小板的输入量也较多。低温和癫痫的关系目前尚存争议。Atkins的研究显示脑部外伤后低温治疗可以降低癫痫的易感性[23]。而另一项前瞻性观察性研究发现成人院外心脏骤停患者接受低温治疗后,24%发生癫痫[24]。本研究中低温及常温组分别有7.1%及1.4%的患者发生癫痫。85.7%的低温组患者在ECMO前发生心脏骤停,此数字在常温组仅为19.3%。ECMO前的缺血性脑损害可能与低温组患者较高的癫痫发生率有关。低温治疗可导致外周血管收缩、外周循环阻力增加,因此,较多的低温组患者发生需血管扩张药物治疗的高血压。复温后由于血管扩张,可出现外周阻力降低及低血压,通常可通过容量扩充及增加ECMO流量达到缓解,而不需要增加血管活性药物用量。ECMO本身可以通过激活凝血系统、导致血小板减少及功能障碍而造成凝血功能异常[25-26]。低温可以加重上述过程。健康受试者中,低温可导致凝血时间延长,尤其是合并酸中毒的条件下[6]。而代谢性酸中毒在ECMO患者中相当普遍。低温也可以造成血小板激活和血小板减少[27]。由于ECMO和低温对凝血作用的双重影响,不难理解低温组患者需要输入更多的血小板及血浆以维持相对正常的凝血功能。
与成人院外心脏骤停患者的研究结果不同,本研究未能证实低温治疗与院内死亡相关。可能的原因如下:首先,在研究期间低温治疗并非常规进行,而是由主管医生决定,往往接受低温治疗者病情更重。在ECMO建立前,更多的低温组患者发生了心脏骤停、pH更低、乳酸更高。ECMO前血乳酸水平已被证实与院内死亡相关[28]。其次,低温治疗的进行并未严格遵照推荐的流程。理想情况下低温应达到核心温度32~33℃并维持24~72 h。实际上7名患者核心温度始终高于34℃。仅50%患者维持目标温度达到48 h。14名患者在低温过程中出现降温不足的现象。第三,低温组患者出现较多并发症,使用较多的血液制品,这些都与不良预后相关[24,29-30]。需注意的是Cox回归发现低温组患者具有较高的长期生存率。笔者推测一旦患者存活至出院,低温治疗相关的心、脑保护作用将可能产生较好的长期预后。
本研究的局限性需加以注意。首先,观察性研究不能证实因果关系;其次,约20%的常温组患者为外院转入患者。这些患者撤除ECMO后再次转回原就诊医院,长期随访信息缺失。这些患者被认为存活至出院,出院日期即为末次随访日期。因此,院内生存率可能被高估,而长期生存率可能被低估;最后,低温治疗的实施并未遵行统一标准,如果所有患者均能接受32~34℃的低温治疗至少48 h,有可能观察到更明显的疗效。
4 结 论
ECMO期间可以方便地进行低温治疗。低温组患者具有较好的长期生存率。在缺乏随机对照研究的情况下,尚无证据支持低温治疗在ECMO患者中的常规应用。
[1] Haines NM,Rycus PT,Zwischenberger JB,et al.Extracorpore⁃al Life Support Registry Report 2008:neonatal and pediatric car⁃diac cases[J].ASAIO J,2009,55(1):111-116.
[2] Ao H,Tanimoto H,Yoshitake A,et al.Long-term mild hypo⁃thermia with extracorporeal lung and heart assist improves surviv⁃al from prolonged cardiac arrest in dogs[J].Resuscitation,2001,48(2):163-174.
[3] Tagin MA,Woolcott CG,Vincer MJ,et al.Hypothermia for Neonatal Hypoxic Ischemic Encephalopathy:An Updated Sys⁃tematic Review and Meta-analysis[J].Arch Pediatr Adolesc Med,2012,166(6):558-566.
[4] ECC Committee,Subcommittees and Task Forces of the Ameri⁃can Heart Association.2005 American Heart Association Guide⁃lines for Cardiopulmonary Resuscitation and Emergency Cardio⁃vascular Care[J].Circulation,2005,112(24 Suppl):IV1-203.
[5] Wu ET,Huang SC,Chi NH,et al.Idioventricular rhythm in⁃duced by therapeutic hypothermia[J].Resuscitation,2008,76 (3):471-473.
[6] Dirkmann D,Hanke AA,Gorlinger K,et al.Hypothermia and acidosis synergistically impair coagulation in human whole blood [J].Anesth Analg,2008,106(6):1627-1632.
[7] Flores-Maldonado A,Medina-Escobedo CE,Rios-Rodriguez HM,et al.Mild perioperative hypothermia and the risk of wound infection[J].Arch Med Res,2001,32(3):227-231.
[8] Horan M,Ichiba S,Firmin RK,et al.A pilot investigation of mild hypothermia in neonates receiving extracorporeal membrane oxygenation(ECMO)[J].The Journal of pediatrics,2004,144 (3):301-308.
[9] Ichiba S,Killer HM,Firmin RK,et al.Pilot investigation of hypothermia in neonates receiving extracorporeal membrane oxy⁃genation[J].Arch Dis Child Fetal Neonatal Ed,2003,88(2):F128-133.
[10] Guenther U,Varelmann D,Putensen C,et al.Extended thera⁃peutic hypothermia for several days during extracorporeal mem⁃brane-oxygenation after drowning and cardiac arrest Two cases of survival with no neurological sequelae[J].Resuscitation,2009,80(3):379-381.
[11] Mizobuchi M,Nakamura S,Muranishi H,et al.Hypothermia with extracorporeal membrane oxygenation for sudden cardiac death and submersion[J].Am J Emerg Med,2010,28(1):115 e1-4.
[12] Bohuta L,d'Udekem Y,Best D,et al.Outcomes of secondrun extracorporeal life support in children:a single-institution experience[J].Ann Thorac Surg,2011,92(3):993-996.
[13] Horton S,d'Udekem Y,Shann F,et al.Extracorporeal mem⁃brane oxygenation via sternotomy for circulatory shock[J].J Thorac Cardiovasc Surg,2010,139(2):e12-13.
[14] Maclaren G,Butt W,Best D,et al.Extracorporeal membrane oxygenation for refractory septic shock in children:one institu⁃tion's experience[J].Pediatr Crit Care Med,2007,8(5):447-451.
[15] Hypothermia After Cardiac Arrest Study Group.Mild therapeu⁃tic hypothermia to improve the neurologic outcome after cardiac arrest[J].N Engl J Med,2002,346(8):549-556.
[16] Zobel C,Adler C,Kranz A,et al.Mild therapeutic hypother⁃mia in cardiogenic shock syndrome[J].Crit Care Med,2012,40(6):1715-1723.
[17] Che D,Li L,Kopil CM,et al.Impact of therapeutic hypo⁃thermia onset and duration on survival,neurologic function,and neurodegeneration after cardiac arrest[J].Crit Care Med,2011,39(6):1423-1430.
[18] Hutchison JS,Doherty DR,Orlowski JP,et al.Hypothermia therapy for cardiac arrest in pediatric patients[J].Pediatr Clin North Am,2008,55(3):529-544.
[19] Walker PA,Harting MT,Baumgartner JE,et al.Modern ap⁃proaches to pediatric brain injury therapy[J].J Trauma,2009,67(2 Suppl):S120-127.
[20] Zwischenberger JB,Kirsh MM,Dechert RE,et al.Suppres⁃sion of shivering decreases oxygen consumption and improves hemodynamic stability during postoperative rewarming[J].Ann Thorac Surg,1987,43(4):428-431.
[21] Peberdy MA,Callaway CW,Neumar RW,et al.Part 9:postcardiac arrest care:2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care[J].Circulation,2010,122(18 Suppl 3):S768-786.
[22] Massaro A,Rais-Bahrami K,Chang T,et al.Therapeutic hy⁃
pothermia for neonatal encephalopathy and extracorporeal mem⁃brane oxygenation[J].J Pediatr,2010,157(3):499-501.[23] Atkins CM,Truettner JS,Lotocki G,et al.Post-traumatic
seizure susceptibility is attenuated by hypothermia therapy[J].Eur J Neurosci,2010,32(11):1912-1920.
[24] Nielsen N,Sunde K,Hovdenes J,et al.Adverse events and their relation to mortality in out-of-hospital cardiac arrest pa⁃tients treated with therapeutic hypothermia[J].Crit Care Med,2011,39(1):57-64.
[25] Kestin AS,Valeri CR,Khuri SF,et al.The platelet function defect of cardiopulmonary bypass[J].Blood,1993,82(1):107-117.
[26] Plotz FB,van Oeveren W,Bartlett RH,et al.Blood activa⁃tion during neonatal extracorporeal life support[J].J Thorac Cardiovasc Surg,1993,105(5):823-832.
[27] Straub A,Krajewski S,Hohmann JD,et al.Evidence of platelet activation at medically used hypothermia and mecha⁃nistic data indicating ADP as a key mediator and therapeutic target[J].Arterioscler Thromb Vasc Biol,2011,31(7):1607-1616.
[28] Li J,Long C,Lou S,et al.Venoarterial extracorporeal mem⁃brane oxygenation in adult patients:predictors of mortality [J].Perfusion,2009,24(4):225-230.
[29] Benson AB,Burton JR,Jr.,Austin GL,et al.Differential effects of plasma and red blood cell transfusions on acute lung injury and infection risk following liver transplantation[J.Liv⁃er Transpl,2011,17(2):149-158.
[30] Pereboom IT,de Boer MT,Haagsma EB,et al.Platelet trans⁃fusion during liver transplantation is associated with increased postoperative mortality due to acute lung injury[J].Anesthe⁃sia and analgesia,2009,108(4):1083-1091.
Effects of therapeutic hypothermia on clinical outcome in pediatric patients re⁃ceiving extracorporeal membrane oxygenation support
Lou Song,Warwick Butt
Department of Cardiopulmonary bypass;Cardiovascular Institute and Fu Wai Hospital,CAMS and PUMC,Beijing 100037,China;Intensive care unit;Royal Children's Hospital,Melbourne 3052,Australia
Warwick Butt,Email:Warwick.Butt@rch.org.au
ObjectiveTo describe the method of delivering therapeutic hypothermia among pediatric patients receiving extra⁃corporeal membrane oxygenation(ECMO);to compare the occurence of ECMO and hypothermia-related complications between hypo⁃thermia and normothermia patients;and to evaluate the effects of therapeutic hypothermia on in-hospital mortality and long term surviv⁃al.MethodsWe retrospectively reviewed the medical records of patients who received ECMO between January 2005 and December 2011.Patients receiving therapeutic hypothermia were allocated to hypothermia group,other patients into normothermia group.The process of therapeutic hypothermia was described based on core temperature detected by esophageal probe.Demographic data,pre-EC⁃MO status,ECMO support information and complications were collected and compared between groups with univariate analysis.Factor not comparable(P<0.1)were entered into logistic regression to evaluate the effects of therapeutic hypothermia on in-hospital mortali⁃ty.After excluding patients unable to be weaned off ECMO,the above univariate analysis was repeated and Cox regression was per⁃formed to evaluate the effects of therapeutic hypothermia on long-term survival.A P value≤ 0.05 was accepted as significant.Results210 patients were included and 70 received therapeutic hypothermia which could easily be induced and maintained by ECMO incorporated heat-exchanger.Logistic regression indicated that after controlling for pre-ECMO inotrope score,platelet consumption during ECMO and ECMO-related complication number,therapeutic hypothermia was not related to in-hospital mortality(OR 0.85 95%CI 0.30-2.39,P=0.762).Cox regression indicated that therapeutic hypothermia results in a lower hazard(hazard ratio 0.40 95%CI 0.17-0.92,P=0.032)and therefore a longer survival time after controlling for pre-ECMO glucose(hazard ratio 0.92 95%CI 0.85-0.99,P=0.040)and hypertension requiring vasodilator(hazard ratio 2.59 95%CI 1.23-5.46,P=0.013).ConclusionTher⁃apeutic hypothermia can be delivered by ECMO conveniently,and is associated with a better long-term survival.Routine therapeutic hypothermia should not be recommended until further randomized controlled trial has confirmed its safety and efficacy.
Extracorporeal membrane oxygenation;Therapeutic hypothermia;Mortality
2013⁃03⁃18)
2013⁃04⁃10)
10.13498/j.cnki.chin.j.ecc.2014.01.18
100037北京,阜外心血管病医院体外循环科(楼 松);3052墨尔本,皇家儿童医院小儿重症监护室(Warwick Butt)
Warwick Butt,Email:Warwick.Butt@rch.org.au
