改良下半身停循环联合选择性脑灌注兔模型的建立
2014-03-13吴树彬邹丽华刘晋萍吉冰洋吴爱丽戚家峰
吴树彬,邹丽华,刘晋萍,吉冰洋,唐 跃,吴爱丽,戚家峰,龙 村
·基础研究·
改良下半身停循环联合选择性脑灌注兔模型的建立
吴树彬,邹丽华,刘晋萍,吉冰洋,唐 跃,吴爱丽,戚家峰,龙 村
目的探讨建立心脏停跳的改良下半身停循环联合选择性脑灌注兔模型的可行性。方法随机选取26只新西兰兔,平均体重3.0 kg,15~20周龄。13只用于建立模型,另13只作为供血兔。经右锁骨下动脉和右心房插管建立体外循环(CPB),左锁骨下动脉置管于主动脉根部,在CPB降温至28℃时灌注St.Thomas液。降至肛温20℃时停循环,行选择性脑灌注60 min。围CPB期于4个时点采集血流动力学指标和检测动脉血气,记录数值。结果1只动物死于主动脉破裂,其余12只均顺利完成实验。血流动力学和血气指标总体符合CPB的病理生理过程。结论该改良下半身停循环联合选择性脑灌注兔模型安全、稳定,可用于心、脑等器官保护机制的研究。
低温停循环;选择性脑灌注;脏器保护;动物模型
在大脑血流紊乱时,降低温度可维持大脑的代谢需求。因此,深低温停循环被视为成人主动脉弓部手术中的一门关键技术。随着外科技术不断提高,停循环时间有所缩短,而低温带来的副作用逐渐得到关注,一些有经验的心血管中心也开始尽可能的避免深低温,中低温和浅低温停循环也逐渐应用于临床,但何种停循环温度对于大脑等器官保护较佳仍是研究者关注的焦点。
目前,构建体外循环的动物模型集中在猪、犬和羊等大动物[1-2],但大动物个体间同源性较差,且不经济。小动物如大鼠由于外科操作难度大,选择性脑灌注这一技术至今未能实现。新西兰兔作为中型动物,价格低廉,便于外科操作,并具有和人类大脑相似的Willis环[3],适于低温停循环下的脑保护及其作用机制研究,受到了研究者的青睐。但目前兔的停循环主要依靠深低温心脏室颤而不是灌注心脏停搏液[4-5],限制了不同温度停循环下机体重要脏器保护的研究。本研究拟结合国内外的研究进展,探索采用心脏停搏液控制兔下半身停循环联合选择性脑灌注模型的建立,为研究不同温度停循环下脏器保护提供新的平台。
1 材料与方法
1.1 实验动物 本实验经中国医学科学院阜外心血管病医院动物伦理委员会批准。15~20周龄新西兰兔26只,2.5~3.5 kg,雌雄不限;其中13只建立模型,另外13只作供血用。术前6 h禁食,2 h禁水。1.2 主要实验耗材与仪器 14 F静脉插管(美国Medtronic Inc,型号:66114),中心静脉管(中国深圳益心达医学新技术有限公司,型号:SCW-CVCP-1),膜肺(日本Terumo公司,型号:Terumo Capiox RW05 Baby-RX),16G/18G/20G动脉套管针,7-0 prolene缝线,输液器,尿液引流瓶,3.5#气管插管。呼吸机(巴西INTERMED公司,型号:Class 1-Type B),双头滚压泵(德国Stockert公司),变温水箱(德国Jostra公司,型号:20-600),变温毯等。
1.3 体外循环管道 整体管道由回流室(50 ml注射器),硅胶输液管道,泵管,膜肺,变温水箱,双头滚压泵,14 F静脉插管及引流管组成。预充液组成:60 ml供血兔血液,琥珀酰明胶注射液(沈阳贝朗制药有限公司)10 ml,复方电解质注射液(上海百特医疗用品有限公司)10 ml。肝素钠注射液(天津药业焦作有限公司)100 U、呋塞米注射液(郑州羚锐制药有限公司)3 mg、5%NaHCO3注射液(天津药业焦作有限公司)5 ml加入到预充液中。
1.4 麻醉及外科准备 随机选取实验用新西兰兔,称重。盐酸氯胺酮注射液(福建古田药业有限公司)35 mg/kg和地西泮(安徽省皖北药业股份有限公司)1.5 mg/kg经耳缘静脉诱导麻醉,于仰卧位将兔四肢固定于铺有变温毯的外科操作台。经口气管插管,连接呼吸机,调节呼吸参数:呼吸频率为40~60次/min、潮气量为7~10 ml/kg,吸呼比为1∶2,氧流量0.5~1 L/min。给予0.1 mg/kg维库溴铵(浙江仙琚制药股份有限公司)维持肌松,氯胺酮10 mg/(kg·h)和地西泮1.5 mg/(kg·h)维持术中麻醉。四肢连接心电图导联进行心电监测;置肛温探头进行体温监测;右股动脉置入20 G动脉套管针,监测平均动脉压;膀胱造瘘,荷包缝合18 G动脉套管针引流尿液。全身肝素化(500 U/kg)后,胸部正中切口暴露心脏和升主动脉,沿主动脉游离无名动脉及左、右锁骨下动脉,右锁骨下动脉置入16 G动脉套管针供全身灌注或选择性脑灌注。中心静脉管置入左锁骨下动脉,在动脉鞘管导丝引导下,送至主动脉根部,供灌注心脏停搏液。右心耳处做切口,荷包缝合14 F静脉插管,连接引流管,并暂时夹闭,供引流静脉血,将回流室与动物心脏水平垂直距离维持在35~40 cm。主动脉根部套Ⅰ号阻断带备用,左锁骨下动脉与无名动脉之间套Ⅱ号阻断带备用。值得注意的是,新西兰兔主动脉弓部的动脉血管解剖与人类有较大差异,多数动物的左颈总动脉起源于无名动脉而非主动脉弓部,见图1。
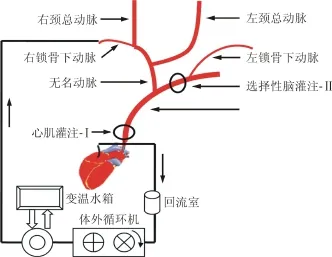
图1 兔仰卧位颈胸部主要血管及体外循环示意图
1.5 体外循环方法 体外循环管道预充排气后,打开静脉引流管,同时开启双头滚压泵,开始体外循环。全流量设为100~120 ml/(kg·min),平均动脉压维持在40~60 mm Hg。于转机10 min后启用变温水箱降温,降至28℃时夹闭Ⅰ号阻断带,降温过程中未出现室颤。开启双头泵另一泵头灌注St.Thomas液20 ml/kg,此后,主动脉阻断每隔30 min时灌注停搏液半量,心脏停跳后在心脏周围以冰屑冷敷。继续降温至20℃时,调整灌注泵速,将流量降至8~10 ml/(kg·min),同时夹闭Ⅱ号阻断带,开始下半身停循环并行选择性脑灌注,将冰袋置于动物皮肤表面维持低温。停循环1 h后,打开Ⅱ号阻断带,恢复全身灌注,打开变温毯和调整变温水箱温度开始复温,肛温与变温水箱温度差低于5℃。复温至32℃时,打开I号阻断带,心脏自动复跳,若出现房、室颤则电复律。继续复温至35℃时停机,并于停机后2 h以安乐死处置动物。整个转机过程采用α稳态血气管理。
1.6 实验数据采集 体外循环各时段所用时间;分别于麻醉后、降温至28℃、开放升主动脉后10 min和停机后10 min四个时间点采集血流动力学指标并检测动脉血气。
1.7 统计分析 应用SPSS 17.0软件进行统计分析,数据用均数±标准差(x¯±s)表示。对四个时点数据采用单因素方差分析,各组数据间应用LSD(最小显著差值法)检验;P<0.05表示差异具有统计学意义。
2 结 果
2.1 手术及体外循环 转机、主动脉夹闭、降温和复温时间分别为(208.25±30.62)min、(130.42±11.56)min、(50.75±11.66)min、(69.00±10.95)min。复温过程中1只动物因主动脉破裂大出血死亡,原因是所置导管过深损伤了主动脉壁,在体外循环灌注压力的不断刺激下导致破裂。其它12只动物均自动复跳,其中2只动物在停机后出现血压下降,微量泵持续泵入多巴胺5 μg/(kg·min)和去甲肾上腺素0.04 μg/(kg·min)可维持血压在50~65 mm Hg,直到动物安乐死。10只动物自动复跳后血压可自行维持在45 mm Hg以上。1只动物在自动复跳后发生心房颤动,电复律后心脏恢复正常节律。
2.2 血流动力学与血气监测 监测数据见表1。平均动脉压(MAP)降温至28℃、开升主10 min和停机后10 min三个时点比麻醉后低(P<0.05),开升主10 min和停机10 min后MAP无明显统计学差异(P>0.05),但较降温至28℃时高(P<0.05)。
心率(HR)降温至28℃、开升主10 min及停机10 min三个时点无明显差异(P>0.05),但降温至28℃和开升主10 min两个时点较麻醉后低(P<0.05),麻醉后与停机后无明显差异(P>0.05)。
氧分压(PaO2)降温至28℃时较其它三个时点高(P<0.05),开升主10 min高于麻醉后和停机后10 min(P<0.05),麻醉后和停机后10min无明显差异(P>0.05)。
动脉氧饱和度(SaO2)四个时点无明显统计学差异(P>0.05)。
pH值与停机后10 min相比,麻醉后、降温至28℃和开升主10 min三个时点较高(P<0.05),降温至28℃和开升主10 min时较麻醉后高(P<0.05),但降温至28℃和开升主10 min两个时点无明显统计学意义。
血红蛋白(Hb)浓度麻醉后较降温至28℃、开升主10 min和停机后10 min三个时点高(P<0.05),且这三个时点无明显差异(P>0.05)。
乳酸(Lac)值四个时点的两两之间均有统计学差异(P<0.05)。
3 讨 论
神经功能障碍是深低温停循环后最常见的并发症之一,选择性脑灌注技术应用于临床后改善了患者神经预后,但同时给临床带来了新的变革,即停循环温度趋向“暖化”。低温作为停循环期间重要的保护措施,可以抑制大脑代谢、减少兴奋性氨基酸释放、削弱氧化应激程度和降低大脑缺血后炎症反应[6]。但同时,它也会打破机体稳态、导致微循环功能障碍和心肌收缩功能障碍[7]。因此,不同温度下停循环的最佳脑灌注流量仍然是一个值得深入研究的课题。深低温、中低温和浅低温停循环中何种管理方式能更好的保护大脑,减轻心肌功能障碍等损伤,是一个值得探讨的问题。
本研究克服了国内外目前深低温停循环兔模型中的关键难题,成功的将心肌灌注和选择性脑灌注技术合为一体,建立了成功率高、贴近临床的动物模型,为研究上述难题提供了便利。
3.1 模型的建立方法
3.1.1 插管及插管位置的选择 研究选择了右锁骨下动脉灌注全身和下半身停循环期间灌注大脑,只需调控一个泵头流量就可以满足两个部位的灌注,节约了外科手术操作过程,降低了手术导致的并发症。选择左锁骨下动脉置中心静脉管于主动脉根部灌注心脏停搏液是本研究的一个创新点:首先,管道足够细,几乎不会影响全身灌注,并可满足心肌灌注;其次,管道足够长、软,为其走行于有弧度的弓部血管提供了便利;再次,管道特配有柔韧有余的导丝,导丝牵引为其顺利置于主动脉根部提供了保障。另外,选择14 F静脉插管荷包缝合于右心房引流静脉血是本研究的关键技术环节。14 F静脉插管(内径4.7 mm)不仅管径足够大,而且管道头端备有专业设计的引流孔,为通畅引流静脉血和建立体外循环打下了良好的基础。
表1 转流过程中各时点血气比较(±s)

表1 转流过程中各时点血气比较(±s)
注:#与麻醉后比较P<0.05;△与降温至28℃比较P<0.05;∗与开升主10 min比较P<0.05。
项目 麻醉后 降温至28℃ 开升主10 min 停机10 min MAP(mm Hg) 80.83±8.01 55.58±9.25#66.92±13.48#△65.92±14.85#△HR(bpm) 236.92±18.61 195.33±36.16#197.13±40.48#213.67±17.52 PaO2(mm Hg) 245.97±45.94 490.96±70.96#411.20±56.83#△251.63±43.43∗△SaO2(%) 99.28±2.01 99.89±0.03 99.88±0.06 99.62±0.32 pH 7.28±0.08 7.40±0.13#7.40±0.16#7.17±0.09∗#△Hb(g/L) 93.67±17.03 69.67±13.23#75.75±14.40#77.75±21.54#Lac(mmol/L) 4.41±0.72 5.17±0.48#7.48±0.64#△5.83±0.44∗#△
3.1.2 膀胱造瘘 这是本次研究的另一关键技术环节。在目前的国内体外循环兔模型中,尚未见膀胱造瘘这一操作的应用。虽然,依靠较高的膀胱充盈压能够使尿液溢出体外,但高膀胱充盈压会影响肾脏滤过作用,导致血液稀释。通过将剪有侧孔的18 G套管针荷包缝合于膀胱,并结合利尿药的使用,实现了体外循环中免用血液滤器,就可将Hb维持在较高的浓度,不仅减少了体外循环耗材的使用,还避免了机体内许多有益成分的丢失。
3.1.3 预充 本研究预充量较小(80 ml),但因需灌注St.Thomas心脏停搏液20 ml/kg,会导致血液进一步稀释,因此,采用了供血兔的血液预充,较好的维持了转流中的Hb浓度。另外,兔血液高凝,注意平衡抗凝。
3.2 实验数据分析 MAP和HR在四个时点的变化比较符合体外循环病理生理过程。PaO2在转流过程中较高,维持了较好的SaO2,侧面反映了膜肺的氧合性能良好。麻醉后和停机后10 min PaO2无统计学意义,暗示了停机后10 min动物呼吸功能状态良好。Hb在转流后由于血液稀释,出现明显下降,但在转流过程中通过添加供血兔的血液和使用利尿剂,使Hb维持在一个相对较高的水平。麻醉后动脉血pH均值为7.28,略偏酸性,转流过程中采取了α稳态血气管理,pH值恢复正常范围内,但可能因为停循环期间血液重新分布、无氧代谢等因素产生的Lac未被代谢完全和机体尚存在未完全纠正的代谢性酸中毒,从而在停机后10 min出现一定程度的pH值降低。
新西兰兔Lac值与人类有较大的差异,其基础值在4~6 mmol/L之间[8]。Lac值在降温至28℃时明显较基础值高,可能是转流开始后血液稀释和血液温差增加了机体的无氧代谢。开放升主后10 min Lac值急剧升高,可能是因为低温停循环会导致血液向骨骼肌的重新分布,导致体内脏器血流降低,增加无氧代谢,Lac产生增加;肝脏是Lac转化的主要器官,低温下酶活性降低导致其清除率降低[9]。此外,复温期间耗氧量增加及微循环功能紊乱,也是Lac进一步升高的重要原因。停机后10 min Lac明显降低,可能与利尿剂的应用及升主开放后机体自身微循环的改善密切相关。尽管新西兰兔的Lac与人类差异较大,但对于1 h深低温停循环,其Lac增长幅度仍在可接受的范围内,其变化趋势与临床比较相符。
3.3 研究局限 本实验中缺少对全身灌注和心肌灌注压力的测量,但是血气分析和血流动力学监测结果表明,全身灌注效果较好。动物在心脏平均停循环130 min后仍可自动复跳,并且停机后多数动物血压可自行维持50 mm Hg以上,暗示在低温和心脏停搏液的作用下,心肌保护效果较好,并没有因为灌注压力高而导致心肌或血管损伤。
总体来说,本研究成功建立了心脏停跳的改良下半身停循环联合选择性脑灌注兔模型。与之前建立的模型相比,该模型更加贴近临床,为研究不同温度停循环下心、脑及其它脏器保护作用及机制提供了新的平台。
[1] Chen Y,Liu J,Ji B,et al.The optimal flow rate for antegrade cerebral perfusion during deep hypothermic circulatory arrest [J].Artif Organs,2012,36(9):774-779.
[2] Leroux AA,Moonen ML,Pierard LA,et al.Animal models of mitral regurgitation induced by mitral valve chordae tendineae rupture[J].J Heart Valve Dis,2012,21(4):416-423.
[3] Safar P.Long-term animal outcome models for cardiopulmonarycerebral resuscitation research[J].Crit Care Med,1985,13 (11):936-940.
[4] 杨九光,龙村,姚忠喜,等.经右锁骨下动脉、右房插管兔体外循环及选择性脑灌注模型的建立 [J].中华实验外科杂志,2000,17(1):77-78.
[5] 唐跃,吴爱丽,慎慧,等.兔深低温停循环体外循环模型的建立[J].实验动物科学,2009,26(6):76-77.
[6] Dave KR,Christian SL,Perez-Pinzon MA,et al.Neuroprotec⁃tion:lessons from hibernators[J].Comp Biochem Physiol B Biochem Mol Biol,2012,162(1-3):1-9.
[7] Howell NJ,Ashrafian H,Drury NE,et al.Glucose-insulin-po⁃tassium reduces the incidence of low cardiac output episodes after aortic valve replacement for aortic stenosis in patients with left ventricular hypertrophy:results from the Hypertrophy,Insulin,Glucose,and Electrolytes(HINGE)trial[J].Circulation,2011,123(2):170-177.
[8] Lin Y,Leach WJ,Ammons WS.Synergistic effect of a recombi⁃nant N-terminal fragment of bactericidal/permeability-increasing protein and cefamandole in treatment of rabbit gram-negative sep⁃sis[J].Antimicrob Agents Chemother,1996,40(1):65-69.
[9] Li J,Schulze-Neick I,Lincoln C,et al.Oxygen consumption after cardiopulmonary bypass surgery in children:determinants and implications[J].J Thorac Cardiov Sur,2000,119(3):525 -533.
Establishment of a modified lower body circulatory arrest and selective cerebral perfusion model in rabbits
Wu Shu-bin,Zou Li-hua,Liu Jin-ping,Ji Bing-Yang,Tang Yue,Wu Ai-li,Qi Jia-feng,Long Cun
Department of Cardiopulmonary Bypass,State Key Laboratory of Cardiovascular Disease and Fuwai Hospital Peking Union Medical College and Chinese Academy of Medical Sciences,Beijing 100037,China
Liu Jin-ping,Email:jinpingfw@hotmail.com
ObjectiveTo explore the feasibility of establishing a modified lower body circulatory arrest and selective cerebral perfusion model in rabbits.MethodsTwenty six rabbits were selected randomly.The mean weight and age of the rabbits were 3.0 kg and 15-20 weeks respectively.Half of them were used to model establishment,and the rest blood donation.Cardiopulmonary bypass was established via right subclavian artery and right artrium cannulation.Catheter was cannulated from left subclavian artery to arotic root for St.Thomas fluid perfusion at 28℃.Rabbits undergone 60 min of the lower body circulatory arrest and selective cerebral perfu⁃sion at a rectal temperature of 20℃.Blood gas and hemodynamic parameters were measured in four time points during cardiopulmonary bypass.ResultsOf the thirteen rabbits,one died of aortic rupture and the others survived during the experiment.Blood gas and hemo⁃dynamic parameters were in accordance with the pathophysiological process of cardiopulmonary bypass generally.ConclusionThe model is safe and stable,and could be used to study the protective mechanism of heart,brain and the other organs under circulatory ar⁃rest and selective cerebral perfusion.
Hypothermia circulatory arrest;Selective cerebral perfusion;Organs protection;Animal model
2013⁃10⁃14)
2014⁃01⁃07)
10.13498/j.cnki.chin.j.ecc.2014.01.13
国家自然科学基金(81100178)
100037北京,北京协和医学院,中国医学科学院,阜外心血管病医院体外循环科[吴树彬(研究生)、邹丽华(研究生)、刘晋萍、吉冰洋、龙 村],动物实验中心(唐跃、吴爱丽);154002佳木斯,佳木斯大学附属第一医院心胸外科(戚家峰)
刘晋萍:Email:jinpingfw@hotmail.com
