杀虫剂胁迫对寒地稻田优势种蜘蛛的影响
2014-03-12金永玲王丽艳
金永玲,王丽艳
(黑龙江八一农垦大学农学院,黑龙江 大庆 161319)
在稻田生态系统中,捕食性蜘蛛是稻田生态系统中节肢动物群落的优势类群,具有适应性强、生态分布广泛、感觉灵敏、捕食量大、生殖力强、繁殖快、寿命长,田间栖居稳定,种群数量最大等优良特性,对农作物不同生长时期的多种害虫具有控制作用,其群落结构与功能特性直接制约稻田害虫的发生程度,影响农业生产[1]。化学农药频繁使用,不但影响生态环境和引起害虫抗药性,还会大量杀伤蜘蛛等优势天敌类群,降低天敌对害虫自然控制能力,使害虫种群数量上升,导致害虫猖獗和次生害虫上升[2-3]。杀虫剂大量施用对稻田优势种蜘蛛酶活性有显著抑制作用,影响田间蜘蛛功能特性及农药抵抗力[4-5]。所以,了解杀虫剂胁迫对蜘蛛生理生化方面影响尤为必要。
多年对寒地稻田节肢动物群落多样性调查研究结果表明,寒地稻田捕食性天敌以拟水狼蛛为主要优势种[6]。本试验在对稻田节肢动物群落多样性调查基础上研究杀虫剂胁迫下稻田优势种蜘蛛拟水狼蛛体内重要的保护酶系、解毒酶系含量变化及杀虫剂对稻田优势种蜘蛛的杀伤力,为科学合理使用化学杀虫剂、保护害虫天敌、保持稻田生态系统平衡提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试虫源
寒地稻田优势种蜘蛛:拟水狼蛛(Pirata subpi⁃raticus)。采自黑龙江八一农垦大学水稻试验田(王家围子等地)。
1.1.2 供试水稻品种
垦建稻5号。
1.1.3 供试药剂
4.5%高效氯氰菊酯乳油(安徽丰乐农化有限责任公司,300~600mL·hm-2);10%吡虫啉可湿性粉剂(苏州华源农用生物化学品有限公司,150~300 g·hm-2);1.5%阿维菌素乳油(黑龙江绥化农垦晨环生物制剂有限责任公司,150~300 mL · hm-2)。
1.2 方法
1.2.1 室内试验
室内网罩试验采用直径为40 cm的塑料盆,盛以稻田土壤,灌水,每盆栽种水稻植株3株。试验在水稻分蘖期进行,以直径为100 cm的尼笼纱网养蛛笼罩住,周围用泥土封闭严实以免蜘蛛流失,每个网罩内投放蜘蛛50头。试验设三种杀虫剂及清水对照4个处理,每个处理重复3次。把事先配制好的杀虫剂用小喷壶均匀喷施,分别于施药后1、4、9、15 d进行调查,统计蜘蛛死亡率。
1.2.2 田间试验
试验采用随机区组,三种杀虫剂及清水对照,3次重复,共设12个小区。每个小区面积为20 m2,区间设有塑料布隔离保护行,防止蜘蛛逃逸。用工农16型背负式喷雾器常规喷雾。施药前调查蜘蛛基数。施药后分别于1、4、9、15 d调查蜘蛛存活数量。调查时采用平行跳跃法取样,每小区5点,每点查20穴,统计每百穴蜘蛛减退数[5]。
室内网罩试验与大田试验采用杀虫剂相同,各种处理比例相同(各农药施用剂量见1.1.3)。
1.3 生理指标测定方法
1.3.1 虫源处理
清水喂养:田间采回成年蜘蛛后,用清水喂养10~25 d,排除其消化道内尚未消化的异体酶类后,放入-70℃超低温冰箱中备用。
农药喂养(吡虫啉、阿维菌素):试验蜘蛛为成年蜘蛛,样本采回后,用清水喂养2周,再用农药亚致死中浓度喂养,分别在喂养后第1、4、9、15天选取存活蜘蛛各5只,放入-70℃超低温冰箱中备用。
高效氯氰菊酯处理方法:用滤纸在配好的农药中浸泡1 min,拿出放入装有蜘蛛的生测瓶中,待其爬行,分别在第1、4、9、15天选取存活蜘蛛各5只,放入-70℃超低温冰箱中备用。
试验选高效氯氰菊酯、吡虫啉、阿维菌素三种杀虫剂的亚致死中浓度,分别为3.9253、41.0037、6.9166 mg·L-1。
1.3.2 保护酶测定[7]
1.3.2.1 超氧化物歧化酶(SOD)活性测定
将经过1.3.1处理的蜘蛛用预冷的磷酸缓冲液充分匀浆,于4℃,4000 g离心15 min,取上清液做酶原。取一试管加入2.8 mL SOD反应液(50 mmol·L-1pH 7.0磷酸缓冲液、13 mmol·L-1蛋氨酸、75 μmol· L-1NBT,0.1 mmol·L-1EDTA),再加入酶原0.1 mL,200 mmol·L-1VB2溶液0.1 mL。在25℃生化培养箱内2支40 W日光灯下光照反应15 min后,然后用黑暗终止反应,立即在分光光度计560 nm处比色,并测定酶液蛋白质含量(参照Bradford考马斯亮蓝G-250法),3次重复。酶活性以U·mg-1表示。
1.3.2.2 过氧化物酶(POD)活性测定
将经1.3.1处理的蜘蛛分别放入研钵中,加入少量石英砂,按每1g幼虫加入10mL缓冲液的剂量加入预冷pH7.0、浓度为0.1mol·L-1PBS液,在冰浴条件下研磨,所得匀浆于12000g离心15min,其上清液为待测的酶液。取一试管加入2.9mLPOD反应液(其中有pH 6.0100 mmol·L-1磷酸缓冲液1 mL,30 mmol·L-1愈创木酚0.95mL和26mmol·L-1H2O22mL),再加入酶液0.l mL,30℃水浴反应15 min后,立即在470 nm处比色,并测定酶液蛋白质含量。以不加酶液为对照,3次重复。
1.3.3 解毒酶测定
1.3.3.1 羧酸酯酶(CarE)活性测定
参照Byme等方法[8]、高希武方法略作修改[9]。在96孔酶标板上设置好参比和样品区域,先向参比孔穴内加入25 μL 0.02 mol·L-1pH 7.0 PBS缓冲液,再同时向参比和样品孔穴内各加入25 μL 1×10-4mol·L-1毒扁豆碱溶液,然后向样品孔穴内加入25 μL酶液,最后同时向参比和样品孔穴内各加入200 μL[a-NA+固蓝RR]混合液。用Synergy HT多功能酶标仪在450 nm下每隔50 s读一次光密度值,读11次,然后将时间与光密度值作图,求出线性部分的斜率,即以反应的初速度值做为酶的活性。每处理各3次重复。
1.3.3.2 谷胱甘肽转移酶(GSTs)活性测定
参照Habig等方法略作修改[10]。在96孔酶标板上设置好参比和样品区域,先同时向样品和参比孔穴内加入3 μL GSH溶液,再向参比和样品孔穴内分别加入 250 μL 和 230 μL 0.1 mol· L-1pH 7.5 PBS缓冲液,然后同时向参比和样品孔穴内加入10 μL CDNB溶液,最后向向样品孔穴内加入25 μL酶液。用Synergy HT多功能酶标仪在340 nm下每隔50 s读一次光密度值,读11次,然后将时间与光密度值作图,求出线性部分的斜率,即以反应的初速度值做为酶的活性。每处理各3次重复。
1.4 数据处理与统计分析
试验测得数据采用SPSS 11.5进行方差分析。计算见公式1~3。

2 结果与分析
2.1 施药处理后室内网罩蜘蛛的死亡率
由表1可知,三种杀虫剂的施用对稻田优势种蜘蛛均有较大影响。在施药后1~15 d蜘蛛死亡率均显著高于对照处理。在施药后第1天,三种杀虫剂处理后蜘蛛的校正死亡率分别为30.56%、41.67%和64.44%,经高效氯氰菊酯处理的蜘蛛校正死亡率最高为64.44%。三种处理间,吡虫啉和阿维菌素处理的蜘蛛死亡率间差异不显著,但两者与高效氯氰菊酯处理的蜘蛛死亡率相比差异显著;施药后第4天,蜘蛛校正死亡率分别为39.05%、43.49%和50.92%,经高效氯氰菊酯处理的蜘蛛校正死亡率最高为50.92%;施药后第9天,蜘蛛校正死亡率分别为49.40%、41.90%和50.0%;施药后第15天,蜘蛛校正死亡率分别为50.67%、45.24%和54.17%,可以看出施药第4~15天,三种药剂处理间死亡率差异不显著。同时,随着施药时间延长,经高效氯氰菊酯处理的蜘蛛校正死亡率在第4、9、15天均比第1天低,经吡虫啉和阿维菌素处理的蜘蛛校正死亡率在第4、9、15天均比第1天高。

表1 施药后室内网罩蜘蛛的死亡率Table 1 ndoor net cover spiders mortality after pesticide treatment
2.2 施药处理后大田蜘蛛的退减率
表2结果表明,三种杀虫剂处理蜘蛛退减率在施药后第1~15天均高于对照处理,差异显著。随着施药时间延长,三种杀虫剂处理稻田优势种蜘蛛数量均比施药前大量减少,三种处理蜘蛛校正死亡率在施药后第4~15天均比第1天低。在施药后1~15 d呈现出下降-升高-下降趋势,并且第15天下降显著。
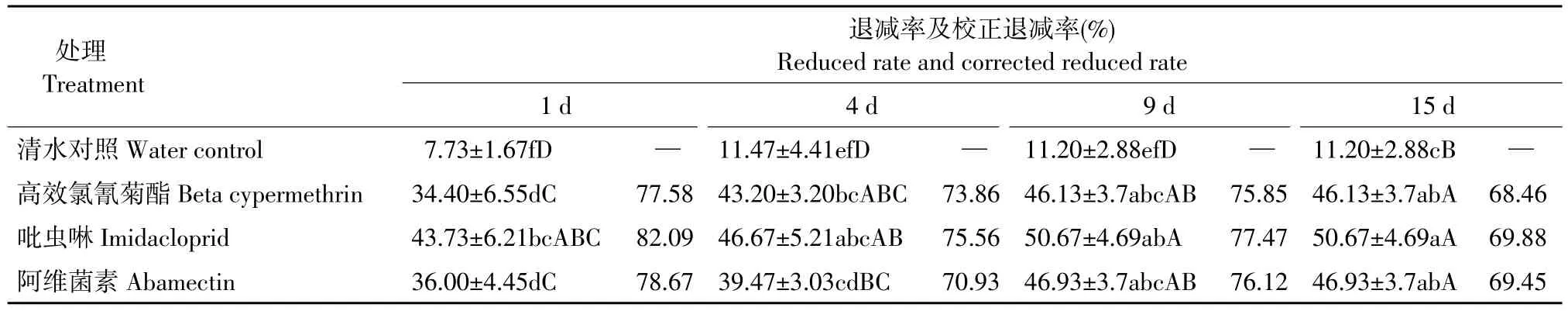
表2 施药后大田蜘蛛的退减率Table 2 Field spiders reduced rate after pesticide treatment
2.3 三种杀虫剂胁迫下寒地稻田优势种蜘蛛体内保护酶的含量
表3结果表明,三种杀虫剂处理后,在施药后1~15 d内,蜘蛛体内SOD酶含量均低于对照处理,且差异显著。施药后第1天,阿维菌素处理酶含量最低,三种处理间差异显著;第4、9天,经吡虫啉和阿维菌素处理的蜘蛛体内SOD酶含量显著低于高效氯氰菊酯处理SOD酶含量;施药后第15天,经阿维菌素处理的蜘蛛体内SOD酶含量显著低于高效氯氰菊酯和吡虫啉处理。

表3 杀虫剂胁迫下蜘蛛体内保护酶的变化Table 3 Changes of protective enzymes in spider under insecticide stress
随着施药天数的不断增加,三种处理的蜘蛛体内SOD酶含量在施药后第1~15天均呈现先下降再升高的趋势;三种处理在第4天蜘蛛体内SOD酶含量均显著低于第1天;第9天经高效氯氰菊酯和吡虫啉处理的蜘蛛体内SOD酶含量在第9天均显著低于第1天,经阿维菌素处理的蜘蛛体内SOD酶含量明显高于第1天;第15天,三种处理蜘蛛体内SOD酶含量均显著高于第1天。
三种杀虫剂处理后,第1、4、9天蜘蛛体内POD酶含量均低于对照处理。施药后第1天经阿维菌素处理的蜘蛛体内POD酶含量与对照相比差异显著,三种处理间差异显著;施药后第4天经吡虫啉、阿维菌素处理的蜘蛛体内POD酶含量显著低于对照;第9天经三种药剂处理的蜘蛛体内POD酶含量显著低于对照,三种处理间差异显著;施药后第15天经高效氯氰菊酯和阿维菌素处理的蜘蛛体内POD酶含量均低于对照处理,差异显著,经吡虫啉处理的蜘蛛体内POD酶含量显著高于对照处理,三种处理间差异显著。
随着施药天数的不断增加,三种杀虫剂处理的蜘蛛体内POD酶含量在施药后第1~15天内呈现较大波动。经高效氯氰菊酯处理的蜘蛛体内POD酶含量在施药后第1~15天呈现先升高再降低趋势,第4、9、15天均高于第1天,差异显著;经吡虫啉处理的蜘蛛体内POD酶含量第9、15天均高于第1天,差异显著,第4天低于第1天,差异显著;经阿维菌素处理的蜘蛛体内POD酶含量在施药后第1~15天呈现先升高再降低然后再复升高趋势,第4、15天高于第1天,差异显著,第9天低于第1天,差异显著。
2.4 三种杀虫剂胁迫下寒地稻田优势种蜘蛛体内解毒酶的变化
表4结果表明,三种杀虫剂处理后,在第1~15天,蜘蛛体内羧酸酯酶CarE含量均低于对照处理。施药后第1天,三种处理的蜘蛛体内CarE酶含量均显著低于对照,三种处理间差异不显著;施药后第4天,经阿维菌素和吡虫啉处理的蜘蛛体内CarE酶含量与对照相比差异均极显著,且显著低于高效氯氰菊酯处理的蜘蛛体内CarE酶含量;第9天,三种处理的蜘蛛体内CarE酶含量显著低于对照,三种处理间差异不显著;施药后第15天,经吡虫啉处理的蜘蛛体内CarE酶含量与对照相比,降低最多,但差异不显著。

表4 杀虫剂胁迫下蜘蛛体内解毒酶的变化Table 4 Changes of detoxifying enzymes in spider under insecticide stress
三种杀虫剂处理后,随施药时间延长,第1~5天内,蜘蛛体内CarE酶含量整体上均呈现先下降再升高然后再复下降的过程。在第4、9、15天蜘蛛体内CarE酶含量均低于第1天,差异显著。
三种杀虫剂处理后,在施药后第1~15天,蜘蛛体内GST酶含量均低于对照处理。第1天,三种处理与对照GST酶含量降低,差异不显著;施药后第4天,三种处理蜘蛛GST酶含量与对照相比显著升高;第9、15天三种处理与对照相比酶含量降低,但差异均不显著。随着施药时间延长,三种杀虫剂处理的蜘蛛体内GST酶含量在第1~15天呈现逐渐升高的趋势,第4、9、15天均高于第1天,但差异不显著。
3 讨论与结论
化学农药长期使用,在杀死害虫同时也杀伤其天敌,使田间天敌数量大量减少,破坏作物田生态环境平衡稳定,降低天敌对害虫控制作用。本研究结果表明,三种杀虫剂对稻田优势种蜘蛛拟水狼蛛的杀伤力均较高,大田试验结果与胡子强等研究结果一致[11]。王智等研究表明杀虫剂在较低剂量条件下,促进蜘蛛对害虫控制能力[12]。
昆虫体内含有的活性氧在受到逆境胁迫后含量增加,对许多生物功能分子有很强破坏作用。但是生物体内存在的保护酶系能抑制活性氧形成,其中SOD和POD是生物体内重要保护酶,这两种酶共同协调作用以免受外界环境的刺激并维持动态平衡,防止自由基的毒害[13-15]。本试验结果表明,三种杀虫剂处理后稻田拟水狼蛛SOD、POD酶活性均比对照低,差异显著,其中阿维菌素对蜘蛛作用最强。说明三种杀虫剂胁迫使稻田蜘蛛体内的活性氧含量增加,抑制蜘蛛SOD、POD酶活性,这两种酶活性含量大小直接影响蜘蛛对杀虫剂胁迫抵抗能力。本研究结果与徐海伟研究结果[13]一致。
羧酸酯酶和谷胱甘肽转移酶是昆虫体内重要两种解毒酶系,两种酶的活性直接决定对杀虫剂的解毒能力。本研究结果表明,各处理稻田拟水狼蛛解毒酶的含量均相比对照处理低,经阿维菌素处理拟水狼蛛解毒酶活性与对照相比降低最多,其次是吡虫啉,最后是高效氯氰菊酯。综上所述,蜘蛛对杀虫剂的解毒能力较低,恢复能力较慢。这与徐海伟研究结果[13]一致。本试验只对三种杀虫剂进行研究,稻田其他常用杀虫剂对蜘蛛影响还有待进一步研究。
本试验研究不同杀虫剂对不同蜘蛛及其体内酶活性的影响,了解蜘蛛对杀虫剂胁迫抵抗能力及解毒能力高低,增强蜘蛛对药剂抵抗能力,持续发挥天敌自然控制作用。为化学杀虫剂合理使用提供新依据,为稻田害虫可持续控制提供理论依据。
[1] 聂团文.农药胁迫对拟环纹豹蛛等位酶的影响[D].长沙:湖南师范大学,2006.
[2] 姜永厚,吴进才,徐建祥,等.稻田蜘蛛生态位变化及杀虫剂对捕食功能的影响[J].生态学报,2002,22(8):1287-1292.
[3] 许雄,罗玉钊,朱铨铭,等.几种杀虫剂对稻田蜘蛛的毒性试验[J].昆虫天敌,1984,6(1):28-34.
[4] 覃佐一,王智.农药对稻田蜘蛛优势种蛋白水解酶活性的影响分析[J].湖南农业科学,2008(4):102-103.
[5] 王洪全.中国稻田蜘蛛生态与利用研究[J].中国农业科学,1996,29(5):68-75.
[6] 付东波.化学肥料和杀虫剂对寒地稻田节肢动物群落的影响[D].大庆:黑龙江八一农垦大学,2011.
[7] 张宪政.作物生理研究法[M].北京:中国农业出版社,1992.
[8] Byme F J,Devonshire A L.Insensitive acetylcholinesterase and esterase polymorphism in suseeptible and resistance populations of the tobacco whiteflyBemisia ta6aci(Genn.)[J].Pesticide Bio⁃chemistry and Physiology,1993,45:34-42.
[9] 高希武.寄主植物对棉蚜鞍酸醋酶活性的影响[J].昆虫学报,1992,35(3):267-272.
[10] Habig W H,Pabst M J,Jakoby W B.Glutathion S-transferases:the first emymatic step in mereapturie acid synthesis[J].Journal of Biology and Chemistry,1974,249:7130-7139.
[11] 胡自强,王洪全.几种化学农药对稻田优势种蜘蛛杀伤力的研究[J].蛛形学报,2000,11(9):112-113.
[12] 王智,颜亨梅,王洪全.低剂量农药对稻田蜘蛛控虫力的影响[J].生态学报,2002,22(3):346-351.
[13] 徐海伟.杀虫剂诱导下褐飞虱再猖獗的生理生化机制及对非目标物种酶活性的影响[D].扬州:扬州大学,2008.
[14] Soltis P S.phyogenetic relationships and evolution ofCrassulaceainferred from malk sequence data[J].American Journal of Bota⁃ny,2001,88:76-91.
[15] 王曰营.农药胁迫下十字花科蔬菜生理特性与黄曲条跳甲的互作效应[D].福州:福建农林大学,2008.
