丹东猪繁殖与呼吸综合征的流行病学调查
2014-03-11侯洪烈高庆田罗永成姜凤华马海彬
侯洪烈,高庆田,罗永成,姜凤华,马海彬
(1.辽东学院农学院畜牧兽医系,辽宁 丹东118003;2.辽宁省丹东市兽药饲料监察所,辽宁 丹东118000;3.辽宁省丹东市动物疫病控制中心,辽宁 丹东118000)
猪繁殖与呼吸综合征病毒(PRRSV)是目前引起母猪繁殖和仔猪呼吸道疾病的重要病原之一,很难清除和净化。2012年12月,丹东市某猪场先后发生了以怀孕母猪流产、死胎,部分哺乳仔猪出现耳部发绀、神经症状甚至死亡为特征的疾病。该发病场PRRSV的RT-PCR检测,检出率为100%(5/5),确诊为猪繁殖与呼吸综合征(PRRS)。其他猪场也有个别类似病例出现,检测邻近8个规模场PRRSV抗体的血清阳性率,结果在64.0%~95.4%之间;PRRSV的RT-PCR检测阳性率为5.4%(2/37)。结果表明,丹东地区存在PRRSV感染,应加强对猪繁殖与呼吸综合征(PRRS)的免疫,采取综合措施,有效控制该病。
1 材料与方法
1.1 主要仪器 Beckman Allegra 64型高速冷冻离心机,UNO-II型核酸扩增仪(Biometra公司),电泳仪,Thermo MK3酶标仪,DS8000PC凝胶成像及分析系统(英国UVP公司)。
1.2 流行病学调查 对发病规模化养猪场的免疫情况、生产繁殖和发病情况进行了调查。
1.3 血清学检测
1.3.1 发病猪场及其邻近场血清采集 对发病猪场及其邻近场的种猪、后备猪、肉用猪及仔猪分别随机采样。耳静脉无菌采集猪全血2mL,37℃放置1 h,待全血凝固并析出血清后,8 000 r/min离心4min,取上清液,-20℃保存,待检。共采待检血清2 835份。
1.3.2 试剂及检测方法 PRRSV的ELISA抗体检测:PRRS的ELISA抗体检测试剂盒(美国IDEXX公司生产),检测方法按其操作说明书进行,S/P值≥0.4为阳性。S/P值<0.4为阴性。比较不同猪场的血清阳性率。
1.3.3 病原学检测 随机剖检发病猪场及邻近猪场疑似病死猪,无菌采取每头病死猪肺门淋巴结或脾脏,共42份。-20℃保存备用。
取1.5~2 g病料,加少量灭菌PBS(含青霉素、链霉素100 IU(ug)/mL)。无菌研磨至糊状,取PBS按1∶4的体积比稀释,分别在-20℃和37℃反复冻融3次,8 000 r/min(4℃)离心10min,取上清,-20℃保存,待检。
试剂:TRIZol来自AutolabTech公司;DEPC来自Sigma公司;DL-2 000 DNA Marker来自Tiangen公司;AMV反转录酶、Rnase Inhibitor、r Taq DNA聚合酶、dNTPs等,均购自Clontech公司。
引物由Novagen公司合成,序列如下:(PF)5′-CTG AGA CCA TGAGGTGGGCAA CT-3′;(PR)5′-CAT CACTGGCGTGTAGGTAATAGA AAAC-3′,扩增产物预期大小为748 bp。
病毒总RNA提取:取-20℃保存的各病料上清液,按TRIZol LSReagent试剂盒(Invitrogen公司),按操作说明书提取病毒总RNA,15μLDEPC水溶解,-20℃保存待检。
RT-PCR检测:取10μLRNA,加1μL(20 pmoL/μL)下游引物、3.5μL dNTP(2.5mmoL/μL)、0.5μL Rnase Inhibitor(40 u/μL)、1μL LAMV、4μL 5×AMV Buffer,42℃水浴1~2 h,得cDNA模板,之后进行PCR检测。PCR反应体系为:10×PCRBuffer5μL、dNTPs 4μL、上下游引物各1μL、rTaq 0.6μL、cDNA 4μL、加水至50μL,反应参数为95℃变性5min,94℃1min,58℃40 s,72℃50 s,共32个循环;最后72℃延伸10 min。反应结束后,取8μLPCR产物,1%琼脂糖凝胶,100 V、30min电泳,观察结果。
2结果
2.1 发病猪场流行病学调查结果 发病猪场及其邻近8个规模化猪场都有防疫制度。发病猪场除因当时发生其他疫情,未免疫猪繁殖与呼吸综合征灭活苗外,其他免疫程序均与其他猪场大致相同。种猪免疫接种猪瘟兔化弱毒疫苗、口蹄疫疫苗、伪狂犬病灭活苗、猪繁殖与呼吸综合征灭活苗、猪传染性胃肠炎与流行性腹泻二联苗和链球菌苗,细小病毒疫苗仅在后备母猪免疫1次。肉猪均接种猪瘟、口蹄疫、猪肺疫和链球菌疫苗。
发病猪场的繁殖障碍情况:调查86胎,发病24胎,发病率27.9%(24/86);总产仔数1 067,病死仔数357,死亡率33.5%(357/1 067)。母猪产出活仔、死仔和木乃伊胎儿,胎膜污灰、腐臭。母猪产后发情周期紊乱,甚至屡配不孕,反情率80%(36/45)。初产仔猪出现弱仔、畸形胎儿和先天性震颤,个别腹泻,常于生后1~3 d死亡。
病理剖检变化:病死仔猪淋巴结肿大、充血和出血,淋巴滤泡出血和坏死。胸腔有大量清亮或浑浊积液,有的有纤维素状渗出物。间质性肺炎,肺淤血,边缘肝变。肾表面、实质、髓质针尖大出血斑点,脑水肿。组织学检查:肺嗜中性粒细胞浸润,脑干呈亚急性单核细胞性脑炎和血管周围炎,小血管周围“血管套”。
2.2 邻近猪场PRRS血清学检测 检测邻近8个猪场2 835份血清,阳性2 390份,PRRS抗体平均阳性率84.9%,各猪场的抗体阳性率在64.0%~95.4%之间,结果详见表1。
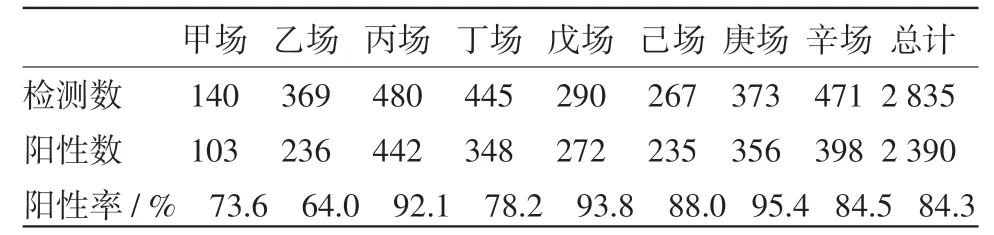
表1 邻近猪场PRRSV血清抗体检测结果
不同猪场PRRSV血清抗体阳性率u检验结果见表2。由表2可见,甲、乙场与平均数差异极显著(|u(uc)|≥2.58),即极显著地低于平均数;丙、戊、庚场也与平均数差异极显著(|u(uc)|≥2.58),即极显著地高于平均数;丁、己、辛场与平均数差异不显著(|u(uc)|<1.96)。总之,这邻近的8个猪场猪的PRRS免疫水平参差不齐。
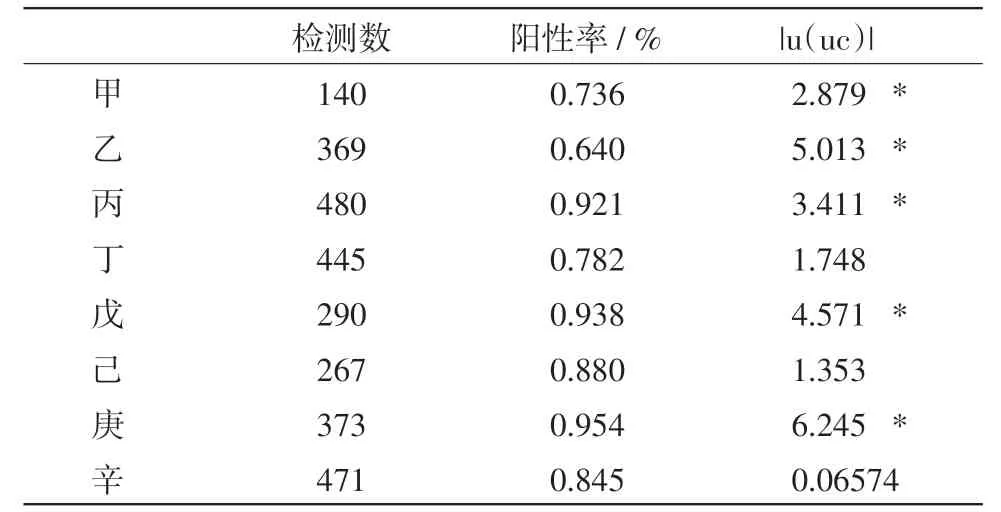
表2 邻近猪场PRRSV血清阳性率比较
2.3 发病及邻近猪场RT-PCR检测 发病场PRRSV的RT-PCR检测阳性率为100%(5/5);邻近猪场疑似病死猪随机采取的病料37份,检出PRRSV核酸阳性2份,检出率为5.4%(2/37),结果详见表3。
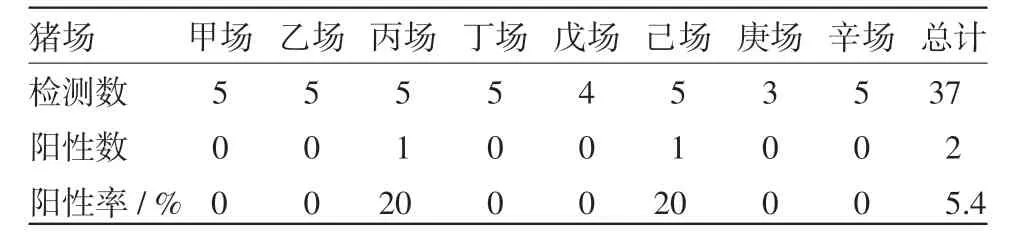
表3 邻近猪场PRRSV的RT-PCR检测结果
3 小结和讨论
3.1 采取综合防制措施 由于PRRS属免疫抑制病,并存在猪只长期隐性感染的可能,要控制该病必须采取综合性防制措施。出现疫情后,立即封锁发病猪场,淘汰阳性猪。及时清洗和消毒猪舍及环境,母猪流产的胎衣、死胎及病死猪严格做好无害化处理,产房彻底消毒。加强饲养管理,防止继发感染。提高猪只的免疫力,对发病猪场周围的猪群紧急接种PRRS灭活疫苗。
3.2 预防其他病原的感染 某些疾病的感染,如猪圆环病毒2型等免疫抑制性疾病,可引起PRRS的免疫失败。虽然本次试验没对这类病原进行确诊,但如何预防此类免疫抑制性疾病的感染,是有效提高PRRSV免疫效果的重要环节之一。
3.3 制定科学的免疫程序 结果证明,虽然检测的猪场均进行过PRRS免疫,但是抗体滴度水平参差不齐,可能养殖场缺乏兽医专业人员,自主免疫不到位等,造成了对PRRS免疫认识不足的漏免现象,最终导致临床发病。所以,应在疫病监测结果基础上制定科学的免疫程序,严格防疫。
3.4 病毒感染监测很必要 PRRSV具有广泛的抗原变异能力,这种变异性不仅表现于不同基因型的PRRSV之间,而且表现于同一基因型的PRRSV不同分离株之间,不同毒株之间抗原的交叉保护是有限的,由于PRRSV各分离株之间存在着广泛的抗原多样性,根据某一PRRSV分离株制备的疫苗是不可能有效地保护猪群对抗具有抗原差异的PRRSV野毒株的感染[2]。而由于基因变异,PRRSV毒力明显增强,会给生猪生产造成严重损失[3]。另外,目前使用的猪蓝耳病免疫抗体检测试剂盒不能区分野毒抗体和免疫抗体。所以,加强该病毒感染监测十分必要。
3.5 药物预防 选择对PRRS及其他病毒性疾病均有一定效果的某些药物进行药物预防。如中药银翘散:主要成分为金银花、连翘、淡豆豉、薄荷、荆芥穗等,按每吨饲料添加2~3 kg连喂5~6 d。此外,PRRSV的一个重要生物学特征是主要攻击宿主的单核巨噬系统,可导致免疫抑制甚至失败,所以,可选择黄芪多糖、氟苯尼考、替米考星、强力霉素等药物以预防PRRS引起的并发或继发感染。
[1]韩庆安,许玉静,刘红,等.河北省猪繁殖与呼吸综合征病毒隐性感染情况的调查[J].中国兽医科学,2011,41(03):314-319.
[2]LiYu feng,Wang Xing long,Bo Kun tao,etal.Emergenceofahighly pathogenic porcine reproductive and respiratory syndrome virus in mid-eastChina[J].Veterinary Journa,2007,174:577-584.
[3] 张建武,庄金山,袁世山.中国部分地区高致病性猪繁殖与呼吸综合征病毒的分子流行病学研究[J].中国农业科学,2008,41(6):1822-1831。
[4] 刘业兵,王晶钰,薛青红,等.陕西省规模化猪场猪繁殖与呼吸综合征流行病学调查[J].中国动物检疫,2007,24(1):34-35.
[5]熊伟杰.当前猪繁殖与呼吸综合征(蓝耳病)的流行特点及其综合防控措施[J].福建畜牧兽医,2011,33(5):42-43.
