猪痢疾短螺旋体荧光PCR检测方法的建立与初步应用
2014-03-11高志强凌凤俊乔彩霞张利峰柏亚铎赖平安张鹤晓
张 伟,高志强,李 宁,谷 强,凌凤俊,乔彩霞,蒲 静,张利峰,汪 琳,吴 丹,柏亚铎,安 健,刘 环,赖平安,张鹤晓
(1.北京出入境检验检疫局,北京 通州101113;2.中国兽医药品监察所,北京 海淀100081;3.北京农学院,北京 昌平102206)
猪痢疾(SD)的病原体是一种革兰阴性的厌氧性螺旋体,先后命名为是由猪痢疾密螺旋体(T.h)、猪痢疾蛇形螺旋体(S.h)。现在统一命名为猪痢疾短螺旋体(Brachyspira hyodysenteriae;B.h),目前猪痢疾密螺旋体这一名称由于历史的原因还被广泛使用。该病是猪的一种肠道传染病,以黏液性或黏液出血性腹泻为特征[1]。在猪群中的发病率相当高,病猪生长发育受阻,耗料增加,给各地养猪业造成很大的经济损失。据统计病猪的饲料消耗率为正常猪的2倍,而增重率仅为正常猪的1/2。根据1983年Lysons的统计,为控制猪痢疾在饲料中添加的药物,每头猪花费2.5~2.8美元[2]。根据Wood等(1988)的计算,猪痢疾猪群的饲料消耗,每头上市猪要多花12.6美元,同时每头猪还要多花费2.4美元。在美国估计每年由于猪痢疾而损失6 400万美元[3]。
该病遍布五大洲50多个国家和地区。在我国,许多省、市都有该病的存在,并且一旦传入猪群,若不采取严格的处理措施很难根除。1978年10月,上海口岸在从美国进口的451头商品猪的检疫中确诊猪痢疾后,1979年初又在我国猪只中确诊猪痢疾,并从国内猪只分离得到猪痢疾短螺旋体纯培养,引起我国兽医界的重视,并被列入《中华人民共和国进境一、二类传染病》[4]。目前检测中采用行业标准SN/T 1207-2003《猪痢疾短螺旋体分离培养操作规程》进行病原分离和鉴定,检验周期要两周时间,并且要求严格的厌氧培养监控,因此急需快速、敏感、特异性强的检测方法以替代或者补充该规程。
本研究从动物检疫的实际出发,建立了荧光PCR检测方法用于猪痢疾短螺旋体的快速检测。缩短了该病原的检测周期,并为临床诊断提供快速、敏感、特异性强的检测方法。
1 材料与方法
1.1 试剂及设备
1.1.1 菌株 研究过程中应用到的菌株如表1所示。
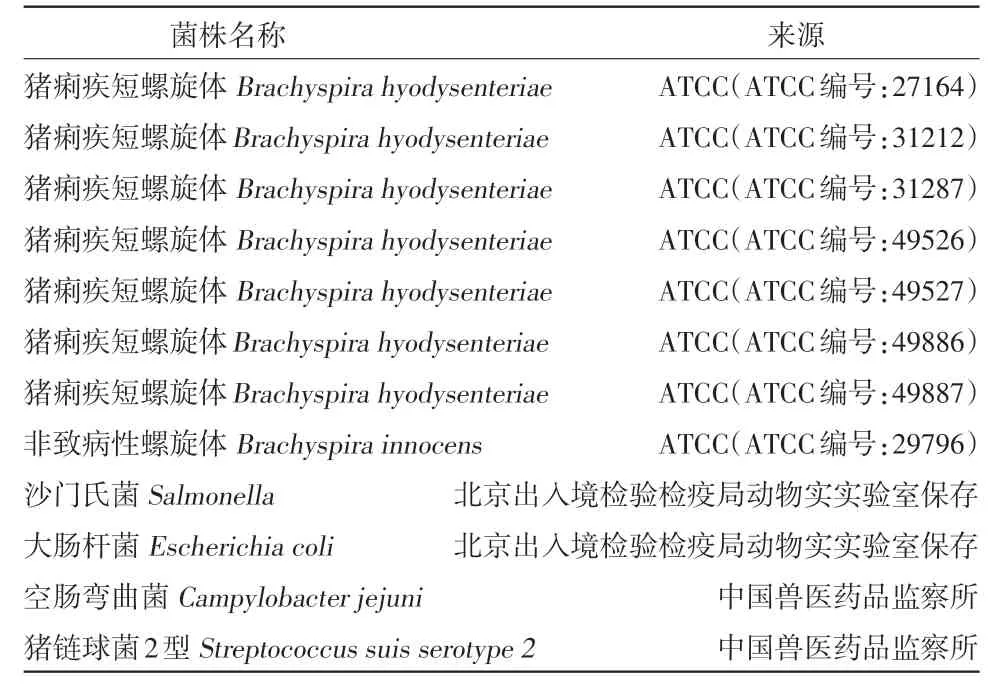
表1 研究过程中应用到的菌株
1.1.2 主要试剂 Taq DNA聚合酶、dNTP等,购自Promega公司;细菌培养基,购自北京陆桥技术有限责任公司;脱纤马血,购自北京希凯创新科技有限公司。
1.1.3 实时荧光定量PCR仪 LightCycler 2.0,Roche公司产品;ABI7900,ABI公司。
1.1.4 厌氧培养系统 COY公司。
1.2 引物探针的设计、合成 选择猪痢疾短螺旋体nox基因作为靶区域,设计引物和探针。引物长度为20个碱基左右,GC含量为50%~60%,引物内无二级结构和重复性,引物间和引物内无互补序列,引物间的熔解温度(Tm值)相差小于5℃。探针的长度在25个碱基左右,Tm值比引物Tm值高5℃左右。引物、探针的名称、序列及扩增基因见表1。引物和探针由上海旭冠生物技术有限公司合成。
1.3 荧光PCR反应体系的建立 以猪痢疾短螺旋体Brachyspira hyodysenteriae(ATCC编号:31212)的DNA作为扩增模板,对引物浓度,探针浓度,Mg2+浓度,Taq DNA聚合酶用量,循环参数等条件进行优化。
1.3.1 引物和探针浓度的优化 将筛选好的引物浓度从0.1μmol/L至0.8μmol/L以0.1μmol/L为间距递增,探针浓度从0.025μmol/L至0.2μmol/L以0.025μmol/L递增。对引物和探针不同浓度的配比进行了比较。
1.3.2 Mg2+浓度的优化 应用筛选好的引物探针,将Mg2+的浓度从1.0 mmol/L至5.0 mmol/L以0.5 mmol/L为间距递增。对不同Mg2+浓度条件下的扩增进行了比较,其他反应物的量同表2~3。
1.3.3 Taq DNA聚合酶的用量优化 Taq酶用量(以单位U计)分别选取0.75 U、1.25 U和2.5 U三种用量。
1.3.4 循环参数优化试验 我们针对Roche Light Cycler荧光PCR检测仪,对循环参数的各个方面都进行了优化试验,以期达到最佳扩增效率。在92℃/3 min的预变性之后,对该试验中对变性温度和时间、退火和延伸温度及时间进行了优化试验。我们主要比较了以下几种循环条件的扩增效率:方法A—92℃/10 s,60℃/1min,40个循环;方法B—92℃/15 s,60℃/30 s,40个循环;方法C—94℃/10 s,60℃/1min,40个循环;方法D—92℃/5 s,55℃/5 s,60℃/30 s,40个循环;方法E—92℃/5,55℃/10,65℃/30;40个循环。
1.3.5 扩增时循环次数的确定 扩增时,采用循环次数分别为40、45和50,比较扩增结果的Ct值,进而确定扩增的循环次数。
1.4特异性试验 提取Brachyspira hyodysenteriae(7株)和Brachyspira innocens、沙门菌、大肠杆菌、空肠弯曲菌和猪链球菌的DNA做为模板,采用优化好的方法对提取的DNA进行荧光PCR检测,以确定检测方法的特异性。
1.5 敏感性和重复性试验 选取一株B.h(ATCC编号为:31212),参照行业标准SN/T 1207-2003《猪痢疾短螺旋体分离培养操作规程》进行纯培养,收集纯培养的B.h,用从猪场采集的猪粪作为载体,用pH值7.4的PBS作为稀释液进行10倍梯度稀释,制备模拟阳性标准品,采用细胞计数板计算每个稀释度的病原数。稀释后,得到B.h的浓度分别为105,104,103,102,101,1.0菌/200μL。模拟样品按照建立的荧光PCR方法进行检测,每个样品设置一个重复,以验证试验的重复性。
1.6 临床样品检测 参照行业标准SN/T 1207-2003《猪痢疾短螺旋体分离培养操作规程》对从北京周边8家猪场的351份猪粪拭子样品进行病原分离及鉴定。采集的样品同时按照建立的荧光PCR方法进行检测。
2 结果
2.1 引物和探针的设计 对设计的引物和探针经BLAST验证,表明可覆盖所有已公布的猪痢疾短螺旋体的菌株。所合成的引物和探针见表2。
对引物探针筛选的结果为选取引物对U1 nox、L1 nox与探针PROBE nox 2的组合用于后续试验。

表2 引物、探针的名称、序列及扩增基因片段
2.2 荧光PCR的反应条件的优化结果 对各种反应条件进行优化发现,最适反应总体积25μL(ROCHE 2.0)或50μL(ABI7900),其中模板5.0μL(ROCHE 2.0)或10μL(ABI7900);最适的引物浓度均为0.2μmol/L,探针浓度均为0.1μmol/L,Mg2+浓度为3mmol/L,选定1.25 U Taq酶作为使用的Taq酶量;最适循环参数为方法D。
优化后的特异性的扩增曲线见图1,从图1可以看出,优化后的反应体系扩增的Ct值相对较低,且升幅较高,同时具有良好的重复性。
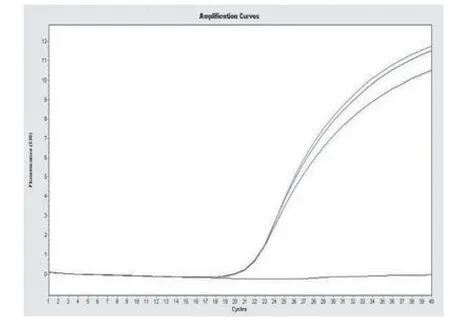
图1“nox组合”优化后的特异性的扩增曲线
2.3 特异性试验 结果见图2(a、b)。结果显示两种引物探针的组合针对7株从ATCC引进的B.h均出现了特征性的扩增曲线,其他几株肠道致病菌结果均为阴性。由此证明方法有较强特异性。
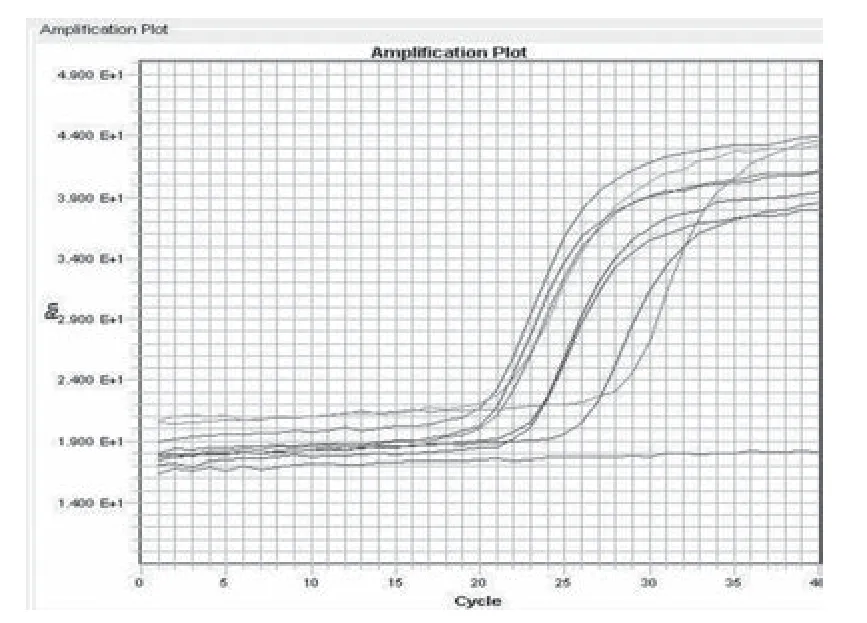
图2a nox组合特异性试验(7株B.h)
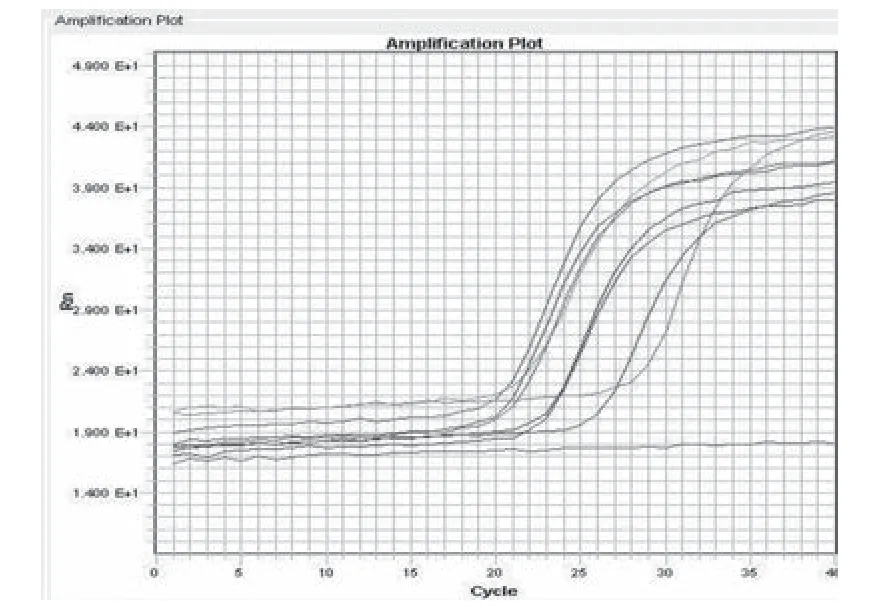
图2b nox组合特异性试验
2.4 敏感性和重复性试验 对稀释的阳性标准样品(105-1.0菌/200μL)进行荧光PCR检测,结果如图3所示(扩增曲线对应的样品浓度从左至右依次为105-1.0菌/200μL)。结果表明,荧光PCR对系列梯度稀释的阳性标准品进行检测,在B.h浓度为101菌/200μL时,有较弱的扩增曲线,1.0菌/200μL浓度时无特异性扩增曲线。故PCR对猪痢疾短螺旋体模拟样品最低可检测至B.h浓度101菌/200μL。
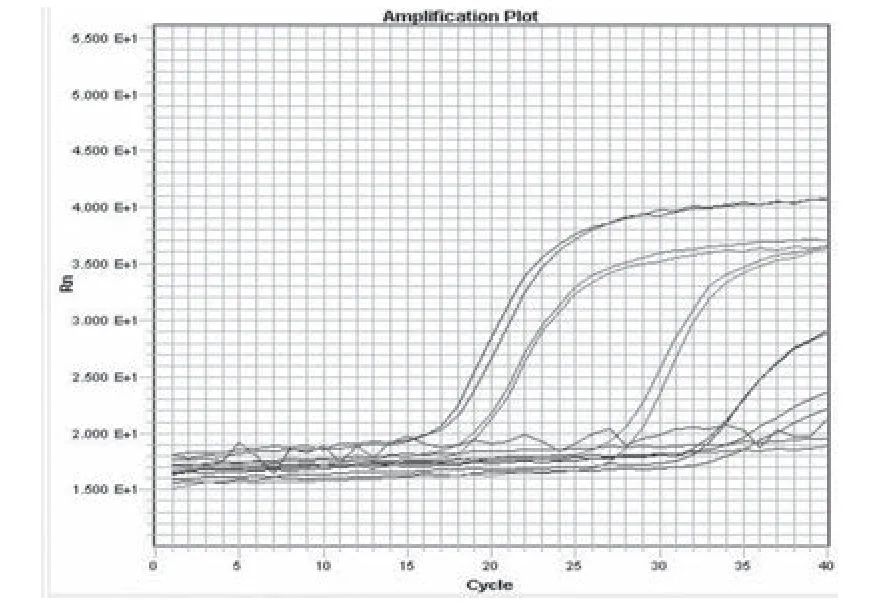
图3 敏感性和重复性试验
2.5 临床样品的检测 对北京周边8个猪场采集的351份猪粪拭子进行检测。结果如表3所示,与传统分离培养鉴定的符合率为100%。该方法的可以在4 h内完成检测,大大缩短了检验周期,与传统的病原分离培养结果完全一致,证明该方法是一种快速、准确、特异性强的的检测方法。
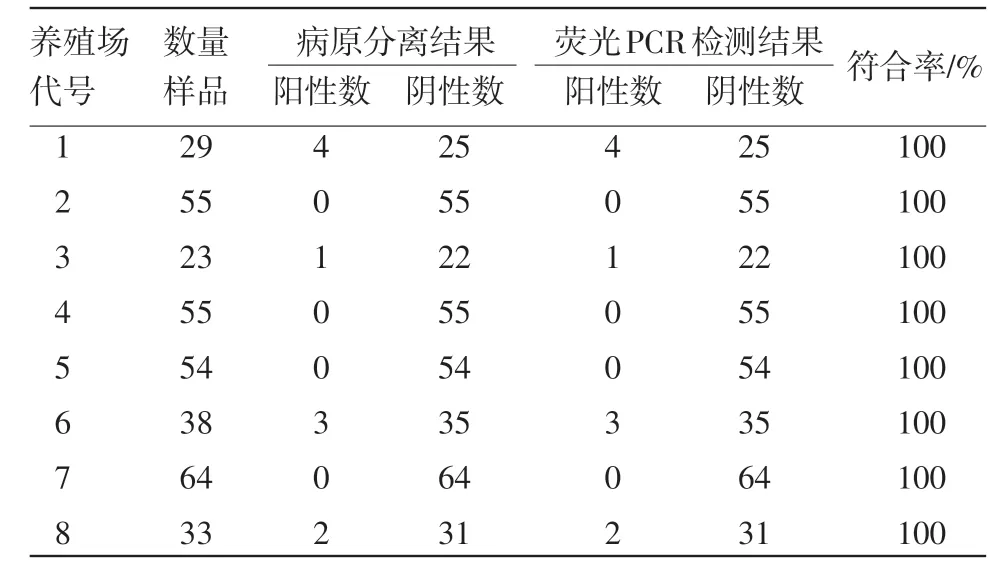
表3 临床样品检测
3 结论与讨论
猪痢疾在猪群中的发病率很高,病猪生长发育受阻,耗料增加,给各地养猪业造成很大的经济损失。目前除了病原分离外没有特异性好、敏感性高的检测方法在我国广泛使用。由于该病的病原需要严格的厌氧培养条件,对于该病的研究还比较少。尽管经典检测方法仍为病原分离鉴定,但国内外越来越多的实验室均采用核酸检测方法进行病原检测[1]。
本试验选择猪痢疾短螺旋体nox基因作为靶基因,设计引物和探针建立了猪痢疾短螺旋体荧光PCR检测方法。用所建立的方法对以10倍梯度稀释的猪痢疾短螺旋体培养物进行检测,结果显示灵敏度可达101菌/200μL;重复性试验结果显示所建立方法的稳定性良好;建立的两种猪痢疾短螺旋体荧光PCR检测方法在检测所收集的猪痢疾短螺旋体全部为阳性,但检测其他细菌的结果为阴性,未发现交叉反应。表明该方法敏感性高、特异性强。
用该方法对8个猪场采集的351份猪粪拭子进行检测。荧光PCR检测方法与分离培养鉴定法的符合率为100%,并且检验周期为小于4 h,进一步验证了所建立的方法具有快速、灵敏、准确、特异性强的特点。
传统的分离培养及鉴定的方法检验周期长,一般需要10 d左右的时间,并且由于猪痢疾短螺旋体是一种厌氧菌,分离培养需要严格的厌氧环境,对实验室的要求也非常苛刻,操作复杂。大量的试验数据表明,本试验所建立的两种荧光PCR检测方法与传统的病原分离培养鉴定法(金标)在敏感性和特异性上无显著差别。但与分离培养鉴定法相比其快速的特点就非常突出。可以大大缩短检验周期,同时可以有效地避免由于样品采集、运输过程中造成病原分离失败的假阴性结果。
随着荧光PCR技术被广泛认可。本试验所建立的荧光PCR检测方法可以在进出境检测以及日常的临床疫病监控和诊断中发挥更加积极地作用。
[1]David J,Hampson C,Fellstrom Jill Thomson.Swine Dysentery Diseasesof Swine 9th edit:895.
[2]Lysons R J,Lemcke R M.Swine dysentery:to isolate or to fluo⁃resce[J].Vet Rec.1983,112(9):203.
[3]Wood E N,Lysons R J.Financial benefit from the eradication of swine dysentery[J].VetRec.1988,122(12):277-279.
[4] 覃青松,金梅林,刘建杰,等.猪痢疾短螺旋体综述[J].2002,297:306-310.
