兔多杀性巴氏杆菌外膜蛋白OMPH 1基因的克隆及原核表达
2014-03-11裴志花高云航马红霞孟轲音
裴志花,高云航,马红霞,王 开,孟轲音
(1.吉林农业大学动物科学技术学院,吉林 长春130118;2.军事医学科学院军事兽医研究所,吉林 长春130122)
兔巴氏杆菌病是由多杀性巴氏杆菌(Pm)引起的,主要侵害家兔呼吸系统的疾病。该病的发病率和死亡率都很高,对养兔业的危害和导致的经济损失日益严重,目前已成为危害养兔业最严重的传染病之一。预防该病的商业疫苗主要有全菌苗、类毒素苗和减毒活疫苗,但它们不能提供或只能提供有限的异源保护,还有可能造成兔巴氏杆菌病的暴发。因此,探寻更为安全有效的新型疫苗来预防兔巴氏杆菌病势在必行。
研究表明,多杀性巴氏杆菌外膜蛋白(Outer membrane proteins,OMPs)是主要免疫原,应用外膜蛋白制备的疫苗对小鼠、鸡和兔进行免疫,显示了明显的保护力[1-4]。OMPH是Pm最主要的外膜蛋白之一,属于孔蛋白,OMPH能诱导动物机体产生高水平的保护性抗体,是交叉保护应答中最重要的抗原[5-7]。
试验选择购自中国兽医药品监察所的兔多杀性巴氏杆菌标准株C51-2-499株的OMPH1基因作为研究对象,进行PCR扩增、克隆及序列分析并构建原核表达载体,为进一步进行ELISA检测及开展相关的免疫研究奠定了基础。
1 材料与方法
1.1 菌株、质粒和抗体 兔多杀性巴氏杆菌标准株C51-2-499,购自中国兽医药品监察所;表达载体pET30a、菌株DH5α及BL21(DE3),均由本实验室保存;pMD-18T载体,购自宝生物工程(大连)有限公司。
1.2 主要试剂 DNA提取试剂盒、ExTaq聚合酶、限制性内切酶BamHⅠ、XhoⅠ、T4 DNA连接酶、IPTG、DNA Marker,均为宝生物工程(大连)有限公司产品;DNA快速回收试剂盒,购自上海生工生物工程技术服务有限公司;一抗为兔源多杀性巴氏杆菌免疫家兔制备的多克隆抗体,由本实验室制备;二抗为辣根过氧化物酶标记的绵羊抗兔IgG,购自北京鼎国昌盛生物技术有限责任公司。
1.3 表达引物的设计 参考已发表的序列,用Primer5.0软件设计上下游引物,并分别在两5′端引入BamHⅠ和XhoⅠ酶切位点。引物序列如下:P1:5′-TGGATCCATGAAAAAGACAATCGTAC-3′,P2:5′-ATCTCGAGTGTACGCGTAAACCT-3′,引物由上海生工生物工程技术服务有限公司合成。
1.4 目的基因的克隆
1.4.1 兔多杀性巴氏杆菌总DNA的提取 取2mL增菌液于微量离心管中,6 000 r/min离心5min,收集沉淀。将沉淀用500μL NET缓冲液溶解并于80℃水浴15min;从水浴锅中取出微量离心管室温放置2min后加入12μL溶菌酶,37℃消化4 h;再次取出离心管室温放置2min,加入蛋白酶K、RNA酶50℃过夜消化;用等体积的酚-氯仿-异戊醇(体积比为25∶24∶1)混合物抽提2次,再用无水乙醇洗涤2次,放入温箱中使离心管内壁干燥;加入50μL无核酸酶的TE缓冲液溶解,置于-20℃冰箱中备用。
1.4.2 目的片段的扩增、克隆、重组质粒的鉴定及序列分析 以提取的总DNA为模板进行PCR扩增,电泳检测扩增结果。将PCR产物纯化回收后与pMD-18T载体连接,转化DH5α感受态细胞,提取质粒,经PCR和酶切鉴定,筛选出阳性克隆。将阳性克隆送上海生工生物工程技术服务有限公司测序,此重组质粒命名为pMD-OMPH1。利用DNAMAN软件对测得的序列与不同动物来源的多杀性巴氏杆菌OMPH基因序列进行比对分析。
1.5 重组表达载体的构建及鉴定 用BamHⅠ和XhoⅠ从pMD-OMPH1上双酶切下目的基因片段,纯化回收后分别与用同样双酶切的pET30a相连,转入BL21后挑斑提取质粒,重组质粒经酶切及PCR扩增进行鉴定,筛选出阳性克隆,重组质粒命名为pET30a(+)-OMPH1。送上海生工生物工程技术服务有限公司对插入的DNA片段测序,以确证读码框是否正确。
1.6 重组质粒在大肠杆菌中的诱导表达及表达产物的SDS-PAGE检测 将pET30a(+)-OMPH1阳性质粒转化至BL21中,挑取单克隆菌将其放入5mL含氨苄青霉素的LB液体培养基中,37℃250 r/min培养过夜后取200μL接种于100mL的LB培养液中进行重组菌的扩大培养,37℃250 r/min培养至OD600值至0.6-0.8时,加入异丙基硫代-β-D-半乳糖苷(IPTG)进行诱导表达。将收集的1.5mL菌液以10 000 r/min离心1min,弃上清液后用100μL pH值8.0的TE缓冲液悬浮,反复冻融3次后,取28μL样品加入7μL的5×上样缓冲液,水浴煮沸5min后进行上样电泳,并以相同条件下诱导的空载体菌液作为阴性对照。电泳结束后用考马斯亮蓝染色2-3 h,再脱色至底色褪去后观察目的蛋白条带,以蛋白质Marker进行比较,以确定目的带的位置。
1.7 表达产物的Western-blotting检测 表达产物经SDS-PAGE后,将凝胶转移至NC膜上进行免疫印迹,一抗为兔多杀性巴氏杆菌免疫兔制成的超免血清,二抗为HRP标记的绵羊抗兔IgG,用底物二氨基联苯胺(DAB)和过氧化氢显色。
2 结果
2.1 目的基因的克隆与鉴定 PCR反应后得到1条约1 040 bp的目的片段。之后将目的基因克隆到pMD-18T载体上,测序分析表明,该基因序列与GenBank登录的Pm OMPH1基因的核苷酸序列完全一致。
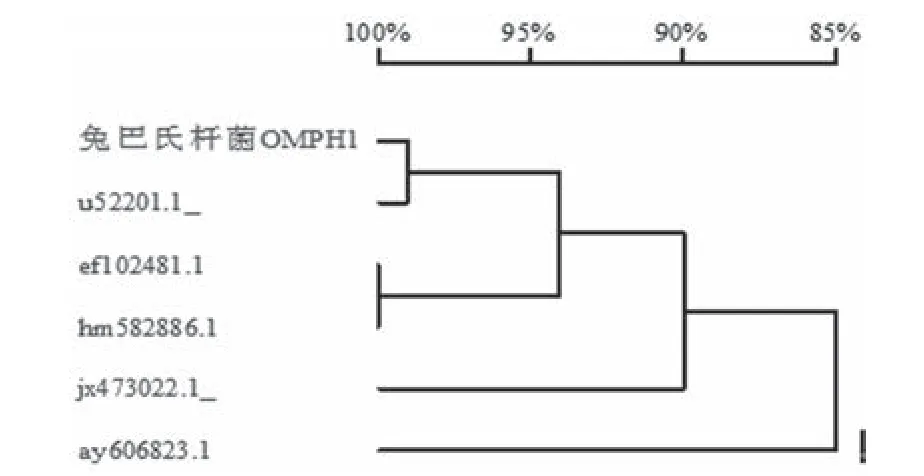
图1 多杀性巴氏杆菌om pH1基因的同源性分析
2.2 核苷酸序列分析 利用DNAman软件对测得的序列与不同动物来源的多杀性巴氏杆菌OMPH基因序列进行比对分析,结果显示(图1)兔多杀性巴氏杆菌OMPH1基因与鸡P-1662株(U52201.1)OMPH基因的同源性最高,基因序列相似性高达99%,与绵羊(JX473022.1)、牛(HM582886.1)、猪(EF102481.1)、和鸭(AY606823.1)源多杀性巴氏杆菌OMPH基因的同源性都很高,均>85%。
2.3 重组表达载体的构建 用BamHⅠ和XhoⅠ从pMD-OMPH1上双酶切下目的基因片段,连接到用同样双酶切的表达载体PET30a(+)上,BamHⅠ和XhoⅠ双酶切分析表明,目的基因已正确插入表达载体(见图2)。对筛选出的阳性克隆经宝生物工程(大连)有限公司测序,证实目的基因已正确插入到表达载体的阅读框中。
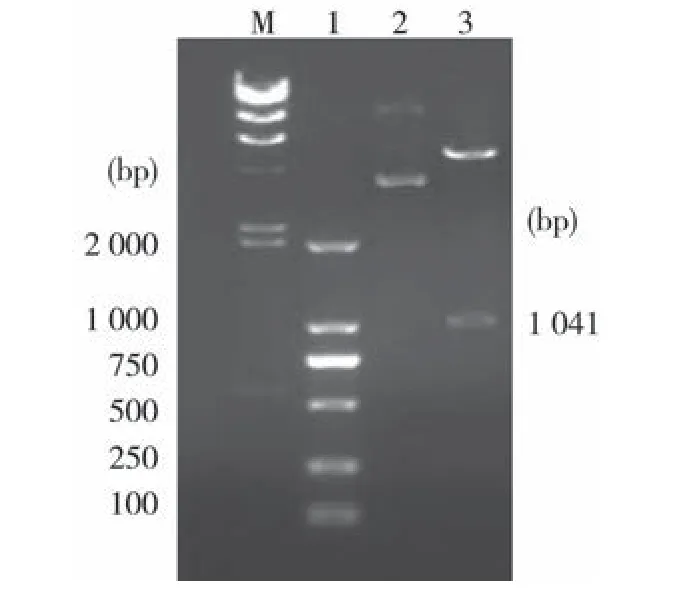
图2 重组表达质粒的酶切鉴定
2.4 OMPH1基因在大肠杆菌中的诱导表达及表达产物的检测 将pET30a(+)-OMPH1阳性质粒转化至BL21中,经IPTG诱导后、SDS-PAGE电泳、考马斯亮蓝染色、脱色后发现诱导菌在47.0ku处有一条目的条带,与预期的目的蛋白大小一致(见图3a),以同样条件诱导的pET-30a(+)-BL21则没有出现这一条带,初步证明OMPH1基因得到了表达。
2.5 Western-blot分析 原核表达的OMPH1融合蛋白SDS-PAGE电泳后,进行Western-blotting检测时,出现了1条特异性的抗2抗体结合带(见图3b),根据分子质量的大小推测,这条带的分子质量与目的蛋白的分子质量相同,从而证明表达的目的蛋白是OMPH1蛋白。
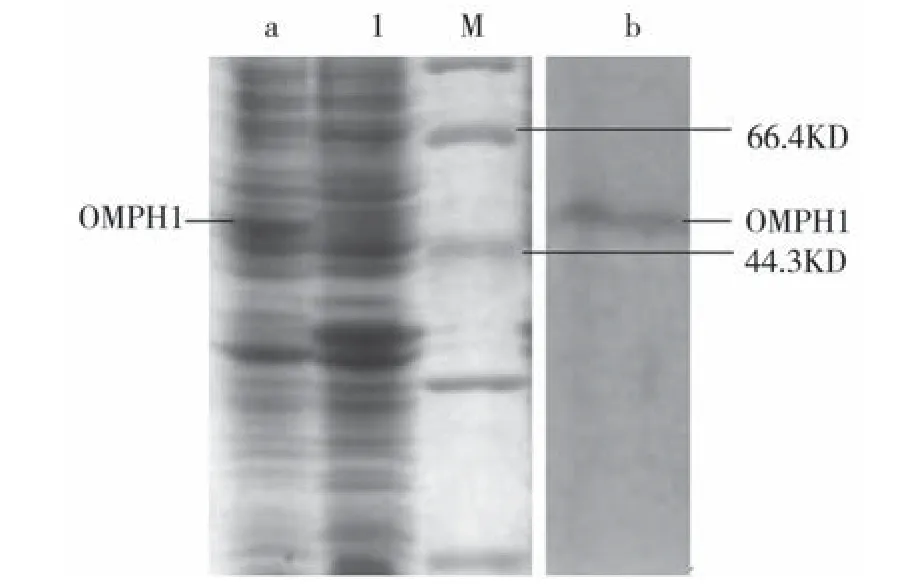
图3 OMPH1基因表达产物的分析
3 讨论
OMPH是多杀性巴氏杆菌菌体最主要的外膜蛋白之一,不同血清型的Pm OMPH蛋白具有很高的同源性,而其异源性主要源于318~333位上部分氨基酸的变异,而大部分的变异又集中在60-80aa和200~220aa两个不连续的超变区。OMPH蛋白也是多杀性巴氏杆菌的一种主要的保护性抗原,能诱导很高水平的保护性抗体。兔多杀性巴氏杆菌OMPH蛋白编码基因分为OMPH1基因和OMPH2基因两部分,Garrido等从A血清群中鉴定了2个OMPH(OMPH1和OMPH2),经验证这两个基因的基因组是连续的并且可以独立转录的[5],其大小均为1 000 bp左右。本试验针对Pm OMPH1设计引物,进行目的基因的克隆,成功构建了兔多杀性巴氏杆菌OMPH1基因原核重组表达载体,并进行了IPTG诱导表达,初步证明OMPH1基因获得了高效表达。表达产物经SDS-PAGE后转移至NC膜上进行免疫学反应,显色后可见明显条带,这表明表达蛋白能被兔多杀性巴氏杆菌阳性血清所识别,也证明了该表达蛋白具有免疫学活性,为兔多杀性巴氏杆菌诊断试剂和新型疫苗的研究奠定了良好的基础。
目前,有人已开展了猪[8]、鸡[9]、鸭[10]、牛多杀性巴氏杆菌OMPH的相关研究,而针对兔源Pm OMPH的相关研究,尚未见到。本试验通过PCR方法成功扩增出1 041 bp的兔Pm OMPH1目的片段,将目的基因克隆到pMD-18T载体上。测序分析表明,该基因序列与GenBank登录的Pm OMPH1基因的核苷酸序列完全一致,确定该基因为Pm OMPH1基因。利用DNAman软件对测得的序列与不同动物来源的多杀性巴氏杆菌OMPH基因序列进行比对分析,结果显示兔多杀性巴氏杆菌OMPH1基因与鸡(U52201.1)、绵羊(JX473022.1)、牛(HM582886.1)、猪(EF102481.1)、和鸭(AY606823.1)源多杀性巴氏杆菌OMPH基因的同源性都很高,均>85%。以表达载体pET-30a(+)为基础,成功地将pET-30a(+)-OMPH2阳性质粒转化至BL21(DE3)中,为进一步研究兔多杀性巴氏杆菌CVCC500株OMPH1的免疫原性及OMPH的DNA疫苗奠定了基础。
[1] HatfaludiT,Al-hasaniK,Boyce JD,etal.Outermembrane proteins of Pasteurellamultocida[J].vet.microbial,2010,144(1):1-17.
[3] 肖国生,曹三杰,黄小波,等.猪多杀性巴氏杆菌5:A型Ts-8株psl基因的克隆和序列分析[J].河南农业科学,2008,4,108-114.
[4] Garrido M E,Bosch M,Bigas A,et al.Heterologous protective immunization elicited inmice by Pasteurellamultocida fur ompH[J].IntMicrobiol,2008,11(1):17-24.
[6] 孙颖.App菌影装载多杀性巴氏杆菌OMPH外膜蛋白DNA疫苗的研究[D].天津:天津农学院,2011.
[7] 宫强,牛明福,王帅涛,等.禽巴氏杆菌OMPH外膜蛋白DNA疫苗的免疫效果[J].中国免疫学杂志,2010,26(1):13-16.
[8] 李良军,黎璐,李健,等.猪源产毒素多杀性巴氏杆菌HN-13株外膜蛋白H的基因克隆与特征[J].农业生物技术学报,2007,15(2):183-191.
[10] 曹素芳,黄青云,韩先干,等.禽多杀性巴氏杆菌C48-1外膜蛋白H基因真核表达载体的构建[J].中国兽医科技,2005,35(2):117-120.
