感染旋毛虫小鼠心肌能量代谢变化的检测
2014-03-11许圆圆韩彩霞路义鑫李兴超宋铭忻
许圆圆,李 巍,韩彩霞,路义鑫,李兴超,宋铭忻
(1.哈尔滨医科大学,黑龙江 哈尔滨150086;2.东北农业大学,黑龙江 哈尔滨150030)
正常的心脏能量代谢是维持心脏内环境稳定和组织结构不断更新的物质基础,对维持心脏功能具有重要的意义。过氧化物酶体增殖物激活受体(PPARs)是配体活化的核转录因子,其中PPARα主要分布在心脏、肝、肾等组织,调控脂肪酸代谢。研究证明,PPARα受体激活在糖尿病心肌肥大的发展中起保护作用,但对其研究主要集中在心肌能量代谢调控等方面[1]。心肌局部肾素血管紧张素系统(RAS)的主要作用因子血管紧张素Ⅱ(AngⅡ)与心肌肥厚的发生密切相关[2]。机体多种组织细胞膜上均存在胰岛素受体(IR),胰岛素对缺血心脏可能具有“拟硝酸甘油”样效应,进而发挥心血管保护效应[3]。
旋毛虫在心肌组织呈一过性游走,并不在此寄生,但现大量临床症状显示,旋毛虫的重度感染也能够引起宿主的心肌损伤,并因心肌炎等病症而导致感染者死亡[4]。因此,本试验以大剂量旋毛虫经口感染昆明系小鼠,建立旋毛虫重度感染小鼠心肌损伤模型,通过对小鼠心肌AngⅡ、PPARα和胰岛素含量的检测,探讨旋毛虫感染小鼠心肌能量代谢变化的规律,为旋毛虫病的早期诊断、治疗提供基础数据。
1 材料与方法
1.1 虫种 旋毛形线虫(Trichinella spiralis),分离自黑龙江逊克猪;由本教研室保种。
1.2 实验动物及试剂 昆明系小鼠,雌雄各半,体重20~22 g,购自哈尔滨医科大学附属第二医院实验动物中心;AngⅡELISA检测试剂盒、PPARs、ELISA检测试剂盒和小鼠组织胰岛素ELISA检测试剂盒,均购自南京建成生物工程研究所。
1.3 感染旋毛虫小鼠心肌组织标本制备 取保种用旋毛虫肌幼虫,经口感染24只昆明系小鼠,剂量为1 000蚴/只,对照组3只口服生理盐水。于感染后3、9、14、19、24、29、34 d和49 d从感染组随机取出4只小鼠,剖杀并无菌取出心脏,一部分置-80℃冰箱备用,另一部分在匀浆管中均质化,离心取上清,-80℃备用。
1.4 心肌能量代谢动态检测 小鼠心肌AngⅡ、PPARα和胰岛素的检测,按照检测试剂盒说明书进行操作。
1.5 试验数据的统计分析 试验数据采用平均数±标准差(X±SD)表示,数据用SPSS统计软件处理,试验组与对照组、试验组中各分组之间的比较均采用ANOVA,Dunnett′T方法,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果
旋毛虫感染小鼠心肌组织AngII、PPARs和胰岛素含量的检测结果显示,旋毛虫感染后,AngII、PPARα及胰岛素检测结果均呈现相似趋势,至19~24 d出现峰值,随后下降(表1、图1)。

表1 血管紧张素Ⅱ、过氧化物酶体增殖物激活受体和胰岛素含量的检测 (n=3)
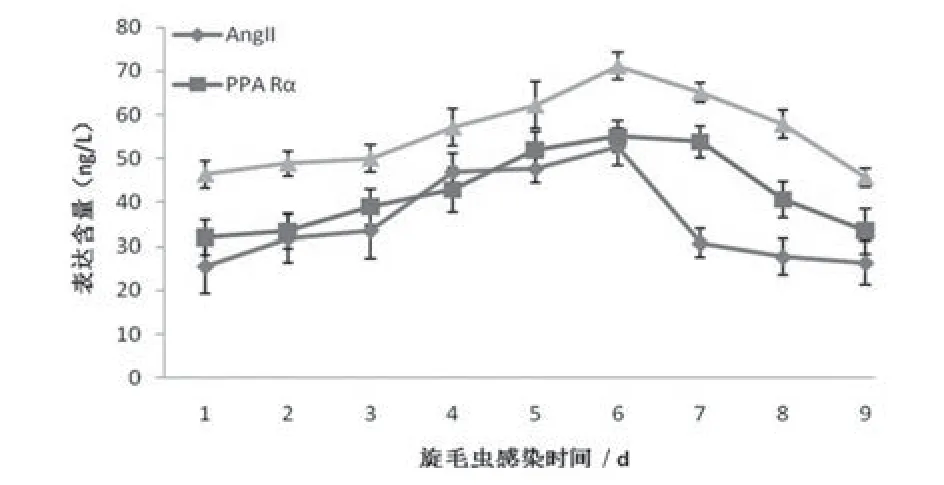
图1 血管紧张素Ⅱ、过氧化物酶体增殖物激活受体、胰岛素含量的检测结果(n=3)
3 讨论
心肌局部肾素血管紧张素系统(RAS)的主要作用因子AngⅡ与心肌肥厚的发生密切相关。研究表明,AngⅡ对心肌成纤维细胞的代谢功能具有重要的作用,AngⅡ促心肌细胞肥大的作用主要是通过心肌成纤维细胞介导的[5]。AngⅡ引起心肌细胞肥大的作用机制可能是AngⅡ作用于心肌成纤维细胞表面AT1受体,使其产生某些生长因子如ET-1、TGF-β1,以旁分泌的形式作用于心肌细胞。AngⅡ既有促心肌细胞肥大又有促凋亡作用[6],即同时诱发心肌细胞凋亡[3]。因此,AngⅡ在感染旋毛虫引起的心肌凋亡中也将起到重要作用。本研究结果显示,旋毛虫感染小鼠后,AngII至19~24 d出现峰值,随后下降。AngⅡ在旋毛虫感染小鼠心肌中的变化趋势提示,其变化规律可能与活性氧激活核转录因子κB(NF-κB)介导心肌损伤有关,NF-κB是AngⅡ的前体-血管紧张素原再合成的重要调节因子,NF-κB促进血管紧张素原的表达从而促进AngⅡ的表达,血管紧张素又能诱导NF-κB的表达,二者相互促进。AngⅡ表达量的上升说明其参与了心肌损伤。
PPARα对于调节全身组织能量代谢有极其重要的意义,尤其是脂肪酸及葡萄糖代谢。PPARα参与脂质代谢、促进脂肪细胞分化的基因转录,增加脂肪酸转运蛋白和脂肪酸转运酶表达,刺激细胞对脂肪酸的摄入及向脂酞coA转化。PPARα与配体结合后,通过调整下游基因表达,可增强胰岛素的反应性及组织摄取糖,具有明显改善心肌能量代谢的作用。本研究显示,心肌细胞胞浆内PPARα水平均明显增高,提示心肌损伤过程中,脂肪酸转运加剧。也有研究表明,PPARs激活时通过抑制NF-κB和激活蛋白-1(AP-1),引起下游细胞因子表达减少而起抗炎和抗氧化作用。
机体多种组织细胞膜上均存在胰岛素受体(IR),其中心肌细胞膜上含有丰富的IR,是典型的胰岛素靶细胞。胰岛素在细胞水平的作用是由胰岛素与其靶细胞膜IR结合而启动的[7]。研究发现,胰岛素通过PI3K-Akt信号转导途径不仅可影响细胞糖代谢,还可抑制氧化应激的缺血/再灌注诱导的心肌细胞凋亡,进而发挥心脏保护作用[8]。也有报道称胰岛素可通过PI3K-Akt途径激活人冠状血管内皮eNO,使冠状血管NO产生增加[9]。研究结果提示,胰岛素对缺血心脏可能具有“拟硝酸甘油”样效应,即胰岛素可发挥心血管保护效应。这一发现从另一角度再次提示胰岛素对心肌细胞凋亡的保护作用。本研究结果为旋毛虫病的早期诊断、治疗提供基础数据。
[1] 宋默薇,赵进军.糖代谢异常与糖尿病心肌病[J].心血管病学进展,2005,2(26):147-149.
[2]Chen Lili,Guo Xiaomei,Yang Fei.Role of heart-type fatty acid binding protein in early detection of acutemyocardial infarction in comparison with cTnI,CK-MB and myoglobin[J].Journal of Hua⁃zhong University of Science and Technology,2004,24(5):449-451.
[3] Kong JY,Rabkin SW.Palmitate-induced cardiac apoptosis is mediated through CPT-1 butnot influenced by glucose and insulin[J].Am JPhysiol Heart Circ Physiol,2002,282(2):717-725.
[4] 戴晓冬,崔昱.旋毛虫病鼠心肌及血清氧自由基变化的实验观察[J].中国微生态学杂志,2003,15(2):82-84.
[5] Listenberger L L,Schaffer JE.Mechanisms of lipoapoptosis:im⁃plications for human heart disease[J].Trends CardiovascMed,2002,12(3):134-138.
[6]Pavlovsky Z,Vagunda V.Apoptosis-selectedmethods of detection of apoptosis and associated regulatory factors on tissue sections of tumors[J].Cesk Patol,2003,39(1):6-10.
[7]王新利,崔勤.体外循环诱发急性心肌胰岛素抵抗的研究新进展[J].中国体外循环杂志,2011,9(2):118-120.
[8]王浩.胰岛素抵抗与心功能损害[J].海军总医院学报,2007,20(3):164-167.
[9]Federiei M,Hribal M,Perego L.High glucose causes apoptesisin cultured human pancreatic islets of Langerhans:a potential role for regulation of specific Bcl family genes toward an apoptotic cell death program[J].Diabetes,2001,50(6):1290-1301.
